吴茱萸碱超微粉-F68 固体分散体溶出研究
2015-01-09杨红梅唐安玲
杨红梅,盛 蓉,宋 英,曹 蕾,唐安玲
1成都中医药大学,成都 610075;2 成都中医药大学附属医院,成都 610072
吴茱萸碱(Evodiamine,EVO)是中药吴茱萸的主要活性成分[1]。研究表明EVO 具有抗炎、镇痛、降血尿酸的作用[2],但EVO 属于生物药剂学分类系统(BCS)二类的难溶性药物,溶出速率是制约其生物利用度的关键因素[3]。固体分散体是提高难溶性药物的溶出速度,改善难溶性药物生物利用度[4-5]的有效方法之一。本实验制备了吴茱萸碱分散体并对其体外溶出进行了相关研究。
1 仪器与材料
1.1 仪器
HP1100 型高效液相色谱仪(美国惠普),四元泵,DAD 检测器,HP 化学工作站;色谱柱:依利特C18(150 mm×4.6 mm,5 μm);BP211D 型分析天平(德国赛多利斯);DLXW-S-8 电热恒温水浴锅(北京市永光明医疗仪器厂);JB-3 磁力搅拌器(上海雷磁仪器有限公司)。
1.2 材料
EVO 对照品(中国药品生物制品鉴定所,批号110802-200606);EVO 原料药(西安冠宇生物技术有限公司,批号GY20070603,纯度≥98%);泊洛沙姆188(F68,德国巴斯夫(中国)有限公司),批号03000242876);十二烷基硫酸钠(SDS,汕头市西陇化工厂,批号090619);辅料均为药用标准。
2 实验方法
2.1 EVO 固体分散体的制备
取F68 过80 目筛90 g 与10 g EVO 超微粉混合均匀,于水浴锅上(80 ℃)研磨搅拌30 min,立即倒入预冷的不锈钢盘上,迅速放置于-20 ℃冰柜中,冷却固化4 h,取出放置干燥器中平衡24~48 h,粉碎过筛(60 目),并同法制备EVO 原料药-F68 固体分散体备用。另取F68 过80 目筛45 g,与5 g 的EVO超微粉混合均匀,得EVO 超微粉与F681∶9 的物理混合物,于干燥器中备用。
2.2 EVO 不同处理方法水中平衡溶解度的测定
研究表明,吴茱萸碱在不同pH 条件的溶出介质中,溶出度较小且无显著差异[6],故该试验只考察其在水中的平衡溶解度。取过量的EVO 原料药、EVO 超微粉、EVO 原料药-F68 固体分散体、EVO 超微粉-F68 固体分散体各2 份,均置于250 mL 的具塞锥形瓶中,分别加入100 mL 水,置37±0.5 ℃恒温水浴中,磁力搅拌24 h 后吸取上清液,经微孔滤膜滤过(0.45 μm),取续滤液作为供试品溶液。
2.3 EVO 不同处理方法溶出度的测定
分别取EVO 原料药、EVO 超微粉约10 mg,EVO 超微粉-F68 固体分散体、EVO 超微粉-F68 物理混合物约50 mg,精密称定,参照《中国药典》2010年版二部附录XC 溶出度测定法第二法(浆法)项下的有关规定进行测定。以1% SDS 溶液为溶出介质,转速为100 r/min,放入时开始计时,分别于3、5、10、15、30、45、60 min 时,取溶液10 mL(同时补液10 mL),微孔滤膜(0.45 μm)滤过,精密吸取滤液5 mL,用甲醇定容至10 mL 量瓶,微孔滤膜(0.45 μm)滤过,精密吸取续滤液20 μL 进样,按外标法计算溶出度。
2.4 EVO 超微粉-F68 固体分散体配比考察
分别以EVO 超微粉与F68 按1∶2、1∶4、1∶6、1∶9 按“2.1”项方法制备样品。
供试品溶液的制备 参照《中国药典》2010年版二部附录XC 项下“溶出度测定法”的浆法测定EVO 固体分散物的溶出度。溶出介质为1% SDS,体积为900 mL,温度为37±0.5 ℃,转速为100 rpm。取EVO 固体分散物适量(约相当于EVO10 mg),精密称定,放入时开始计时,于45 min 定位吸取溶液10 mL,吸取液微孔滤膜(0.45 μm)滤过,精密吸取滤液5 mL,用甲醇定容至10 mL,微孔滤膜(0.45 μm)滤过,取续滤液作为供试品溶液。
2.5 固体分散体含量测定
取EVO 超微粉-F68 固体分散体(1 ∶4)约50 mg,共两份,置100 mL 量瓶中,加甲醇适量,超声处理30 min,放冷,定容至刻度,微孔滤膜(0.45 μm)滤过,取续滤液作为供试品溶液,精密吸取5 μL,以色谱柱:依利特柱C18(150 mm×4.6 mm,5 μm);流动相:乙腈∶0.1% 磷酸(含2% 的四氢呋喃)(38∶62);柱温:30 ℃,检测波长:225 nm 色谱条件测定EVO 含量[7-9]。
3 结果与讨论
3.1 不同处理方法对EVO 在水中平衡溶解度的影响
EVO 原料药和超微粉在水中几乎不溶,EVO 超微粉-F68 固体分散体对EVO 水中溶解度提高最大,高出EVO 原料药-固体分散体和EVO 超微粉-F68物理混合物约3~5 倍。由此可见,固体分散体能使药物保持高度分散状态,加快药物的溶出;F68 是固体分散体中使EVO 增加溶出的主要因素。测定结果见表1。

表1 不同样品水中的平衡溶解度测定结果(n=2)Table 1 Determination results of equilibrium solubility in water of different samples (n=2)
3.2 不同处理方法对EVO 溶出度的影响
EVO 超微粉-F68 固体分散体与其余三个样品的溶出行为有差异;EVO 超微粉-F68 物理混合物和EVO 原料药溶出行为有差异;EVO 原料药和EVO超微粉溶出行为相似,EVO 超微粉-F68 物理混合物和EVO 超微粉溶出行为相似。F68 的加入能促进原料药EVO 的体外溶出,F68 与EVO 超微粉形成固体分散体之后,溶出度大为改观,在1%SDS 溶液溶出度提高到60%以上。上述四个样品在45 min时溶出已不再变化,EVO 超微粉-F68 固体分散体60 min 累积溶出度为65%,较EVO 原料药提高近60倍。根据溶出度结果绘制溶出曲线,结果如图1。
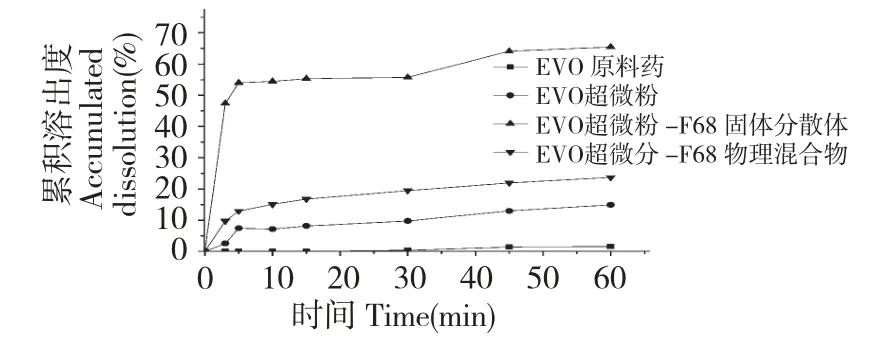
图1 EVO 不同处理方法的溶出曲线图Fig.1 Dissolution curves of EVO with different processing methods
参考《口服固体制剂溶出度试验技术指导原则》,采用非模型依赖的f2相似因子法对溶出曲线进行比较。相似因子(f2)是衡量两条溶出曲线相似度的参数,计算公式如下:

n:试验点数;Rt、Tt:t 时刻参比制剂和被试制剂的释放度;f2值得大小可用来表征被试制剂与参比制剂释药之间的近似程度。若两条曲线完全相同,f2值为100;随着两条曲线近似程度的降低,f2值趋近于0。一般认为,50≤f2≤100,制剂具有相似的体外释放度。
分别计算EVO 超微粉-F68 固体分散体、EVO原料药、EVO 超微粉、EVO 超微粉-F68 物理混合物四者的f2值,结果见表2。

表2 f2相似因子比较Table 2 Comparison of similarity factor
3.3 溶出度的测定
精密吸取上述对照品溶液(0.0345 mg/mL)和“2.4”项供试品溶液各20 μL,按色谱条件注入液相色谱仪,按外标法计算溶出度,结果见表3。
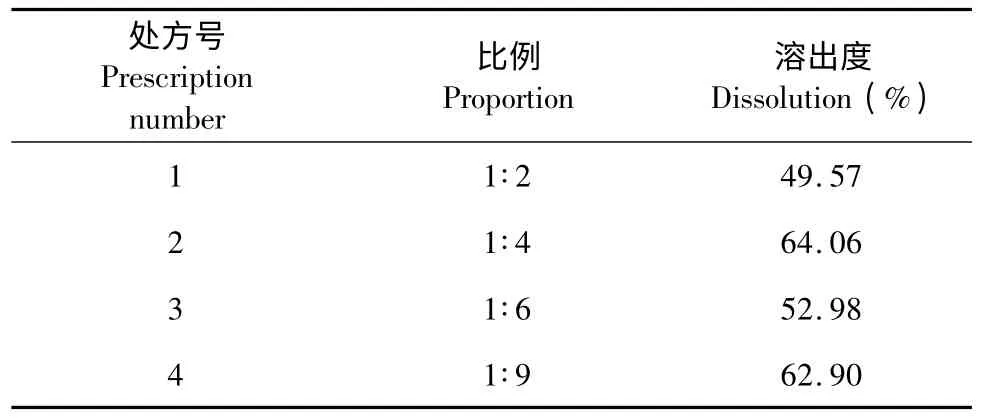
表3 固体分散体辅料比例的筛选Table 3 Screening of solid dispersion excipient
结果表明,EVO 与F68 比例为1∶4 的溶出度与1∶9 的溶出度差异不大,因此为减少辅料用量,确定EVO 与F68 按1∶4 的比例,采用熔融法制备固体分散体。
3.4 EVO 超微粉-F68 固体分散体(1∶4)含量测定
实验结果表明,EVO 含量分别为97.695%、98.807%(图2)。固体分散体技术对药物的含量无影响。
3.5 讨论
固体分散体也存在一定的局限性,在固体分散体中,药物可达到高度分散的状态,但其分散状态的稳定性不好,长时间贮存往往会发生老化现象,应考察其在高温强光下的稳定性,为以后的储存条件提供依据。
经X-衍射鉴定显示EVO 原料药在7.760°、8.694°、18.480°、26.107°有的特异性的晶体衍射峰;在19.217°和23.360°有泊洛沙姆188 的特征衍射峰;在固体分散体中仍可见F68 衍射峰和EVO 衍射峰,EVO 特征衍射峰峰强度大大减小,说明制备的载药固体分散体并未改变EVO 的晶体特征,绝大部分药物以微晶形式分散于载体中;红外图谱显示EVO 没有发生太大的变化,可以认为EVO 在F68固体分散体中没有发生化学变化;扫描电镜结果显示已无可见吴茱萸碱晶体存在于载体中,推测吴茱萸碱以微晶或无定形状态存在于载体中。故此固体分散体技术适于吴茱萸碱的工艺成型.

图2 EVO 对照品(A)、EVO 固体分散体阴性样品(B)及EVO 分散体样品(C)的HPLC 色谱图Fig.2 HPLC chromatograms of EVO control (A),negative control (B)and EVO dispersion sample (C)
考虑到生物碱和酸生成盐能大大增加其溶出度,我们在前期实验中考察了吴茱萸碱和不同酸制备成盐的溶出,实验结果表明:吴茱萸碱溶出度较小且无显著性差异。从结构上分析,吴茱萸碱属于吲哚喹宁类生物碱,氮原子上的孤对电子能接受氢离子而表现碱性,但吸电子基团的诱导效应及邻近苯环p-π 共轭效应均能降低氮原子的电荷密度,碱性降低,这可能是吴茱萸碱成盐溶出依然较小的原因;同时我们也考察了把吴茱萸碱制备成更小粒径的粉末,加入润滑剂等辅料压片及调节不同比例的辅料量压片,结果显示吴茱萸碱的溶出效果依然没有改善;最终选用强亲水性载体聚乙二醇类(PEG)、聚维酮类(PVP)、泊洛沙姆(pluronic F68)制备成分散片,其中以泊洛沙姆最优。
4 结论
试验分别考察了不同处理方法对EVO 在水中平衡溶解度的影响,结果显示以泊洛沙姆188(F68)为载体,熔融法制备吴茱萸碱固体分散体能显著提高吴茱萸碱的溶出,也使用了X-衍射、红外图谱、扫描电镜法测得所制备的分散体不影响EVO 药物的含量和形态,该制备方法稳定可行,为工业化大生产提供依据。
1 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,160.
2 Hu M(呼梅),Liu JW(刘金伟),Song Y(宋英),et al.The effect of evodiamine on quail hyperuricemia.Pharm Clin Chin Mater Med(中药药理与临床),2014,30:38-40.
3 Chen F(陈菲),Li S(李溯),Xu SX(徐世希),et al.Effects of extract purity on solubility and apparent partition coefficient of evodiamine and rutaecarpine.Chin J Pharm(中国医药工业杂志),2011,3:183-186.
4 Guan YM(管咏梅),Li J(李钰),Yang M(杨明).Micromeritics and dissolution rate of fermented mycelium from Cordyceps sinensis powder with different sizes.Chin J Exp Tradit Med Form (中国实验方剂学杂志),2011,17:7-10.
5 Lai J(赖珺),Liao ZG(廖正根),Yang MF(杨明福),et al.Research and progress of bioavability.Chin J Exp Tradit Med Form (中国实验方剂学杂志),2010,16:226-229.
6 Sheng R(盛蓉),Chen J(陈佳),Song Y(宋英),et al.Determination of dissolution of evodiamine dispersible tablets and evodiamine been processed by different methods.Chin J Exp Trad Med Form (中国实验方剂学杂志),2012,18:32-34.
7 Yuan JB(袁金斌),Luo XZ(罗习珍),Xiao XL(肖锡林),et al.Determination of evodiamine and rutaecarpine in Fructus Evodiae by HPLC.Pro Mod Bio(现代生物医学进展),2008,8:2536-2357.
8 Bao TD(鲍天冬),Dong Y(董宇),Yang Q(杨庆),et al.Simultaneous determination of evodiamine,rutaecarpine and evodin in cut crude drug and exact of Fructus Evodiae by high performance liquid chromatography.Chin J Exp Tradit Med Form (中国实验方剂学杂志),2007,13:1-3.
9 Song YF(宋亚芳),Zhang QW(张启伟),Gong MX(龚慕辛),et al.Quantitative analysis method for chemical componentsin Fructus in Fructus Evodiae.Chin J Exp Tradit Med Formu (中国实验方剂学杂志),2009,15:82-84.
