猕猴桃对糖尿病小鼠糖、脂质代谢及氧化应激的影响
2015-01-09尹震花康文艺
张 伟,尹震花,康文艺
黄河科技学院,郑州 450063
猕猴桃为猕猴桃科植物猕猴桃(Actinidia chinensis Planch)的果实,又名藤梨、猕猴梨、羊桃等。分布于中南及陕西、江苏、安徽、贵州、云南等地,具有解热、止渴,健胃,通淋之功能。主治烦热、消渴,肺热干咳,消化不良,湿热黄疸,石淋,痔疮[1]。
化学成分研究表明,猕猴桃果实中富含有挥发性成分、多种维生素、有机酸、黄酮、三萜、猕猴桃碱、多糖及多种人体必需的氨基酸和微量元素等多种化学成分[2-4],药理研究表明,其具有降血脂、抗脂质过氧化、拮抗细胞毒性、抗突变、防癌、提高免疫力等方面的药理活性[5-10],具有药食两用的功能,但关于猕猴桃对糖尿病引起的糖、脂质代谢和氧化应激的研究未见报道,需要进一步深入研究,开发其在糖尿病治疗药物方面的实际应用。
1 材料与仪器
1.1 实验动物
SPF 级昆明小鼠120 只,体重20±2 g,雄性,山东鲁抗医药有限公司质检中心实验动物室,合格证号:SCXK(鲁)20080002,在室温25~27 ℃下,自由采食和饮水,饲喂普通优质饲料。
1.2 药物与试剂
猕猴桃于2011年7 月采集于河南省南召县板山坪镇,由河南大学生药教研室李昌勤教授鉴定为猕猴桃科植物猕猴桃Actinidia chinensis Planch 的果实。取新鲜的猕猴桃,并将其切碎,用甲醇加热回流提取两次,依次为2、1 h,两次提取液合并、过滤,浓缩得猕猴桃甲醇总提取物,总提取物分散于水中,依次用石油醚、乙酸乙酯、正丁醇萃取,减压抽滤,浓缩得到猕猴桃石油醚提取部位(ACPE)、乙酸乙酯提取部位(ACEA)和正丁醇提取部位(ACBU)。
葡萄糖测定试剂盒(20110901,上海荣盛生物药业有限公司);甘油三酯 (TG)测定试剂盒(2011090034),总胆固醇 (TCH)测定试剂盒(201100025)(均购自浙江东瓯诊断产品有限公司);肝/肌糖元测定试剂盒(20111205),丙二醛(MDA)试剂盒(20111130),超氧化物歧化酶(SOD)试剂盒(20111201)(均购自南京建成生物工程研究所);阿卡波糖(110704,杭州中美华成制药有限公司);四氧嘧啶(10150059,Alfa Aesar)。
1.3 仪器
LRH-150 恒温培养箱(上海一恒科技有限公司);Multiskan MK3 酶标仪(美国Thermo Electron 公司);电子天平(美国Mettler-Toledo 公司);旋转蒸发仪(德国Heidolph 公司);UV-2000 型紫外可见分光光度计(上海尤尼科仪器有限公司);CS-H1 型混合器(北京博励阳科技公司);各规格的微量移液枪及枪头。
2 方法
2.1 糖尿病小鼠模型建立及分组给药方法
[11,12],购回的小鼠适应7 d 后,随机分组,空白对照组10 只,另一组为糖尿病造模组。糖尿病造模组于禁食不禁水12~16 h 小时后按80 mg/kg 一次性尾静脉注射四氧嘧啶糖尿病。正常喂养72 h 后,眼眶取血测空腹血糖水平,以空腹血糖大于11.1 mmol/L 为糖尿病小鼠,依据血糖均衡原则随进分为ACPE 高、中、低剂量组,ACEA 高、中、低剂量组、ACBU 高、中、低剂量组、阿卡波糖阳性对照组、糖尿病模型组,空白对照组作为空白组。除模型组和空白组外,其他组分别灌胃相应剂量的药物(在前期的实验研究中,我们已经研究了猕猴桃三个部位对α-葡萄糖苷酶抑制活性,以此为依据进行剂量设置。),1 次/d,连续给药7 d。
2.2 指标采集
第7 d 给药后自由饮食,2 h 后眼眶取血测餐后血糖水平,而后禁食不禁水12 h 后,于第8 d 摘取眼球取血,分离空腹血清,放置于冰箱0-3 ℃保存,处死动物,取肝脏并称重,制备肝糖元溶液。
2.3 指标测定与数据处理
血糖、肝糖元、TG、TCH、MDA 和SOD 等指标的测定均按试剂盒说明书操作。数据采用统计软件SPSS 17.0 对进行统计学处理,所有数据采用表示,以One-way ANOVA 分析各组别之间的显著性差异,两组均数比较采用t 检验。
3 结果
3.1 猕猴桃各提取部位对糖尿病小鼠血糖的影响
从表1 可以看出,给药前,与空白组相比,糖尿病组(ACPE、ACEA、ACBU、阳性对照组和模型组)空腹血糖均呈极显著性升高(P<0.001),说明四氧嘧啶诱导糖尿病小鼠造模成功,并且各给药组之间无显著性差异。
给药治疗7 d 后,与空白组相比,模型组餐后血糖呈极显著性升高(P<0.001),可见糖尿病可以升高餐后血糖;与模型组相比,ACPE 低剂量组、ACEA高、中剂量组和ACBU 低剂量组分别能显著性降低餐后血糖(P<0.01,P<0.05,P<0.001,P<0.001),其他给药组降低餐后血糖无显著性差异,但餐后血糖均低于模型组。
与模型组相比,ACPE 低剂量组、ACEA 高剂量组、ACBU 中剂量组和阳性对照组分别能显著性降低空腹血糖(P<0.01,P<0.001,P<0.05,P<0.05),其他给药组降低空腹血糖无显著性差异,但除ACBU 高剂量组空腹血糖高于模型组外,其他给药组空腹血糖均低于模型组;与阳性对照组相比,ACEA 高剂量组能显著降低餐后血糖(P<0.05)。
从给药后餐后血糖和空腹血糖综合分析,ACPE、ACEA 和ACBU 均有一定的降血糖作用,其中ACPE 低剂量组和ACEA 高剂量组降血糖效果最好,ACEA 中剂量组和ACBU 低剂量组降低餐后血糖效果较好,ACBU 中剂量组降低空腹血糖效果较好。
表1 猕猴桃不同提取部位对糖尿病小鼠血糖的影响(n=10,)Table 1 Effect of the different extracts of A.chinensis on blood glucose (n=10,)
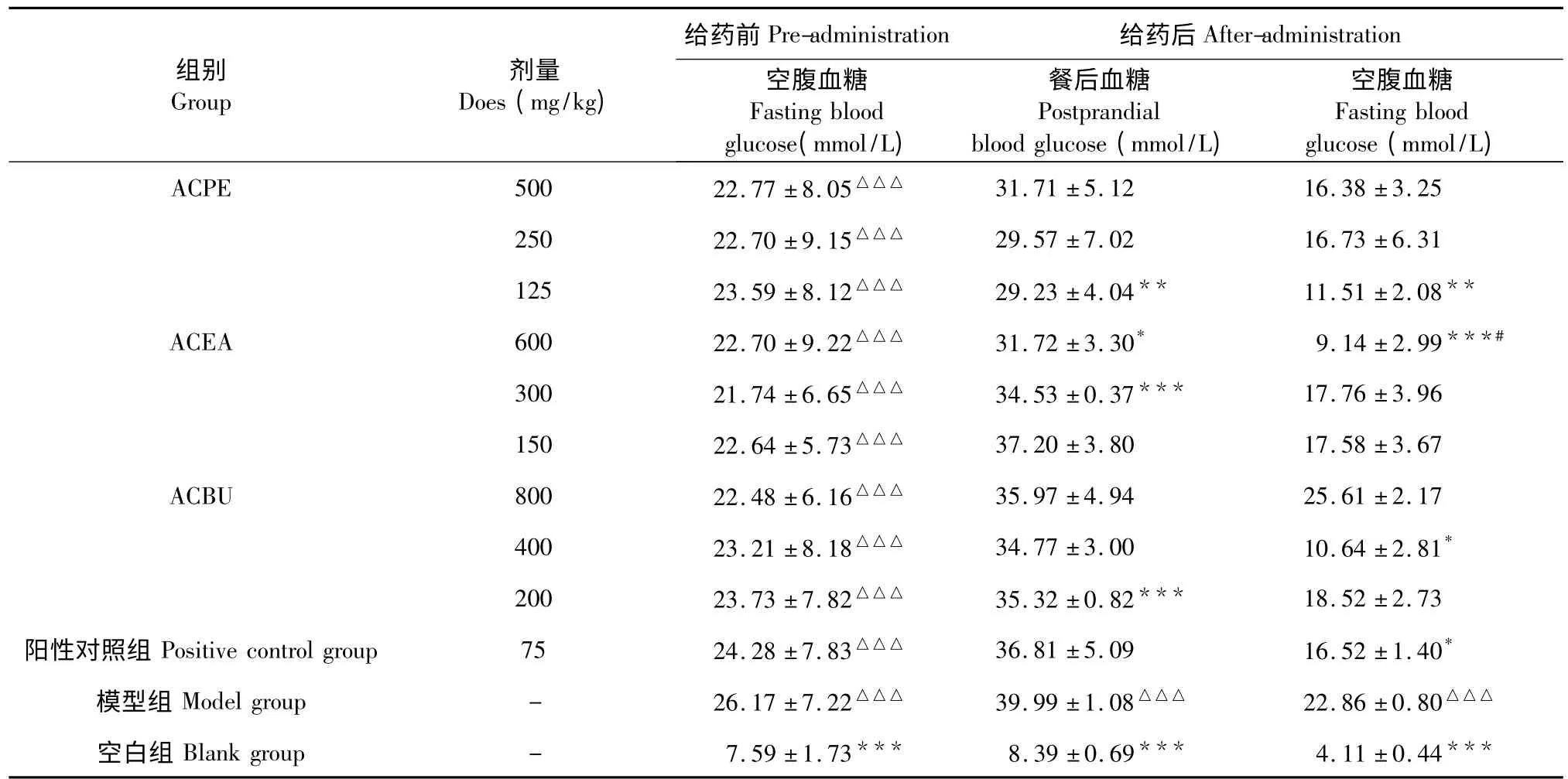
表1 猕猴桃不同提取部位对糖尿病小鼠血糖的影响(n=10,)Table 1 Effect of the different extracts of A.chinensis on blood glucose (n=10,)
注:阿卡波糖为阳性对照。与空白组比较,△P<0.05;△△P<0.01;△△△P<0.001。与模型组比较,* P<0.05;**P<0.01;***P<0.001。与阳性对照组比较,#P<0.05;##P<0.01;###P<0.001。(表2、3、4 同)Note:Acarbose as positive control.Compared with blank group,△P< 0.05;△△P< 0.01;△△△P< 0.001.Compared with model group,* P<0.05;**P<0.01;***P<0.001.Compared with positive control group,#P<0.05;##P<0.01;###P<0.001.
为了进一步研究血糖与肝糖元的关系,测定了糖尿病小鼠中肝糖元的含量。结果见表2。从表2可以看出,与空白组相比,模型组小鼠肝糖元含量极显著性的降低(P<0.001);给药治疗7 d 后,与模型组相比,ACPE 高剂量组能显著性的升高肝糖元的含量(P<0.01),中和低剂量组无统计学意义(P>0.05);ACEA 三个剂量组均能升高肝糖元含量,且具有显著性差异(P<0.05,P<0.01,P<0.05);ACBU 低剂量组能够显著性的升高肝糖元含量(P<0.05),高中剂量组虽能够升高小鼠肝糖元含量,但不具有统计学意义(P>0.05);与阳性对照组相比,ACPE、ACEA 和ACBU 各给药组对肝糖元含量影响无显著性差异,不具有统计学意义(P>0.05)。可见,ACPE、ACEA 和ACBU 可以通过促进肝糖元的合成,降低肝糖元的分解等途径,降低糖尿病的血糖水平。
表2 猕猴桃不同提取部位对糖尿病小鼠肝糖元的影响(n=10,)Table 2 Effect of the different extracts of A.chinensis on hepatic glycogen content (n=10,)

表2 猕猴桃不同提取部位对糖尿病小鼠肝糖元的影响(n=10,)Table 2 Effect of the different extracts of A.chinensis on hepatic glycogen content (n=10,)
3.2 猕猴桃各提取部位对糖尿病小鼠血脂代谢的影响
从表3 可以看出,与空白组相比,模型组小鼠TCH 含量极显著性的升高(P<0.001);给药治疗7 d 后,与模型组相比,ACPE、ACEA、ACBU 和阳性对照组均能极显著性的降低TCH 的含量(P<0.001),且与空白组相比无显著性差异(P>0.05);ACPE 和ACBU 高低剂量组均能够显著性的降低TG 含量(P<0.05,P<0.001,P<0.05,P<0.05),ACEA 高剂量组能够显著性降低TG 含量(P<0.01);与阳性对组相比,ACPE、ACEA 和ACBU 各给药组对TCH 和TG 含量的影响均无显著性差异(P>0.05)。可见,ACPE、ACEA 和ACBU 均能通过降低血清中TCH 和TG 的含量,来改善糖尿病并发症—高血脂,纠正糖尿病小鼠的脂质代谢紊乱。
表3 猕猴桃不同提取部位对糖尿病小鼠血清中TCH 和TG 的影响(n=10,)Table 3 Effect of the different extracts of A.chinensis on the levels of TCH and TG in serum (n=10,)
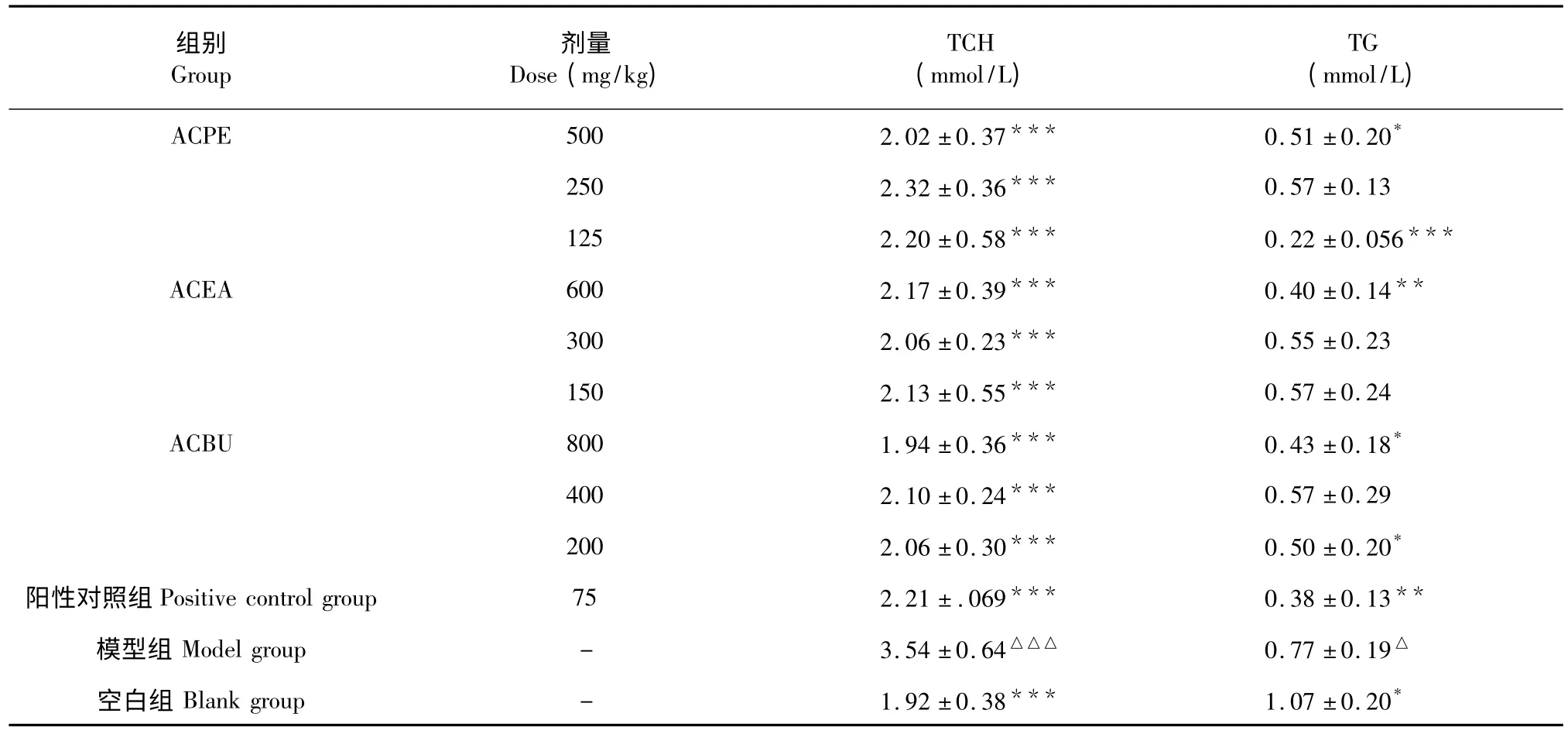
表3 猕猴桃不同提取部位对糖尿病小鼠血清中TCH 和TG 的影响(n=10,)Table 3 Effect of the different extracts of A.chinensis on the levels of TCH and TG in serum (n=10,)
3.3 猕猴桃各提取部位对糖尿病小鼠脂质过氧化水平的影响
由表4 可以看出,与空白组相比,模型组小鼠血清中MDA 含量极显著性升高(P<0.001),SOD 水平极显著性降低(P<0.001)。给药治疗7 d 后,与模型组相比,ACPE、ACEA 和ACBU 高、中、低剂量组均能极显著的升高SOD 水平(P<0.001),ACPE高中低剂量组、ACEA 高剂量组、ACBU 高低剂量组均能极显著性的降低MDA 含量(P<0.001,P<0.001,P<0.001),ACBU 中剂量能非常显著的降低MDA 含量(P<0.01)。与阳性对照相比,ACPE 高、中、低剂量组呈现不同程度的降低MDA 含量(P<0.001,P<0.05,P<0.01),除ACEA 和ACBU 低剂量组外,其他各组能不同程度的升高SOD 水平。可见,ACPE、ACEA 和ACBU 均能通过不同程度的降低血清中MDA 的含量,升高SOD 水平,增强糖尿病小鼠机体的抗氧化功能,保护机体免受自由基的进一步伤害。
表4 猕猴桃不同提取部位对糖尿病小鼠血清MDA 和SOD 的影响(n=10,)Table 4 Effect of the different extracts of A.chinensis on the content of MDA and the level of SOD in serum (n=10,)
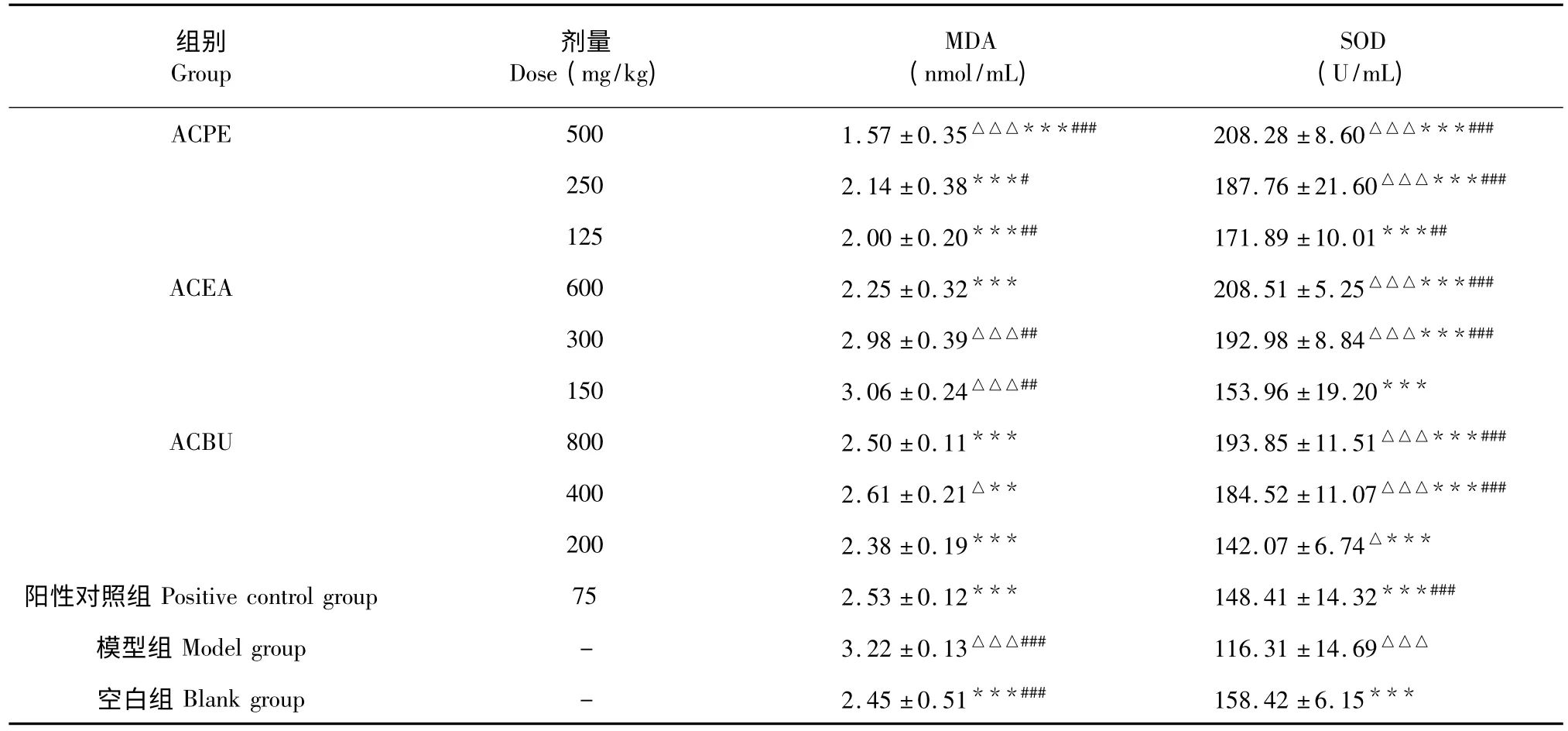
表4 猕猴桃不同提取部位对糖尿病小鼠血清MDA 和SOD 的影响(n=10,)Table 4 Effect of the different extracts of A.chinensis on the content of MDA and the level of SOD in serum (n=10,)
4 讨论
四氧嘧啶会使大鼠胰岛β 细胞损伤,分泌功能降低,因而糖元合成和脂类生成作用受阻,血糖、血脂和动脉粥样硬化指数升高,同时,主要抗氧化酶类-血清SOD 降低,外周组织膜脂蛋白代谢末端产物-脂质过氧化产物升高[13]。本实验利用四氧嘧啶诱导小鼠糖尿病模型,可使糖尿病小鼠血糖水平升高、肝糖元降低、血脂代谢紊乱、抗氧化系统紊乱。可见,四氧嘧啶诱导的糖尿病小鼠和大鼠模型脂质代谢紊乱,抗氧化防御体系受抑制,自由基产生率大于清除率,氧化应激增强[14]。这与糖尿病患者体内变化相一致[15]。另外,血脂代谢异常还可以可通过干扰胰岛素的作用,抑制葡萄糖代谢而导致胰岛素抵抗,从而导致糖脂代谢的紊乱[16]。
本实验利用尾静脉注射四氧嘧啶诱导糖尿病小鼠模型,分别用猕猴桃石油醚部位、乙酸乙酯部位和正丁醇部位进行灌胃处理,探讨其降血糖作用,由体内糖尿病小鼠实验表明,石油醚部位、乙酸乙酯部位和正丁醇部位对四氧嘧啶诱导的糖尿病小鼠均有一定的治疗作用,可以不同程度的降低四氧嘧啶诱导的糖尿病小鼠的空腹血糖和餐后血糖,改善糖尿病并发症如高血脂,纠正糖尿病小鼠的脂质代谢,降低肝糖元的分解等途径,增强糖尿病小鼠机体的抗氧化防御功能,保护机体免受自由基的进一步攻击,进而达到治疗糖尿病的作用。可见,猕猴桃有望用于糖尿病及其并发症的有效治疗,且查阅文献发现,猕猴桃果实籽油具有一定的还原力以及清除DPPH 自由基、超氧阴离子自由基、H2O2以及羟基自由基的能力[17]。猕猴桃含有黄酮、多酚等成分,具有抗氧化作用,能抑制H2O2致膜脂质过氧化产物MDA 产生水平,具有一定的抗脂质过氧化作用[18,6],可推测,猕猴桃体内降血糖作用与其抗氧化活性紧密相关,这与王建勇等研究的灯盏细辛提取物改善血糖代谢和血脂代谢结果具有一定的相似性[19]。
参考文献
1 The Chinese Materia Medica Commission (中华本草编委会).Chinese Materia Medica (中华本草).Shanghai:Science and Technology Press (上海科学技术出版社),1999.9,538-541.
2 Yao MJ (姚茂君).Comparison of the three extracting methods for Kiwi fruit seed oil.Food Sci (食品科学),2006,27:242-243.
3 Zhu WJ,Yu DH,et al.Antiangiogenic Triterpenes Isolated from Chinese Herbal Medicine Actinidia chinensis Planch.Anti-Cancer Agents Med Chem,2013,13(2):195-198.
4 Kalandiya A,Vanidze M,Papunidze S,et al.Flavonols from Chinese actinidia (Actinidia chinensis Planch.)fruits.Bull Georgian Acad Sci,2001,163:157-159.
5 Clearwater MJ,Luo ZW,Chye Ong SE,Vascular functioning and the water balance of ripening kiwifruit (Actinidia chinensis)berries.J Exp Bot,2012,63:1835-1847.
6 Tang ZL (唐筑灵),Zhang XL (张小蕾).The effect on anti-lipid peroxidation of Chinensis Actinidia Planch juice in mice red blood cells.J Guiyang Med College (贵阳医学院学报),1995,20:301-302.
7 Zhang SF (张书芳),Wang PX (王培席),Zhang FY (张发义).Study the effects of Nitrite and Nitrosamines toxicity of Chinensis Actinidia Planch.Henan J Prevent Med (河南预防医学杂志),1996,7:213-215.
8 Zhao ZZ (赵泽贞),et al.The Mutagenicity and antimutagenicity synchronous test of 4 kinds of fruit.Cancer Res Prevent and Treat (肿瘤防治研究),2001,28:463-464.
9 Zou LL,Yang ZY,Fan ZL,et al.Evaluation of antioxidant and antiproliferative properties of three actinidia (Actinidia kolomikta,Actinidia arguta,Actinidia chinensis)extracts inVitro.Int J Mol Sci,2012,13:5506-5518.
10 Lu D (卢丹),Yu LC (俞立超),Yao SJ (姚善泾).Studies on purification and antitumor activity of fruit polysaccharide isolated from Chinensis Actinidia Planch.Food Sci (食品科学),2005,26:213-215.
11 Zhang W (张伟),Yin ZH (尹震花),et al.Effect of blackberry seed on Alloxan induced diabetes in mice.Sci Tech Food Ind (食品工业科技),2014,35:351-354.
12 Wei JF,Li YY,Shang FD.Antioxidant activities,a-glucosidase inhibitory in vitro and effects of Lysimachia paridiformis Franch.var.stenophylla Franch.on Alloxan-induced Diabetic Mice in vivo.J Med Plant Res,2012,6:2793-2800.
13 Ye YW (叶于薇),Zhong WJ (仲伟鉴),et al.Effect of oxidative stress on saccharometabolism disorder.Chin J Food hygiene (中国食品卫生杂志),2000,12:8-10.
14 Pigeolet E.GSH Px,SOD and CAT inactivation by peroxides and oxygen derived free radicals.Mech Ageing Dev,1990,50:283-297.
15 Baynes JW.Perspectiues in diabetes.Diabetes,1991,40:405-411.
16 Wang QY (王秋玉),Xu HY (许泓瑜),et al.Hypoglycemic effect of water extracts from Edgeworthia gardneri(Wall.)meissn on Type 2 diabetic mice.Nat Prod Res Dev(天然产物研究与开发),2014,26:1385-1388.
17 Li JX (李加兴),Yu Jiao (余娇),Huang C (黄诚),et al.In vitro antioxidant activity of kiwifruit seed oil.Food Sci(食品科学),2012,33(23):51-54.
18 Yamazaki M,et al.Antioxidative function of kiwi fruit and oxidative damage in host.Bio Ind,2000,17(11):24-31.
19 Wang JY (王建勇),Yang QX (杨庆雄),Huang XY (黄小燕).Protective Effect of Erigeron breviscapus extract on oxidative damage in type 2 diabetes mice.Nat Prod Res Dev (天然产物研究与开发),2014,26:1696-1699.
