HPLC 同时测定延胡索中6 个核苷成分含量
2015-01-09陈东东陈亚运陈建伟
陈东东,陈亚运,周 萍,李 祥,陈建伟
南京中医药大学,南京 210023
延胡索来源于罂粟科植物延胡索Corydalis yanhusuo W.T.Wang 的干燥块茎,是著名的“浙八味”中的一种。始载于《神农本草经》,列为中品,味辛、苦,性温。具有活血,利气,止痛等功效,用于治疗胸肋、脘腹疼痛,经闭痛经,产后瘀阻,跌扑肿痛[1]等症。本品为中国药典所载常用中药,全国多地区有分布,主产于江苏、浙江等地。现代研究发现,延胡索对心血管系统、神经系统等药理作用明显,临床应用较为广泛,用量较大。核苷是生物细胞维持生命活动的基本组成元素,参与DNA 代谢过程,具有抗肿瘤、抗病毒、基因治疗等多种生物活性[2]。如腺苷具有改善心脑血液循环,防止心律失常,抑制神经递质释放和调节腺苷酸环化酶活性等[3,4]。目前在延胡索质量评价方面,大多以延胡索乙素等生物碱的含量为指标,而关于核苷类成分的含量测定,笔者尚未见到相关文献报道。本实验通过参照其他有关核苷成分含量测定的相关报道,对延胡索中6 种核苷成分进行了定性、定量分析,为延胡索的化学成分、药理作用,和多指标质量控制提供了科学依据。
1 仪器与试药
1.1 仪器
Waters2695 高效液相色谱仪:包括Waters2489型PDA 检测器,Empower 工作站(Waters 公司);AG285 电子天平(瑞士Mettler Toledo 公司);KQ-2200B 型超声波清洗器(昆山市超声仪器有限公司);纯水仪(南京易普易达科技发展有限公司)。
1.2 试药
对照品胞苷(批号0001446223)、尿苷(批号100469-200401)、腺苷(批号140709-200602)、2-脱氧腺苷(批号20331-201208)、鸟苷(批号20332-201205)、胸苷(批号140661-200301)购自Sigma 公司;三批延胡索购自江苏宜兴、江苏南通、浙江杭州,经本校中药资源教研室陈建伟教授鉴定为罂粟科植物延胡索Corydalis yanhusuo W.T.Wang 干燥块茎;甲醇、磷酸为北京化工厂产品;水为去离子水。
2 方法与结果
2.1 色谱条件
采用Grace Prevail C18(4.6 mm × 250 mm,5 μm)柱;以甲醇(A)-0.1%磷酸水溶液(B)为流动相,梯度洗脱为:(0~15min,0.5%~7%甲醇;15~25min,7%~15%甲醇;25~35min,15%~80% 甲醇;35~45min,80%~90%甲醇);流速0.8 mL/min;柱温30 ℃;检测波长260 nm;进样量均为10 μL。
2.2 对照品和供试品溶液的制备
2.2.1 混合对照品溶液
精密称取胞苷、尿苷、腺苷、2-脱氧腺苷、鸟苷、胸苷的对照品适量,用10%的甲醇溶液配制成质量浓度分别为607.3、908.4、967.6、210.6、679.7、256.3 μg/mL 的混合对照品溶液。
2.2.2 供试品溶液
延胡索研成粉末,过60 目筛,精密称取1.0 g,置50 mL 锥形瓶中,精密量取10%甲醇10 mL,称定重量,超声(500 W,40 kHz)处理30 min,冷却至室温,称重,用10%甲醇补足减失重量,过滤,即得。
2.3 方法学考察
2.3.1 专属性实验
在“2.1”项色谱条件下,混合对照品溶液和延胡索供试品溶液的色谱图见图1,混合对照品溶液及延胡索供试品溶液中6 种核苷达到基线分离。
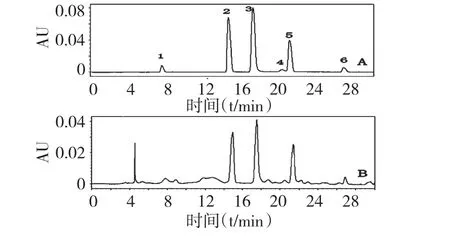
图1 混合对照品(A)和供试品(B)的HPLC 色谱图Fig.1 HPLC chromatograms of mixed reference substances(A)and C.yanhusuo sample (B)
2.3.2 线性关系考察
分别精密吸取混合对照品溶液0.1、0.5、1.0、1.5、2.0 mL 至10 mL 容量瓶中,加10%甲醇定容至刻度,离心后取10 μL 注入高效液相色谱仪,按“2.1”项下色谱条件进行分析,以峰面积Y 对进样量X 进行回归计算,回归方程见表2。

表1 被测核苷的线性关系和线性范围Table 1 Linear ranges and regression equations of studied nucleosides

2.3.3 精密度试验
取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件分别连续进样测定6 次,测定6 种核苷的峰面积并计算其RSD。结果显示胞苷、尿苷、腺苷、2-脱氧腺苷、鸟苷、胸苷的RSD 分别为1.2%、0.5%、0.6%、1.0%、1.3%、0.8%,符合精密度要求。
2.3.4 稳定性试验
取同一供试品(浙江杭州)溶液,按“2.1”项下色谱条件分别于0、4、8、12、16、20 h 进样10 μL,测定6 种核苷的峰面积并计算RSD。结果显示胞苷、尿苷、腺苷、2-脱氧腺苷、鸟苷、胸苷的RSD 分别为0.9%、1.4%、1.6%、1.2%、1.8%、1.3%,表明供试品溶液在20 h 内稳定性良好。
2.3.5 重复性试验
取同一批次(浙江杭州)样品6 份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,测定峰面积,计算含量及RSD。结果胞苷、尿苷、腺苷、2-脱氧腺苷、鸟苷、胸苷的平均含量分别为21.36、207.85、222.35、8.45、154.83、11.54 μg/g,RSD 分别为1.3%、1.7%、0.9%、1.8%、1.0%、1.2%,表明方法重复性良好。
2.3.6 加样回收率试验
取已知含量的样品(浙江杭州)1.0 g 共6 份,按1:1 的比例加入适量对照品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下方法进样分析,根据测得量和加入量计算其回收率,结果见表3。
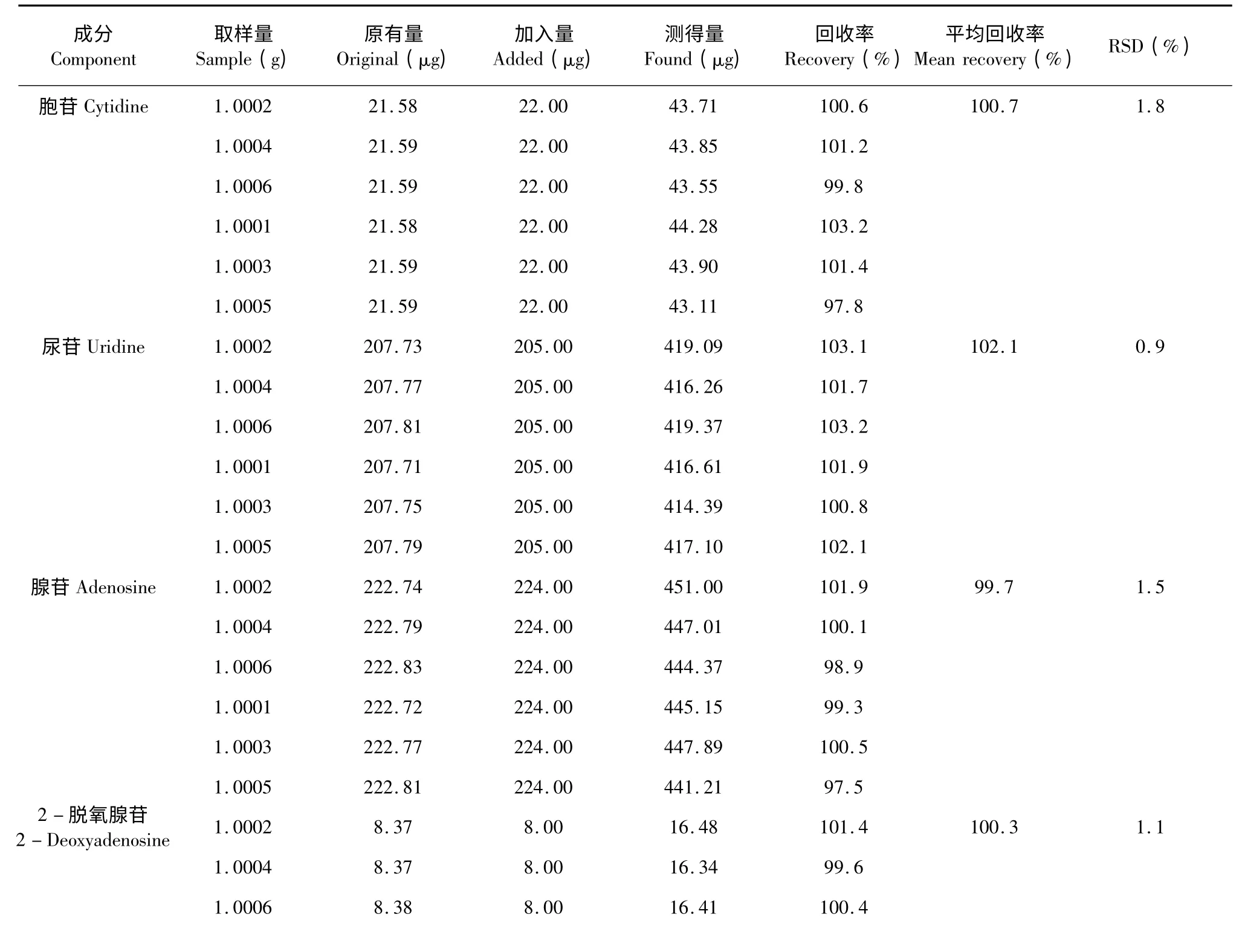
表3 样品加样回收率试验(n=6)Table 3 Results of recovery tests(n=6)

2.4 样品含量测定
取不同产地延胡索粉末1.0 g,平行3 份,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下方法进样分析,采用外标法计算含量,取3 份平均值,结果见表4。

表4 样品中6 种核苷的含量(n=3,μg/g)Table 4 Contents of six compounds in samples (n=3,μg/g)
3 讨论
3.1 提取方法的选择
通过查阅相关文献[5-7],分别对延胡索样品提取的方法包括超声提取和加热回流提取、提取溶剂分别考察了20%甲醇、15%甲醇、10%甲醇、水,提取溶剂的用量分别考察了10、20、40、80 mL 和提取时间20、30、50、60、90 min,等因素进行了考察。结果显示热回流和超声所得供试品中差异不大,但超声更加简捷,快速,容易制得,故选择超声的提取方法,另外提取溶剂中发现10%甲醇提取的效果较好,几种核苷成分的含量较高,并同时确定了提取时间30 min 较适宜,料液比1∶10 为最佳提取条件。
3.2 色谱条件的优化
核苷类成分大多溶于水,偏碱性,所以流动相的条件着重考虑了甲醇-水[8],乙腈-水[9],甲醇-酸水[10]系统,最后试验发现选用甲醇-0.1%的磷酸水为流动相时的峰形较好,分离度较高。另外,并对样品做全波长扫描,发现样品在254 nm 和267 nm 处有最大吸收,参照相关文献发现大多在260 nm 处测定核苷成分的含量,发现在260 nm 处,延胡索中6种核苷也都有较好的吸收,峰形较好,分离度较高,故选择260 nm 作为检测波长值。
3.3 不同产地延胡索中核苷含量的差异
从表4 中可看出南通、宜兴、浙江三个产地中,腺苷和尿苷的含量较高,且远高于其他4 种,其中又以腺苷含量居首,而2-脱氧腺苷的含量为最低。造成不同核苷成分的含量的差异可能跟当地气候条件,土壤情况,以及采收时期有关,值得深入研究,以便能更好了解延胡索化学成分的差异,更好的控制延胡索质量。
1 Lu CM(鲁春梅),Zhang CS(张春森),Jiang LY(姜立勇).Research progress on chemical and pharmacological effects of Corydalis Rhizoma.TCM Mod Study Appl(中药现代研究与应用),2011,5:126-127.
2 Zhang WM(张文萌),Jia YR(贾玉荣),Fu JN(付锦楠).RP-HPLC simultaneous determination of five nucleoside in Rehmanniae Preparata Radix.J Pharm Anal(药物分析杂志),2013,33:94-97.
3 Li J(李静),Zhu JY(朱静毅).Research progress on determination of nucleoside.Tianjing Pharm(天津药学),2013,25(6):53-55.
4 Lv AJ(吕爱娟),Wu H(吴皓).Research on components of nucleoside in traditional Chinese medicine.Chin J Inf Tradit Chin Med (中国中医药信息杂志),2006,13(7):94-97.
5 Zhong QX(钟倩霞),Lv GP(吕广萍),Peng L(彭亮),et al.HPLC determination of 4 nucleoside in Dictyophora echinovolvata from different places of production.J Pharm Anal(药物分析杂志),2014,34:411-414.
6 Li F(李峰),Jing H(姜泓),Kang TG(康廷国).Analysis of nucleoside in Lubian commercial medicinal materials.Chin Tradit Patent Med(中成药),2009,31:1254-1257.
7 Li XL(李雪玲),Cui XM(崔秀明),Dai Y(戴云).Determination of guanosine in Pinellia ternata from the different habitats and the processed.Chin J Spectro Lab(光谱实验室),2006,23:220-223.
8 Zhang HJ(张海娟),Ma SZ(马世震),Xiao YC(肖远灿).RP-HPLC simultaneous determination of ten nucleosides and nucleosides in Fritillaria unibracteata.J Pharm Anal(药物分析杂志),2013,32:986-989.
9 Liu R(刘睿),Ma SM(马思萌),Sun L(孙璐).Simultaneous determination of ten nucleoside components in Kudiezi Injection by HPLC-DAD.Chin Tradit Herb Drug(中草药),2013,44:2542-2546.
10 Tian XR(田晓然),Fu TM(付廷明),Guo LW(郭立玮).HPLC simultaneous determination of five nucleoside components in extracts of Buthus martensii by different extraction technologies.Chin J Exp Tradit Med Form (中国实验方剂学杂志),2013,19(8):13-16.
