基于斑马鱼模式生物的中药主要成分抑制血管生成的活性筛选
2015-01-08周玲晓彭维兵付先军刘可春王振国
周玲晓,彭维兵,付先军,刘可春,王振国*
1山东中医药大学中医药经典理论教育部重点实验室,济南 250399;2山东省科学院生物研究所山东省生物传感器重点实验室,济南 250014
肿瘤是全球范围危及人类生命健康的严重疾病,大量文献报道已经证实中草药的抗肿瘤作用[1,2],相比于化疗药物,中草药抗肿瘤具有安全、低毒、副作用小、遗传致突变率低等优点[3]。中药药性理论是中医药理论体系的重要组成部分,中药寒热药性理论是中药药性理论的核心,对指导中药的临床应用具有重要意义[4]。近几年,抑制血管生成疗法成为国内外抗肿瘤研究的一个热点。研究表明,寒性中药及其主要成分可以抑制血管生成,而热性中药及其主要成分可以促进血管生成[5-7]。
目前,斑马鱼逐渐成为一种药物活性筛选比较成熟的模式生物[8,9],其血管生成过程与肿瘤血管生成模式相似,被作为一种理想的筛选抑制血管生成类抗肿瘤药物的活体动物模型[10]。斑马鱼基因与人类基因的相似度达到87%,因此斑马鱼药物实验所得的结果具有较高的参考价值[11,12],斑马鱼抑制血管生成实验已经成为快速筛选抗肿瘤先导化合物的重要途径。目前在中医药领域,应用转基因斑马鱼模型进行抑制血管生成的研究报道较少,为了进一步验证来源于不同药性中药的成分抑制斑马鱼血管生成的效应是否存在差异,本研究选取了18 种中药主要成分,进行抑制血管生成的实验研究,基于中药寒热药性理论探讨其对于血管生成的抑制作用,并分析中药寒热药性对其作用的影响,以期为抗肿瘤中药新药的研发提供先导化合物和新的思路。
1 仪器与材料
1.1 样品
参照《中国药典》2010 版1 部[13],选取18 种来源于不同药性中药的主要成分(见表1),所有试药均购自上海同田生物有限公司,经HPLC 检验,纯度均达到90%以上。

表1 来源于不同药性中药的主要成分Table 1 Main components of traditional Chinese medicine with different natures
1.2 试剂
斑马鱼胚胎脱膜剂:链霉蛋白酶(pronase)为Sigma 公司产品,批号:1016D045。助溶剂:二甲基亚砜(DMSO),为北京益利精细化学品有限公司产品,批号:20120810。
1.3 实验动物
TG(VEGFR2:GFP)系荧光转基因斑马鱼,取自山东省科学院斑马鱼药物筛选平台,其养殖和培育参照Westerfield[6]。
1.4 实验仪器
XSJ-D 型倒置显微镜、COICXSZ-H 型荧光显微镜均为重庆光电仪器有限公司产品,LRH-250-G 光照培养箱(广东医疗器械厂)。
2 实验方法
2.1 配制样品溶液
首先精确称量1 mg 样品于1.5 mL 的离心管中,然后加入1 mL 胚胎培养用水,对于水溶性比较差的试药,按照0.1%的比例加入助溶剂DMSO 助溶。溶解后获得1 mg/mL 的样品母液以备用。
2.2 收集胚胎
傍晚取健康性成熟的雌雄斑马鱼各两条放于交配缸内,次日10 时左右收集受精卵。收集后,移入0.5%亚甲基蓝溶液中(胚胎培养用水配制),清洗消毒胚胎,几分钟后将其移入清洁的胚胎培养用水中,备用。
2.3 加药
取96 孔培养板,每12 孔为一组,取适量的样品母液,用胚胎培养用水稀释得到不同浓度的样品溶液,将24 hpf 的斑马鱼胚胎置于1 g/mL 的链霉蛋白酶溶液中,脱去卵膜,并用胚胎培养用水清洗2~3遍,然后挑选正常的斑马鱼胚胎,将正常脱膜胚胎加入到培养板中,每个培养孔移入3 个胚胎,同时以胚胎培养用水设为对照组。封闭96 孔板,放入可控温(28 ℃)光照培养箱内继续培养。
2.4 观察结果
加药后24 h(胚胎发育到48 h,48 hpf),于荧光显微镜下观察斑马鱼体节间血管的生成情况和荧光强弱状况,在倒置显微镜下观察斑马鱼存活情况,拍照并计数血管数(尾端至头部与躯干部交界处)。
2.5 数据处理
利用数据统计分析软件(SPSS17.0)处理实验数据,计算18 种中药成分的抑制率,并比较各中药成分对斑马鱼血管生成的抑制作用与对照组的差异性。
抑制率=(对照组平均血管数-实验组平均血管数)/对照组平均血管数×100%
3 实验结果
首先用18 种中药成分的100 μg/mL 的浓度对斑马鱼胚胎进行抑制血管生成活性的筛选。通过对实验结果(表2)的观察以及实验数据的分析,发现汉防己甲素、木通皂苷D、阿魏酸、丹参酮IIA、儿茶素的抑制作用比较明显,其中木通皂苷D、儿茶素在100 μg/mL 的浓度时抑制作用最强,汉防己甲素、阿魏酸、丹参酮IIA 在100 μg/mL 的浓度时,斑马鱼体节间血管有明显缺失、断裂,血管数减少,荧光强度减弱;而羟基红花黄色素A、盐酸小檗碱、红景天苷、黄芪甲苷、苦杏仁苷的抑制作用相比于以上五种成分明显较弱,抑制率均在15 以下;盐酸巴马汀、岩白菜素、三七皂苷、异阿魏酸、表儿茶素、细辛脂素、汉防己乙素、延胡索乙素作用于斑马鱼胚胎时,血管发育比较完好,近似于用胚胎培养用水设置的对照组,统计学意义不大,不再进行验证。
然后进一步研究汉防己甲素、木通皂苷D、阿魏酸、丹参酮IIA、儿茶素在50,25 μg/mL 的浓度时对斑马鱼血管生成的抑制作用(表3)。以上5 种中药成分在50 μg/mL 的浓度时,也表现出抑制血管生成的作用,其中木通皂苷D 的抑制作用比较强,但汉防己甲素、儿茶素、阿魏酸、丹参酮IIA 的抑制作用明显减弱。各中药成分在25 μg/mL 的浓度时,其抑制作用已经变得微乎其微。
通过以上分析可以看出,本研究筛选出的中药成分抑制斑马鱼血管生成的作用与剂量浓度呈正相关性。
从图1、2 可以看出,汉防己甲素、阿魏酸各剂量浓度对斑马鱼胚胎体节间血管生成的影响,相比于对照组有明显差异。其体节间血管有明显缺失、断裂,血管数减少,荧光强度减弱。
表2 药物作用24 h 后各实验组的斑马鱼体节间血管数(n=30,)Table 2 Number of vessels between somites of zebrafish in each group after using medicine for 24 h (n=30,)

表2 药物作用24 h 后各实验组的斑马鱼体节间血管数(n=30,)Table 2 Number of vessels between somites of zebrafish in each group after using medicine for 24 h (n=30,)
表3 药物作用24h 后各实验组的斑马鱼体节间血管数(n=30,)Table 3 Number of vessels between somites of zebrafish in each group after using medicine for 24h (n=30,)
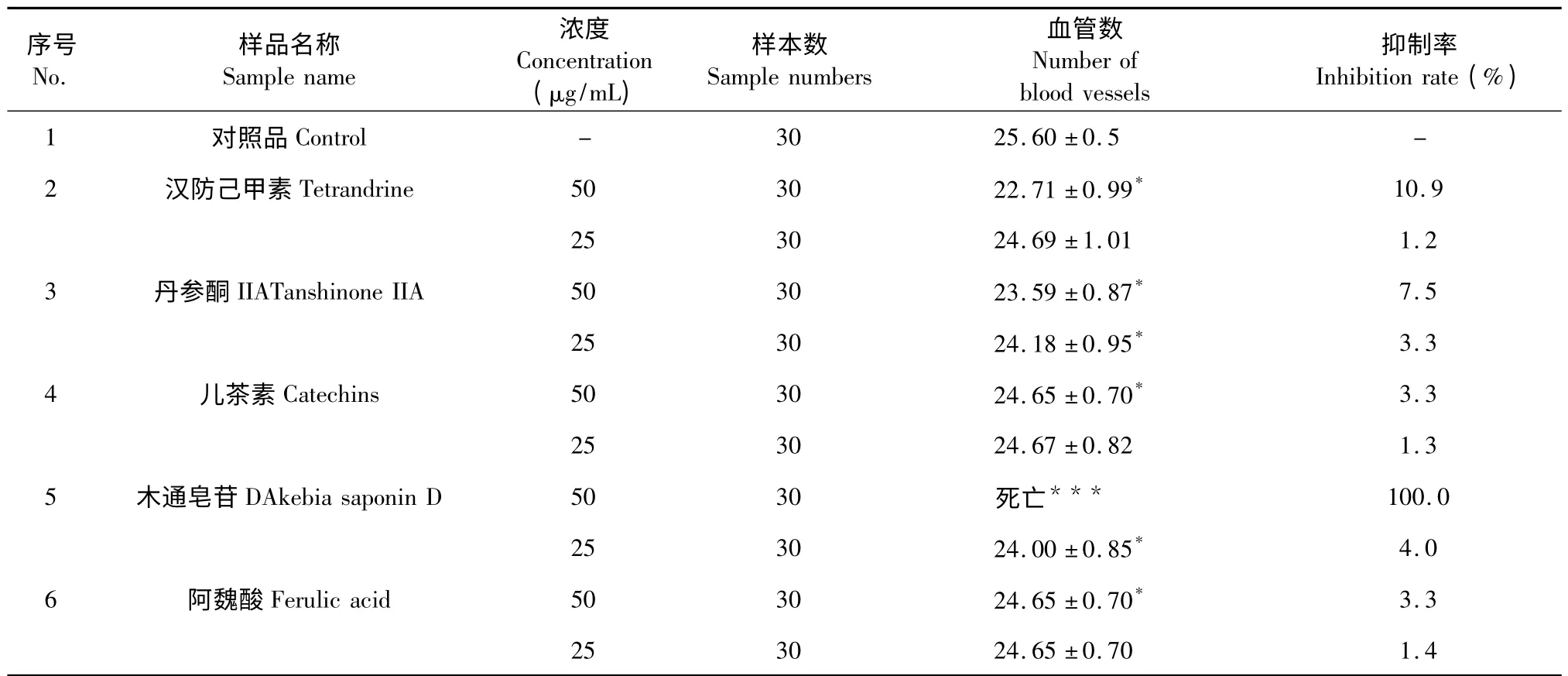
表3 药物作用24h 后各实验组的斑马鱼体节间血管数(n=30,)Table 3 Number of vessels between somites of zebrafish in each group after using medicine for 24h (n=30,)
注:与空白对照组比较,* P<0.05;***代表差异性特别显著。Note:Compare with control,* P<0.05;*** indicated significant difference of the representative medicine
4 讨论
应用传统动物模型进行药物筛选的成本高、效率低、速度慢、样品需要量大,近年来已逐步转变为以体外实验筛选为主,特别是以高通量筛选(high throughput screening,HTS)为主的新药发现模式[14]。斑马鱼模型已经应用于构建人类疾病模型[15]及相关药物筛选[16,17]等方面,Cross 等[18]研究发现用血管荧光标记的转基因斑马鱼可以快速筛选抑制血管生成药物,认为其有潜力成为一种高通量筛选模型,成为活性筛选的一个主要补充。有研究表明,利用斑马鱼生物模型进行药物筛选的方法和技术,同样适用于中药活性成分的研究[19-21]。

图1 汉防己甲素对斑马鱼体节间血管生成的影响Fig.1 Effect of tetrandrine on angiogenesis between zebrafish somites

图2 阿魏酸对斑马鱼体节间血管生成的影响Fig.2 Effect of ferulic acid on angiogenesis between zebrafish somites
本研究采用斑马鱼模式生物,模拟中医临床给药,研究18 种来源于不同药性中药的主要成分抑制血管生成的活性。研究结果显示,18 种成分均具有不同程度的血管抑制活性,在浓度为100 μg/mL时,有5 种成分的抑制率均在20%以上,其中3 种来源于寒性中药,2 种来源于热性中药;来源于寒性中药的8 种成分中,儿茶素抑制率最高,达到100%,其平均抑制率为22.91%;来源于热性中药的8 种成分中,木通皂苷D 抑制率最高,达到100%,其平均抑制率为21.76%;来源于平性中药的2 种成分的抑制率都不高,平均抑制率为7.15%。研究中发现抑制斑马鱼血管生成的中药成分既有来源于寒性中药的,也有来源于热性中药的,来源于寒性中药成分的平均抑制率略高于来源于热性中药成分的,但差异不明显,与文献报道[5-7]有一定出入,有待进一步扩大研究样本量加以证实。
中药是中医药理论指导下用于防治疾病的药物,在我国已有几千年的历史。目前对于抑制血管生成类药物的研究[22,23],大多是按照西方化学药品的研究思路和天然产物的研究模式来进行,缺乏中医药理论的指导,致使新药研发受到一定限制。中药药性理论是传统中医药理论体系的重要组成部分,中药寒热药性是中药药性理论的核心[4],因此本研究从中药寒热药性理论的角度来探讨来源于不同药性中药的主要成分抑制血管生成的活性,可以为新药研发和评价提供新的途径,尤其为抗肿瘤先导化合物的筛选提供新的思路。
1 Gao F(高枫),Fu ZY(符兆英).Research development in mechanisms of tumor cell apoptotic induced by natural products.Chin J Cancer Prevent Treat(中华肿瘤防治志),2011,18:557-560.
2 Chen XQ(陈锡强),Hou HR(候海荣),Liu KC(刘可春).Research advance of natural products anti-angiogenesis.Shandong Sci(山东科学),2010,23(6):34-39.
3 Han YY(韩玉英),Feng P(丰平),Wen CY(文朝阳).Progress of research of anti-tumor Chinese medicine.Beijing J Tradit Chin Med(北京中医杂志),2003,22(2):45-48.
4 Fu XY(付先军),Wang P(王鹏),Wang ZG(王振国).Hypothesis on building of chemical constituent element system of cold-heat nature based on study of ″Nature-Structure Relationship″of traditional Chinese medicine.World Sci Technol,Mod Tradit Chin Med Mater Med(世界科学技术,中医药现代化),2011,10:919-924.
5 Li S,Zhang B,Jiang D,et al.Herb network construction and co-module analysis for uncovering the combination rule of traditional Chinese herbal formulae.BMC Bioinformatics,2010,11(11):1-6.
6 Ma T,Tan C,Zhang H,et al.Bridging the gap between traditional Chinese medicine and systems biology:the connection of Cold Syndrome and NEI network.Mol Bio Syst,2010,6:613-619.
7 Wang S,Zheng Z,Weng Y,et al.Angiogenesis and anti-angiogenesis activity of Chinese medicinal herbal extracts.Life Sci,2004,74:2467-2478.
8 Rubinstein AL.Zebrafish:from disease modeling to drug discovery.Curr Opinion Drug Discover Dev,2003,6:218-223.
9 Wei YJ(韦英杰),Ning Q(宁青),Jia XB(贾晓斌).Thoughts and methods for metabolic study of Chinese material medical based on zebrafish model.Chin Tradit Herb Drug(中草药),2009,40:1009-1011.
10 Serbedzija GN,Flynn ED,Willett CE.Zebrafish angiogenesis:A new model for drug screening.Angiogenesis,1999,3:353-359.
11 Zheng HJ(郑浩江).Screening of active ingredient of antiangiogenic Chinese medicine and studying its mechanism in transgeniczebrafish.Guangzhou:Southern Medical University(南方医科大学),MSc.2013.
12 Han LW(韩利文),He QX(何秋霞),Zhao L(赵亮).Study of structure-angiogenic activity relationship of indirubin and its derivatives using Zebrafish model.Chin J Mod Appl Pharm(中国现代应用药学),2013,5:457-460.
13 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China (中华人民共和国药典).Beijing:China Medical Science Press,2010.Vol I,32-1006.
14 Du GH.High Throughput Screening (高通量药物筛选).Beijing:Chemical Industry Publishers,2002.
15 Langenau DM,Traver D,Ferrando AA,et al.Myc-induced T cell leukemia in transgenic zebrafish.Science,2003,299:887-890.
16 Childs S,Chen JN,Garrity DM,et al.Patterning of angiogenesis in the zebrafish embryo.Development (Cambridge),2002,129:973-982.
17 Parngc,Sengwl,Semino C,et al.Zebrafish:a preclinical model for drug screening.Assay Drug Dev Technol,2002,1:41-48.
18 Cross LM,Cook MA,Lin S,et al.Rapid analysis of angiogenesis drugs in a live fluorescent zebrafish assay.Arterioscler Thromb Vasc Biol,2003,23:911-912.
19 Zheng HJ(郑浩江),Xu WX(许文学),Liu XW(刘晓伟).Indirubin inhibits angiogenesis in zebrafish embryos and its mechanism.Clin Pharmacol Tradit Chin Med(中药药理与临床),2012,28(4):32-34.
20 Wang SF(王思锋),Liu KC(刘可春),Wang XM(王希敏).Effect of Xihuang pill on angiogenesis in zebrafish embryo.J Chin Hospital Pharm (中国医院药学杂志),2010,30:821-823.
21 Tian LL(田丽莉),Dong JY(董建勇),Huang CJ(黄长江).Effect and mechanism of curcumol on angiogenesis activity of zebrafishes.China J Chin Mater Med(中国中药杂志),2012,31:1822-1825.
22 Yuan SL(袁淑兰),Wang XJ(王修杰).Anticancer effect of tanshinone and its mechanism.Chin J Cancer(癌症),2003,22:1363-1366.
23 Wei J,Liu B,Wang L,et al.Synergistic interaction between tetrandrine and chemotherapeutic agents and influence of tetrandrine on chemotherapeutic agent-associated genes in human gastric cancer cell lines.Cancer Chemother Pharmacol,2007,60:703-711.
