悬浮培养发状念珠蓝细菌对盐碱胁迫的生理应答研究
2015-01-08郭金英朱蓓茹任国艳崔国庭张玉先冯惠敏
郭金英,朱蓓茹,吴 影,任国艳,王 萍,崔国庭,张玉先,冯惠敏
河南科技大学食品与生物工程学院,洛阳 471023
发状念珠蓝细菌主要分布于我国北部和西北部的干旱和半干旱地区,这一地区存在着大面积既含有中性盐(Na2SO4)又含有碱性盐(Na2CO3)的盐碱化土壤,大部分耕作层土壤盐含量在0.78%~1.68%[1],盐碱影响着作物的生长。发状念珠蓝细菌是具有生长优势的固氮生物,可为其它土壤微生物的生长提供碳源和氮源,是荒漠化土壤中的“先锋生物”,具有极强的耐旱、耐碱、耐高温等能力。因而,发状念珠蓝细菌在我国西部环境治理和生态恢复方面,具有特殊的地位和重要的生态学意义。毕永红等对天然发状念珠蓝细菌藻体进行不同浓度的盐胁迫处理,指出盐胁迫下天然发状念珠蓝细菌正常生理活性受到抑制而表现出一定的抗逆能力,发状念珠蓝细菌对盐胁迫具有一定的耐受性,添加外源硝酸盐后有助于缓解发状念珠蓝细菌细胞培养物的盐胁迫,提高其抗盐性[2-4]。本研究以悬浮培养的发状念珠蓝细菌细胞为材料,研究盐碱胁迫下悬浮发状念珠蓝细菌细胞质膜透性、超氧化物歧化酶(SOD)、丙二醛(MDA)、脯氨酸(Pro)、可溶性蛋白以及可溶性多糖含量的变化,探讨液体悬浮培养下发状念珠蓝细菌细胞对盐碱胁迫的响应,认识悬浮培养发状念珠蓝细菌对盐碱胁迫的适应性,指导发状念珠蓝细菌的人工培养,具有重要的理论意义和实践价值。
1 材料与方法
1.1 材料
发状念珠蓝细菌种(Nostoc flagelliforme)由工业微生物教育部重点实验室提供,本实验室分离纯化后扩大培养。经活化后无菌条件下4000 rpm 离心10 min,收集离心后细胞,重新悬浮于新鲜的BG-11液体培养基中。
1.2 盐碱胁迫处理
离心收集分离纯化后的发状念珠蓝细菌细胞5 mL,无菌条件下,分别接种于含体积比1∶1 混合的Na2SO4和Na2CO3(0、60、120、180、240 mmoL/L)的100 mL BG-11 培养基中,25 ℃,80 μmol/(m2·s)光照强度下培养,分别培养24 h 和72 h,以不加盐碱的空白组为对照,进行测定,每种处理做3 组平行。
1.3 质膜透性测定
参照李合生[5]的方法,称取离心后不同处理的发状念珠蓝细菌细胞各2 g,放入烧杯中,加入20 mL 去离子水,25 ℃下静置10 h。用玻璃棒轻轻搅拌均匀,恒温下用电导仪测定溶液电导率。再将试管放入100 ℃沸水中恒温水浴15 min,待其冷却至25 ℃时,恒温测定煮沸液电导率。
电解质相对渗透率(%)=(处理液电导率值/煮沸液电导率值)×100%
1.4 丙二醛(MDA)含量测定
参照Tsarouhas[6]的方法,取0.5 g 发状念珠蓝细菌细胞加5 mL 50 mM(pH 7.8)磷酸缓冲匀浆,4000 rpm 离心取上清液1 mL,加2.5 mL 0.6% TBA(硫代巴比妥酸)溶液混匀,加塞,沸水浴15 min,迅速冷却,离心,取上清液分别测定其在532、600、450 nm 波长处的吸光度。
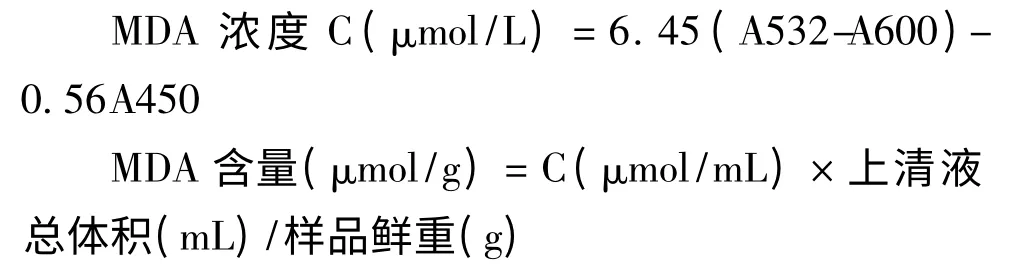
1.5 超氧化物歧化酶(SOD)酶活性测定
参照王星[7]的方法,取0.5 g 发状念珠蓝细菌细胞加5 mL50 mM(pH7.8)磷酸缓冲匀浆,13000 rpm 4 ℃离心10 min,上清液即为酶提取液。取透明度好的干净试管,按表1 加入各溶液组分。

表1 SOD 反应液Table 1 The component of SOD reaction mixture
混匀后将2 支对照管置暗处做空白对照,其余各管于80 μmol/(m2·s)光下反应25 min,反应结束后,以不照光的对照管为空白,测OD560值。SOD酶活性以抑制NBT 光化学反应的50%为一个酶活性单位(U),计算SOD 酶活性。
1.6 脯氨酸(Pro)含量测定
采用酸性茚三酮法[8]。准确称取离心后的发状念珠蓝细菌细胞0.5 g,加入5 mL 3%的磺基水杨酸匀浆,放入具塞试管内,沸水水浴浸提10 min;不断震荡摇动,冷却,3000 rpm 离心10 min 后静置,上清液即为提取的脯氨酸溶液。取2 mL 提取液加入2 mL 冰醋酸和4 mL 酸性茚三酮,沸水浴60 min,溶液为红色,冷却后加入4 mL 甲苯,震荡30 s,静置片刻,吸取上层红色甲苯溶液于比色杯中,以甲苯为空白对照,测OD520值。
1.7 可溶性蛋白含量测定
采用考马斯亮蓝法[9]。取上述SOD 提取液1 mL 加5 mL 考马斯亮蓝后摇匀,放置2 min 后,以蒸馏水做空白,595 nm 比色,测OD595。
1.8 可溶性多糖含量测定
采用蒽酮比色法。称取不同处理的发状念珠蓝细菌细胞0.5 g,加入5 mL 10%的TCA 匀浆后浸泡,离心,取上清液1 mL 加5 mL 蒽酮,沸水中煮10 min,流水冷却,冷却后在室温下静置10 min,以80%乙醇调零,测定626 nm 波长处的吸光度。
1.9 统计分析
2 结果与分析
2.1 盐碱对发状念珠蓝细菌细胞膜透性的影响
由图1 可以看出:随着盐碱胁迫浓度的增大,细胞外渗率先是迅速增加,后逐渐趋于平稳,细胞膜受到严重伤害,外渗率达到80%以上。胁迫时间越长,细胞膜受到的伤害越严重;比较盐碱胁迫24 h和72 h 结果发现,胁迫72 h 较24 h 同期高出约13%。

图1 盐碱对发状念珠蓝细菌细胞外渗率的影响Fig.1 Effect of salinity-alkalinity on electrolyte leakage of N.flagelliforme cell
2.2 盐碱对发状念珠蓝细菌细胞MDA 含量的影响

图2 盐碱对发状念珠蓝细菌细胞MDA 含量的影响Fig.2 Effect of salinity-alkalinity on MDA content of N.flagelliforme cell
由图2 可以看出,随着盐碱浓度增加和时间延长,MDA 含量呈不断上升的趋势,与对照相比,差异极显著(P<0.01);高浓度的盐碱对发状念珠蓝细菌细胞的伤害程度更大,盐碱浓度为240 mmol/L 时MDA 的增加量约是60 mmol/L 下增加量的7 倍;随着盐碱浓度的增加,24 h 胁迫下MDA 含量的增加明显较72 h 胁迫下平缓得多,表明时间越长,盐碱对发状念珠蓝细菌细胞膜脂过氧化程度的伤害越大。
2.3 盐碱对发状念珠蓝细菌细胞SOD 酶活性的影响
SOD 作为超氧自由基清除剂,其活性与生物体抗逆性大小有一定的关系,在适度的逆境诱导下,SOD 活性增加以提高生物体的适应能力。图3 所示,随着盐碱胁迫浓度的增加,SOD 活性先上升后下降,然后逐渐趋于平稳,在胁迫浓度为120 mmol/L 时达到最大值;比较盐碱胁迫不同时间发状念珠蓝细菌细胞的SOD 活性发现,24 h 和72 h 胁迫趋势基本相同。
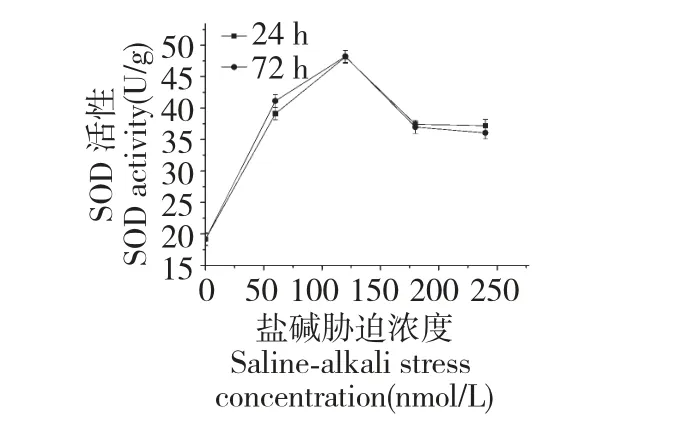
图3 盐碱对发状念珠蓝细菌细胞SOD 酶活性的影响Fig.3 Effect of salinity-alkalinity on SOD activity of N.flagelliforme cell
2.4 盐碱对发状念珠蓝细菌细胞脯氨酸含量的影响
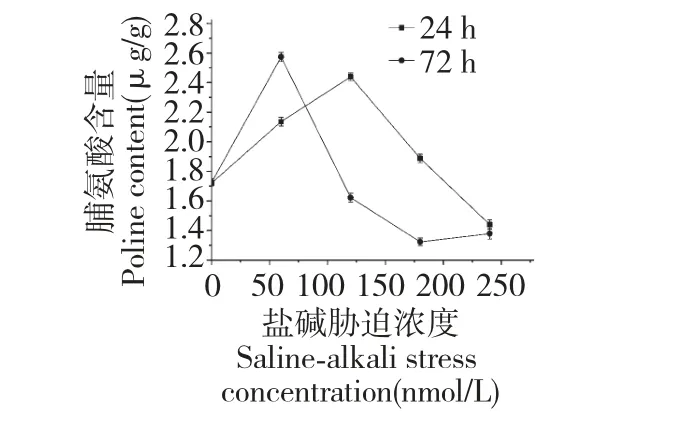
图4 盐碱对发状念珠蓝细菌细胞脯氨酸含量的影响Fig.4 Effect of salinity-alkalinity on Pro content of N.flagelliforme cell
脯氨酸作为一种重要的渗透调节物质,含量升高时,不仅有利于吸收水分,保持水分,同时可以对细胞内的一些酶类起到保护作用。由图4 可以看出,24 h 和72 h 胁迫过程中发状念珠蓝细菌细胞脯氨酸含量均出现先上升后下降的趋势。胁迫24 h,120 mmol/L 时达到最大值,最大增加量为0.7 μg/g;胁迫72 h,60 mmol/L 时达到最大值,最大增加量为0.9 μg/g。表明,脯氨酸与发状念珠蓝细菌细胞的抗盐碱性之间并没有明显的直接关系,仅在浓度较低时,小于60 mmol/L 时起到一定的保护作用,但影响较小,表明在盐碱胁迫下,发状念珠蓝细菌细胞几乎不受脯氨酸的渗透调节保护作用。
2.5 盐碱对发状念珠蓝细菌细胞可溶性蛋白含量的影响
由图5 可知,随着盐碱浓度的增大,发状念珠蓝细菌细胞中的可溶性蛋白含量呈下降趋势,72 h 胁迫后可溶性蛋白含量显著下降,这可能是由于盐碱胁迫使得发状念珠蓝细菌细胞受到离子毒害作用,导致发状念珠蓝细菌细胞中蛋白质的分解,同时也说明了盐碱胁迫作用下,发状念珠蓝细菌细胞中的可溶性蛋白没有发挥有效的保护作用。
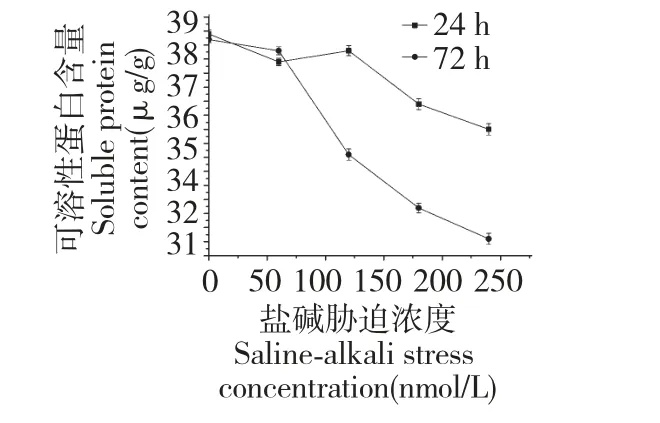
图5 盐碱对发状念珠蓝细菌细胞可溶性蛋白含量的影响Fig.5 Effect of salinity-alkalinity on soluble protein content of N.flagelliforme cell
2.6 盐碱对发状念珠蓝细菌细胞可溶性多糖含量的影响
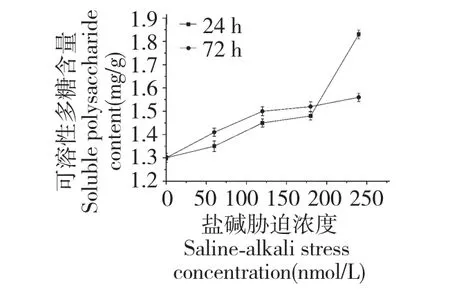
图6 盐碱对发状念珠蓝细菌细胞可溶性多糖含量的影响Fig.6 Effect of salinity-alkalinity on soluble polysaccharide of N.flagelliforme cell
可溶性多糖作为发状念珠蓝细菌细胞中主要的还原性糖,与其抗逆性有很大关系。在发状念珠蓝细菌细胞的盐碱胁迫过程中,随着盐碱浓度的增加,可溶性多糖含量持续上升(图6),且发状念珠蓝细菌细胞胁迫24 h 受到可溶性多糖的保护明显多于胁迫72 h。
3 讨论
发状念珠蓝细菌因生存环境独特,长期适应环境,使其结构和生理生化发生了不同程度的变化。在盐碱胁迫环境条件下,发状念珠蓝细菌膜结构和功能发生了适应性变化。随盐碱度的增加,细胞内电解质外渗率不断上升,质膜透性不断增大。电解质外渗率直接表示了细胞膜透性的变化,反映出逆境中细胞膜的受损程度。膜脂的过氧化作用是破坏细胞膜系统的重要原因之一,电解质的不断外渗,改变了细胞的内环境平衡[10],这种平衡的破坏导致氧自由基在膜脂表面积累,MDA 作为脂质过氧化的产物,其含量随着盐碱度的上升而增长,间接反映了这些活性氧簇的积累对细胞膜的过氧化损伤的加剧,这与焉婷婷等[11]的报道一致。
生物体内酶活性的改变是细菌抗盐碱胁迫的机制之一。SOD 能够有效的清除体内的超氧自由基,在多种环境胁迫中发挥重要的保护作用[12]。盐碱胁迫处理过程中,SOD 酶活性表现为先上升后下降,表明SOD 在一定程度上对发状念珠蓝细菌细胞起到了保护作用。曹特[13]对金鱼藻抗氧化酶活力测定结果表明,硝酸盐处理下SOD 和CAT 活性在24 h 时才有明显升高;铵盐处理下CAT 活性变化最大,在5~15 h 时其活性与处理浓度正相关,更长时间24 h 处理则导致响应停止。一些蓝藻细胞如螺旋藻[14]和盐生隐杆藻[15]进行盐胁迫处理后也得到了相似的结论。
综合本研究结果,在研究的盐碱浓度范围内,发状念珠蓝细菌细胞SOD 在一定程度上对发状念珠蓝细菌细胞起到了保护作用,可溶性糖积累调节了细胞渗透势,保护了细胞膜的完整性,减少了细胞伤害。
1 Han DH(韩多红),Zhang Y(张勇),Jin L(晋玲).Effect of basic salt and mixed salt-alkali stress tolerance on seed germination and seedling physiological characteristics of Astraglus membranaceus var.mongholicus.Chin Tradit Herb Drugs(中草药),2013,43:1661-1666.
2 Bi YH(毕永红),Deng ZY(邓中洋),Hu ZY(胡征宇),et al.Response of Nostoc flagelliforme to salt stress.Acta Hydrobiol Sin (水生生物学报),2005,29:125-129.
3 Zhao XM(赵学敏),Bi YH(毕永红),Qin S(秦山),et al.The response of cultivated Nostoc flagelliforme to salt stress.Acta Botan Boreali-occidentalia Sin(西北植物学报),2005,25:2234-2239.
4 Zhao XM(赵学敏).Studies on the physiology and ecology of cultivated Nostoc flagelliforme.Wuhan:Institute of hydrobiology,2008.
5 Li HS(李合生),Sun Q(孙群),Zhao SJ(赵世杰),et al.The Principle and Technology of Plant Physiology and Biochemistry experiment.Beijing:High Education Press,1999.258-261.
6 Tsarouhas V,Kenney WA,Zsufa L.Application of two electrical methods for the rapid assessment of freezing resistance in Salix eriocephala.Biomass Bioenerg,2000,19:165-175.
7 Wang X(王星).Differential proteomics analysis of Nostoc flagelliforme subjected to desiccation.Yinchuan:Ningxia University,2010.
8 Zhang DZ(张殿忠),Wang PH(汪沛洪),Zhao HX(赵汇贤).Determination of the content of free proline in wheat leaves.Plant Physiol Commun(植物生理通讯),1990,4:62-65.
9 Li RL(李如亮),Wang YZ(王延芝),Zhang CF(张楚富).Biochemistry Experiment.Wuhan:Wuhan University Press,1998.
10 Gao KS,Qiu BS,Xia JR.Light dependency of the photosynthetic recovery of Nostoc flagelliforme.J Appl Phycol,1998,10:51-53.
11 Yan TT(焉婷婷),Zhou YW(周亚维),Li PF(李朋富),et al.Antioxidant responses to hyposaline and hypersaline stresses in the euryhaline diatom navicula lanceolata.J Salt Chem Ind(盐业与化工),2010,39(5):15-19.
12 Rajendran UM,Kathirvel E,Anand N.Desiccation induced changes in antioxidant enzymes,fatty acids,and amino acids in the cyanobacterium Tolypothrix scytonemoides.World J Microbiol Biotechnol,2007,23:251-257.
13 Cao T(曹特),Ni LY(倪乐意).Responses of antioxidases of Ceratophyllum demersum to the increase of inorganic nitrogen in water column.Acta Hydrobiol Sin (水生生物学报),2004,28:299-302.
14 Liu ZL(刘志礼),Li PY(李鹏云).The effect of NaCl stress on the antioxidase activities and growth of Spirulina maxima.Chin Bull Botany (植物学通报),1998,15(3):43-47.
15 Zhou YW(周亚维),Yan TT(焉婷婷),Li PF(李朋富),et al.Changes in antioxidative defense systems of Aphanothece halophytica in response to salt stresses.Marine Sci(海洋科学),2010,34(9):30-35.
