聚酰胺色谱结合高速逆流色谱分离制备萹蓄黄酮类化合物
2015-01-08孙兆林王岱杰段文娟
孙兆林,王 晓,王岱杰,李 佳,段文娟*
1山东中医药大学药学院,济南 250355;2山东省分析测试中心山东省大型精密分析仪器应用技术重点实验室,济南 250014
萹蓄为蓼科植物萹蓄Polygonum aviculare L.的干燥地上部分[1-3]。《本草纲目》中载,用于“治霍乱,黄疸,利小便”。《滇南本草》载:“利小便。治五淋白浊、热淋、瘀精涩闭关窍,并治妇人气郁,胃中湿热,或白带之症”等效用。现民间广泛用其治疗泌尿系统的感染,结石及肾炎等疾病[4-6]。现代临床学报道:萹蓄对非胰岛素依赖性糖尿病患者的治疗是一种理想的药物,疗效显著而持久,且无毒副作用[7]。因此建立相关成分的高效分离纯化方法具有重要意义。
目前,萹蓄中化学成分的分离纯化主要采用薄层色谱、硅胶柱色谱、聚酰胺柱色谱等传统的分离纯化方法[8]。这些方法存在耗时长、容易造成样品的不可逆吸附变性及样品回收率低等缺点。高速逆流色谱技术(high-speed counter-current chromatography,HSCCC)是不使用固态载体的液-液分配色谱[9,10],根据样品在两相溶剂中分配系数的不同实现样品的分离,避免了固相载体对样品的不可逆吸附、变性等缺点,已广泛应用于天然产物的分离纯化领域[11-16]。本研究首先采用聚酰胺色谱法对萹蓄中的黄酮类化合物进行富集,然后采用HSCCC 对富集了黄酮类成分的馏分进行分离纯化,通过两种色谱方法的结合,实现了对萹蓄中黄酮类化合物快速、有效的分离纯化,得到了3 个高纯度的黄酮类化合物,分别为杨梅树皮苷,黄芪苷和合欢草素1(图1),为萹蓄资源的进一步开发应用提供了一定的参考依据。

图1 杨梅树皮苷、黄芪苷、合欢草素1 化学结构式Fig.1 Chemical structures of myricitrin,astragalin and desmanthin-1
1 仪器与材料
高速逆流色谱仪(上海同田生物技术有限公司)、TBP5002 泵(上海同田生物技术有限公司)、8823-B 紫外检测器(北京宾达英创科技有限公司)、3057-11 记录仪(重庆川仪总厂有限公司)、旋转蒸发仪(巩义市予华仪器有限公司)、KDM 型调温电热套(山东光明仪器有限公司)、超声波清洗仪(宁波新芝生物科技股份有限公司)、SHB-B95 型循环水式多用真空泵(郑州长城科技工贸有限公司)、恒温循环器(郑州长城科技工贸有限公司)。Waters 600-996 高效液相色谱系统(配有光电二极管阵列检测器(PDA),美国Waters 公司)、Varian INOVA-600 核磁共振波谱仪(美国Varian 公司)、Agilent 1100 Series 6320 ion-trap 质谱仪(美国Agilent 公司),Agilent 6890N-5973N 气相色谱/质谱联用仪(美国Agilent 公司)。
甲醇、石油醚和乙酸乙酯均为分析纯(中国医药集团上海化学试剂公司);甲醇为色谱纯(美国天地公司);实验用水为过滤蒸馏水及娃哈哈纯净水;柱层析用聚酰胺粉(台州市路桥四甲生化塑料厂)。萹蓄药材购自山东中医药大学中鲁医院,经山东中医药大学李佳教授鉴定为蓼科植物萹蓄的全草。
2 实验方法
2.1 萹蓄粗提物的制备
将购买的2 kg 萹蓄药材,经粉碎机粉碎,过40目筛。将2 kg 药材粉末平均置于两个10 L 的圆底烧瓶中,加入6 倍量药材的95%乙醇,加热回流提取3 次,每次2 h,合并滤液,减压蒸馏浓缩至无醇味。浓缩液用适量水混悬后,依次用等体积的石油醚、乙酸乙酯萃取三次,得到乙酸乙酯层样品38.4 g。
2.2 聚酰胺色谱初步分离
聚酰胺的前处理:将聚酰胺放在95%的优质工业乙醇中煮沸0.5 h,取出晾干,换上新的乙醇再煮,重复3~4 次,直至乙醇液无白色为止,取出晾干备用。
乙酸乙酯萃取物用甲醇溶解,均匀的拌样于100 g 聚酰胺中,置70 ℃水浴锅上蒸干上柱,依次用30%、60%、95%的乙醇洗脱,分别冲洗三个柱体积,减压蒸干洗脱液分别得到馏分1(4.2 g)、馏分2(8.4 g)、馏分3(2.2 g)三个馏分,经HPLC 检测,馏分2(60%乙醇洗脱液)中具有黄酮类成分特征紫外吸收色谱峰(253 nm 和361 nm)的成分较多。
2.3 分配系数KD的测定
取少量样品置于1.5 mL 试管中,加入等量的上下相各0.5 mL,剧烈震荡0.5 min,使样品充分溶解,静置分层,取上下相各5 μL 分别用高效液相色谱(HPLC)进行检测,上相峰面积为A1,下相峰面积为A2,分配系数KD=A1∕A2。
2.4 两相溶剂体系及样品溶液的制备
本实验所用溶剂体系为乙酸乙酯-甲醇-水-甲酸(体积比4∶1∶5∶0.1),按比例配制于分液漏斗中,剧烈振荡使溶液充分混合,室温下静置过夜,分出上下相,使用前超声脱气30 min 备用。
称取馏分2 样品150 mg,加入上下相各10 mL,振荡使其完全溶解,用于HSCCC 分离。
2.5 HSCCC 法分离制备过程
将两相溶剂体系中已超声脱气的上相(固定相),以20 mL/min 的流速泵入HSCCC 螺旋管中,待上相充满整个螺旋管后,缓慢调节主机转速至850 rpm,顺时针旋转,待转速稳定后,自HSCCC 首端以2.0 mL/min 流速泵入下相,同时开启紫外检测器,检测波长为254 nm ;待上下相平衡后,将20 mL样品溶液通过六通进样阀注入HSCCC 色谱仪,根据色谱图收集各色谱峰馏分。
2.6 HPLC 条件
萹蓄馏分2 样品和HSCCC 分离后各色谱峰用HPLC 分析。色谱柱:Inertsil ODS-SP(250 mm ×4.6 mm,5 μm);柱温:25oC;检测波长:254 nm;流动相:甲醇(A),0.2%甲酸水溶液(B),梯度洗脱程序:0~20 min,30%~70% A;20~30 min,70%~100%A;30~35 min,100% A。流速:1.0 mL/min;进样量:10 μL。
3 结果与讨论
3.1 HSCCC 分离条件优化
溶剂体系的选择是HSCCC 分离中的首要和关键环节,溶剂体系合适与否是由目标化合物在两相溶剂中的分配系数(KD)来衡量的。一般而言,对HSCCC 最合适的KD值范围是0.5~2.0[17]。本实验测定了目标化合物在不同体积比的乙酸乙酯-甲醇-水-甲酸溶剂体系中的KD值。实验结果表明,当采用乙酸乙酯-甲醇-水-甲酸(体积比为4∶1∶5∶0.1)两相溶剂体系时,可实现目标化合物的分离。目标化合物在不同比例的乙酸乙酯-甲醇-水-甲酸体系中的KD见表1。由表1 可看出乙酸乙酯-甲醇-水-甲酸的体积比为3∶1∶6∶0.1、3∶2∶5∶0.1 时,3 种化合物的KD差异较大,能保证各组分间具有较好的分离度,但同时各物质在固定相中的分配较多且黄酮类化合物在固定相中的KD偏大,若采用这2 种溶剂体系会使整体的分离时间过长,分离效率低,难以实现萹蓄中黄酮类成分的快速高效分离纯化。如图2 所示,应用乙酸乙酯-甲醇-水-甲酸(体积比为4∶1∶5∶0.1)为两相溶剂体系时,3 种黄酮类成分能够在3h 之内实现分离且分离效果良好。

表1 萹蓄60%乙醇粗提物中3 种化合物在不同比例溶剂体系中的KD值Table 1 Partition coefficients (KD)of the 3 flavones from P.aviculare crude extract under different two-phase solve systems
3.2 HSCCC 分离纯化的结果
以乙酸乙酯-甲醇-水-甲酸(4∶1∶5∶0.1,v/v)为两相溶剂体系,按照1.6 节所述的方法对萹蓄馏分2 进行分离纯化。将150 mg 样品溶于20 mL 等体积上相和下相混合溶液中进行HSCCC 分离(分离谱图见图2),根据图2 进行手动分段收集,得到化合物I、II,在尾吹液中得到化合物III。将各馏分减压浓缩干燥,其质量依次为7.5、13.8、20.6 mg。经过HPLC 分析并应用面积归一法测定1、2、3,3 个化合物的纯度分别为94.86%、94.28%和91.86%(分析结果见图3)。
3.3 化合物的结构鉴定

图2 萹蓄中黄酮类化合物的高速逆流图谱Fig.2 HSCCC chromatogram of flavone compounds from P.aviculare
化合物1 黄色粉末;FAB-MS(m/z):465([M+H]+,100);EI-MS m/s(rel.int.%):318(100),289(6),149(6),128(75),113(28),102(6),85(14),71(33),58(82)。1H NMR(600 MHz,DMSOd6),δ:6.88(2H,s,H-2',H-6'),6.37(1H,d,J=1.8 Hz,H-8),6.19(1H,d,J=1.8 Hz,H-6),5.19(1H,br,s,H-1''),0.84(3H,d,J=5.4 Hz,H-6'')。化合物1 的FAB-MS 和1H NMR 数据与文献[18]报道基本一致,故鉴定化合物1 为杨梅树皮苷。
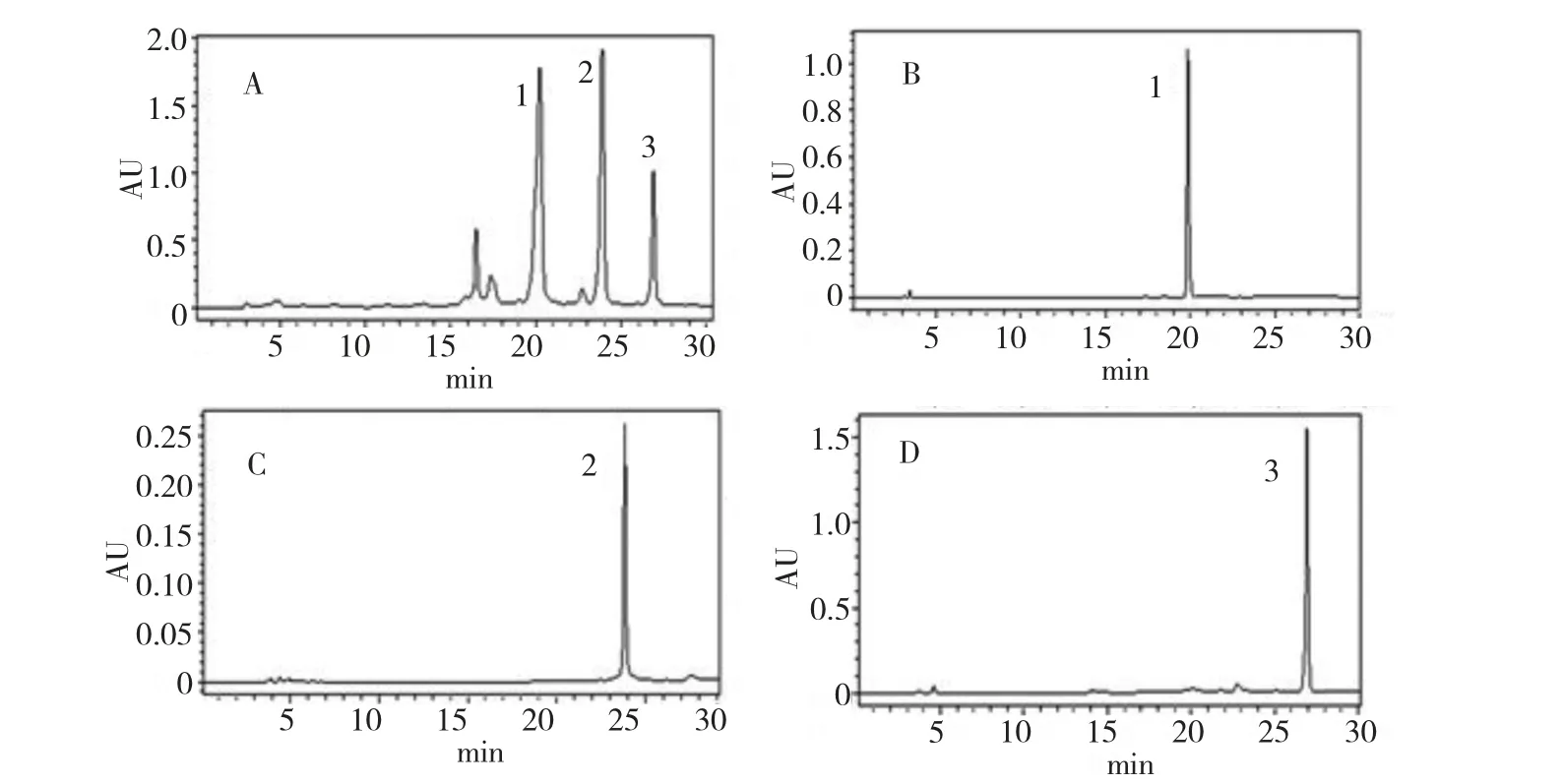
图3 萹蓄中黄酮类化合物组分总样(A)、杨梅树皮苷(1)(B)、黄芪苷(2)(C)、desmanthin-1(3)(D)的HPLC 色谱图Fig.3 HPLC chromatograms of P.aviculare crude extract (A),myricitrin (1)(B),astragalin (2)(C)and desmanthin-1 (3)(D)
化合物2 黄色粉末;FAB-MS(m/z):447([MH]-,100);EI-MS m/s(rel.int.%):286(100),258(16),213(9),184(3),121(25),105(4),93(8),65(15)。1H NMR (600 MHz,DMSO-d6),δ:12.61(s,5-OH),8.03(2H,d,J=8.4 Hz,H-2',H-6'),6.87(2H,d,J=8.4 Hz,H-3'.H-5'),6.42(1H,d,J=2.4 Hz,H-8),6.19(1H,d,J=2.4 Hz,H-6),5.45(1H,d,J=7.2 Hz,H-1'')。化合物2 的FAB-MS和1H NMR 数据与文献[18]报道基本一致,故鉴定化合物2 为黄芪苷。
化合物3 黄色粉末;FAB-MS(m/z):615([MH]-);EI-MS m/z(rel.int.%):318(65),194(6),170(29),153(23),126(100),108(21),97(9),80(31)。1H NMR(600 MHz,DMSO-d6),6.93(2H,s,H-2',6'),6.38(1H,d,J=2.4 Hz,H-8),6.20(1H,d,J=2.4Hz,H-6),5.48(1H,s,H-2''),5.47(1H,d,J=3.0 Hz,H-1''),0.84(3H,d,J=3.6 Hz,H-6'')。化合物3 的FAB-MS 和1H NMR 数据与文献[18]报道基本一致,故鉴定化合物3 为合欢草素1。
4 结论
萹蓄中的黄酮类化合物在结构和性质方面非常相似,采用传统的硅胶柱色谱、高效制备液相、聚酰胺柱色谱分离纯化十分困难。本实验首先应用聚酰胺柱色谱法对萹蓄中的黄酮类化合物进行富集,然后采用HSCCC 对富集的黄酮类化合物进行分离纯化,得到3 个高纯度的黄酮类化合物杨梅树皮苷、黄芪苷、合欢草素1。该方法简便、快速、节省溶剂,具有较好的实用价值,为进一步开发利用萹蓄资源提供了一定的技术支撑。
1 Chinese Pharmacopoeia Commission (国家药典委员会).Pharmacopoeia of the People’s Republic of China(中国药典).Beijing:China Medical Science Press (北京化学工业出版社),2005,235.
2 Jiangsu New Medical College(江苏新医学院).Chinese Medicine Dictionary[中药大辞典(下册)].Shanghai:Shanghai People's Publishing House (上海人民出版社),1977,2330-2330.
3 Dai RC(代容春),He WJ(何文锦),Chen PQ(陈培泉),et al.Determination of flavones in Polygonum aviculare L..Chin Wild Plant Res (中国野生植物资源),2003,22(6):67-69.
4 Yan JM(严健民).The history status of the Bladder meridians of Foot-Taiyang in the theory of meridian.Chin J Basic Med Tradit Chin Med(中国中医基础医学杂志),2003,9(11):57-59.
5 Meng ZW(孟昭威).The origin of formation and outlooks of the theory of meridian.Chin Acupunc(中国针灸),1982,5:25-28.
6 Zhao RF(赵荣芳).Clinical observation of Polygonum aviculare L.on treatment of in 25 diabetic patients.Acta Acad Med Nantong(南通医学院学报),1995,15:247-275.
7 Jiang CE(姜彩娥),Hao R(郝睿),Li CP(李春平).Distribution and drug resistance analysis of pathogenic bacteria causing urinary system infections.Chin Pharm Aff(中国药事),2006,20:311.
8 Yu S,Yu ZY,Duan WJ,et al.Isolation and purification of seven lignans from Magnolia sprengeri by high-speed counter-current chromatography.J Chromatogr B,2011,879:3775-3779.
9 Wang DJ(王岱杰),Liu JH(刘建华),Geng YL(耿岩玲),et al.The high-speed counter-current chromatography separation and purification of alkaloids Corydalis Decumbens(Thunb.)Pers.Chin J Anal Chem (分析化学),2010,38:783-788.
10 Sun YS(孙印石),Liu ZB(刘政波),Wang JH(王建华),et al.Preparative isolation and purification of flavones from pericarpium citriReticulatae by high-Speed counter current chromatography.Chin J Chromatogr(色谱),2009,27:244-247.
11 Wang X,Shi XG,Li FW,et al.Application of analytical and preparative high-speed counter-current chromatography for the separation of z-ligustilide from a crude extract of Angelica sinensis.Phytochem Anal,2008,19:193-197.
12 Zhao AH(赵爱华),Zhao QS(赵勤实),Lin ZW(林中文),et al.The chemical composition of Polygonum aviculare L..Nat Prod Res Dev(天然产物研究与开发),2002,14(5):29-32.
13 Zhao HL(赵会礼).Determination of quercetin in Polygonum aviculare L.and P.plebeium R.Br.by HPLC.J Chin Med Pharmacol(中医药学报),2004,32:17-20.
14 Xu XY(胥秀英),Zheng YM(郑一敏),Fu SQ(傅善权),et al.Quantitative determination of hyperoside and quercitrin and luteolin in Polygonum aviculare by HPLC.Lishizhen Med Mater Med Res(时珍国医国药),2006,17:563-564.
15 Zheng XD(郑旭东),Hu HB (胡浩斌),Zheng SZ(郑尚珍),et al.Studies on thevolatile constitiuents of Polygonum aviculare L.J Northwest Norm Univ,Nat Sci(西北师范大学学报,自科版),1999,35(3):68-70.
16 Shu XK,Duan WJ,Liu F,et al.Preparative separation of polyphenols from the flowers of Paeonia lactiflora Pall.by high-speed counter-current chromatography.J Chromatogr B,2014,947-948:62-67.
17 Guan RJ(管仁军),Wang DJ(王岱杰),Yu ZY(于宗渊),et al.Preparative isolation and purification of the active components from Viticis Fructus by high-speed counter-current chromatography.Chin J Chromatogr (色 谱),2010,28:1043-1047.
18 Chen XH(陈晓虎),Chen DF(陈道峰).The study on chemical constituents of Polygonum aviculare L..China J Chin Materia Med(中国中药杂志),2004,29:918-919.
