五倍子有效组分的分离纯化及抗弧菌活性分析
2015-01-08李忠琴黄文树江兴龙
李忠琴,靳 恒,林 茂,黄文树,江兴龙
集美大学水产学院 鳗鲡现代产业技术教育部工程研究中心,厦门 361021
水产养殖规模的不断扩大和集约化养殖的发展,造成养殖环境的日益恶化,因此近年来水产养殖病害发病率越来越高。鱼类细菌性疾病具有发病快,感染率高等特点,是养殖鱼类中最为常见的一类疾病。其中,弧菌是近年来危害我国养殖业比较严重的鱼类病原菌。弧菌生长的适宜温度为17~35℃[1],广泛分布于世界各地海水及河口处[2]。其对养殖动物的致病性多发生在夏季[3],在水温25~32℃下容易流行[4]。此外,也有大量报道弧菌对人具有致病性,可引起人食物中毒[5]。
传统防治鱼类细菌性疾病的手段主要是使用抗菌化学类药物进行治疗,但抗生素的长期使用导致病菌的耐药株大量增加;其次,大量使用抗菌化学类药物,是造成水产品体内药物残留过量的一个重要原因[6]。我国中药资源相当丰富,具有纯天然、高效、毒副作用小、抗药性不显著等优点。近年来有不少学者对中药抑制鱼类致病菌进行了详细的研究,王玉娥[7]等采用纸片扩散法(K-B 法)测定了34 种中药对5 种海洋致病菌的体外抑制作用,研究结果显示五倍子的体外抑菌效果最好,对溶藻弧菌、副溶血弧菌、河流弧菌、麦式弧菌的最低抑菌和杀菌浓度均为1.56 mg/mL,对哈维氏弧菌的最低抑菌和杀菌浓度为3.125 mg/mL。在进行中药防治鱼类细菌性疾病的研究方面,大多是体外抑菌试验和药饵防治试验,对中药防治鱼病的机理和发挥疗效的物质基础方面研究还很薄弱。由于中药中有效物质基础尚不清楚,限制了中药的有效开发和综合利用。
五倍子为漆树科漆树属盐肤木(Rhus chinensis Mill)的叶或叶柄因受五倍子蚜虫的刺伤而形成的囊状虫瘿,是一种可治疗多种疾病的中药材,在水产养殖中常用于防治细菌性疾病。本研究采用高速逆流色谱法对五倍子主要组分进行分离提取,并利用微量热法分析各分离组分对弧菌的抑制活性,筛选出五倍子中具有抑菌活性的有效组分。该研究旨在建立一种分离制备中药材有效组分和筛选评价其生物活性的方法,研究成果将为中药有效组分应用于防控水产动物细菌性疾病提供理论依据及参考。
1 材料与方法
1.1 试剂与仪器
弧菌致病株G1-1 由鳗鲡教育部工程中心的病原菌库提供,经Biolog 系统鉴定,并进行攻毒实验确定为强毒株;五倍子购于福建铭远制药有限公司;MH 肉汤培养基(青岛高科园海博生物技术有限公司);无水乙醇、氯仿、正己烷、乙酸乙酯、甲醇、正丁醇、醋酸、磷酸、二甲基亚砜(DMSO)等试剂均为分析纯(国药集团化学试剂有限公司);HPLC 所用甲醇为色谱纯(TEDIA,美国),水为超纯水。
X0DL-1000N 超声破碎仪(南京先欧仪器制造有限公司);TBE-20A 分析型高速逆流色谱、TBE-300B 制备型高速逆流色谱仪(上海同田生化技术有限公司);TAM Ⅲ微量热仪(美国Waters LC);Agilent 1100 高效液相色谱仪(美国安捷伦);酶标仪(美国Thermo Scientific);SQW-601 冷冻超微粉碎机(山东三清不锈钢设备有限公司);多样品平行蒸发仪(瑞士BüCHI);超纯水机(MILLIPORE 公司)。
1.2 实验方法
1.2.1 五倍子醇提物的制备
准确称取五倍子超微粉15 g 与70%乙醇料液比1∶10(v/v)混合,溶液浸泡30 min。然后在超声破碎仪辅助萃取30 min,条件为变幅杆6 mm,超声功率400 W,温度50 ℃,超声3 s,间歇5 s。离心过滤药渣,将药液置于多样品平行蒸发仪中减压浓缩得到浸膏,4 ℃保存备用。
1.2.2 高速逆流色谱分析条件
采用分析型高速逆流色谱(High-speed countercurrent chromatography,HSCCC),选择不同分离体系,以上相为固定相,下相为流动相,分别超声脱气20 min,注入不同量的五倍子醇提物药液进行分离溶剂体系的筛选实验。再根据所优化的溶剂系统(乙酸乙酯-乙醇-水,5 ∶1 ∶5,v/v/v),采用制备型HSCCC(TBE-300B)进行分离制备。固定相以30 mL/min 的流速迅速泵入螺旋管柱中,主机转速900 r/min,流动相流速为2.0 mL/min,待流动相流出且两相溶剂达到动态平衡时,将制备好的五倍子醇提物20 mL(100 mg)注入HSCCC 仪中,开启色谱工作站开始采集数据,紫外检测波长254 nm,柱温25℃,根据色谱图收集各组分,浓缩干燥获得干粉备用。
1.2.3 微量热法测定分离组分的抑菌作用[8]
采用微量热安瓿法测定各分离组分对弧菌的抑制效果。用无水乙醇溶解五倍子各分离组分,配制成不同浓度的药液。在无菌条件下,向各安瓿瓶中加入MH 肉汤培养基1 mL,接种107CFU/mL 的弧菌菌液50 μL,再加入不同浓度药液,密封后将安瓿瓶放入微量热仪中。28 ℃下培养,实时动态记录细菌生长代谢曲线即P-t 曲线。
1.2.4 热谱曲线计算方法[9]
设每个细菌的输出热功率为W,细菌的发热功率与细菌群体的数目成正比,则Pt=NtW,P0=N0W,其中P0、Pt分别为t0、t 时刻的细菌热功率,N0、Nt分别为t0、t 时刻的细菌数目,对于细菌指数生长方程Nt=N0ekt,则有:

即lnPt-t 呈线性关系,把热谱图上的指数生长期的Pt、t 值代入式(2)中,用计算机进行线性拟合得到细菌生长速率常数k。
1.2.5 纯度分析
采用HPLC 对HSCCC 分离的各组分进行检测,根据面积归一法,计算其纯度。色谱条件为:甲醇(A)∶0.1%磷酸水(B)=5∶95,流速1 mL/min,柱温25 ℃,检测波长270 nm。
2 实验结果
2.1 五倍子醇提液分离体系的优化
本试验采用分析型HSCCC 分别考察了乙酸乙酯-乙醇-水(5∶1∶5,v/v/v);乙酸乙酯-甲醇-水(5∶1∶5,v/v/v);乙酸乙酯-正丁醇-甲醇-水(4∶2∶0.5∶6,v/v/v/v);乙酸乙酯-正丁醇-水(4∶1∶5,v/v/v)四个溶剂体系分离五倍子醇提物的效果。图1 显示不同溶剂体系的HSCCC 分离五倍子的谱图,结果证明乙酸乙酯-乙醇-水(5∶1∶5,v/v/v)系统的分离效果最为理想。

图1 高速逆流色谱分离五倍子醇提物各组分的溶剂体系优化图Fig.1 HSCCC chromatograms of crude extract of R.chinensis with different solvent systems
2.2 五倍子各色谱组分的分离制备
根据分析型HSCCC 分离五倍子醇提物的溶剂体系,采用半制备型高速逆流色谱仪分离制备五倍子的主要组分(图2),分离获得7 个单峰组分。

图2 HSCCC 分离制备五倍子主要组分谱图Fig.2 HSCCC chromatogram for the separation of R.chinensis
2.3 各色谱分离组分的HPLC 纯度测定
将制备型HSCCC 分离得到的五倍子各个单峰组分进行浓缩,再利用HPLC 进行纯度分析,采用面积归一法计算各组分纯度,结果见表1。五倍子分离得到的7 个峰中,P3、P4、P5 纯度较低,尤其P5 组分的杂质较多,需进一步进行分离纯化,有待进一步研究。
2.4 各分离组分对菌株G1-1 的生物活性分析
根据弧菌G1-1 在微量量热仪上测得的热功率-时间曲线上指数生长期的数据,如图3,利用方法1.2.4 可计算出致病菌在五倍子各色谱组分不同浓度的药液中的生长速率常数k,然后通过EXCEL 拟合得出k 与药液浓度c 的线性函数关系,进而得到各组分分别对弧菌G1-1 的最低抑制浓度,结果见表2。其中组分P5 的抗菌效果最佳,最低抑菌浓度达到0.1 mg/mL。
表1 HPLC 测定五倍子各分离组分的纯度(n=3,)Table 1 Purity of fractions isolated from R.chinensis determined by HPLC (n=3,)
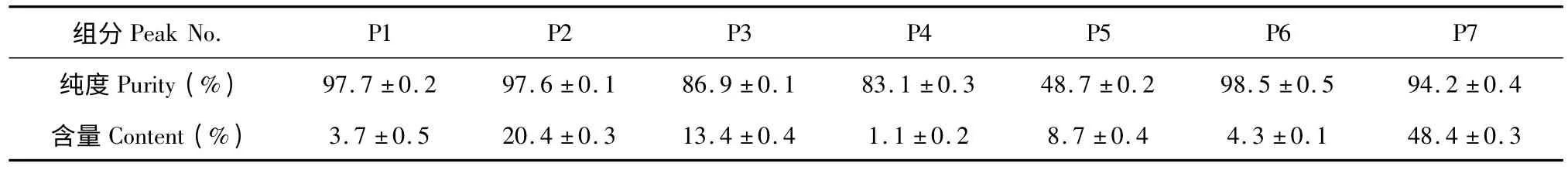
表1 HPLC 测定五倍子各分离组分的纯度(n=3,)Table 1 Purity of fractions isolated from R.chinensis determined by HPLC (n=3,)
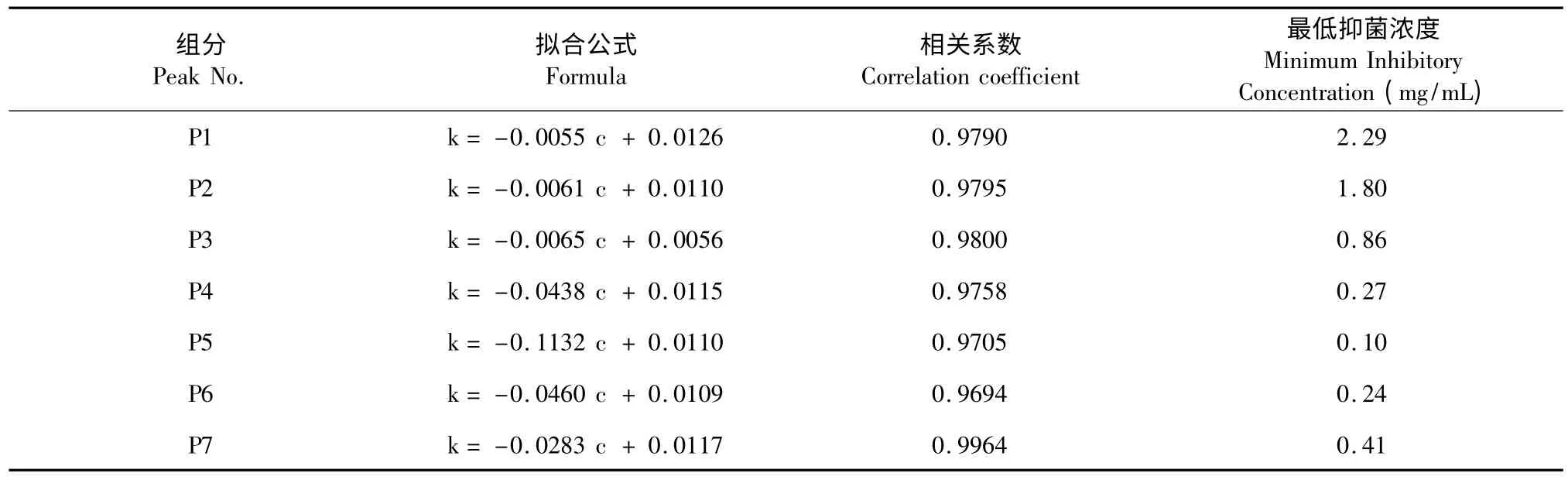
表2 五倍子各色谱组分抑制致病弧菌菌株G1-1 的拟合方程及最佳抑菌浓度Table 2 The relationship between the concentrations of fractions separated from R.chinensis and growth rate constant of Vibrio G1-1,and the optimum inhibitory concentrations

图3 菌株G1-1 在含不同浓度P5 的培养基中的热功率-时间曲线Fig.3 Power-time curves of Vibrio G1-1 in different concentrations of fraction P5
3 讨论与结论
在应用高速逆流色谱的分离过程中,溶剂体系的选择是决定分离纯化效果的关键。结合本实验室已有仪器条件,选用体积小、速度快、溶剂消耗量小的分析型HSCCC 作为摸索溶剂体系的方法。HSCCC 在天然药物活性组分研究中虽得到了广泛应用,并取得了较好的效果,但经常遇到在一次分离中会有几个峰不能有效分开的现象,尤其是在分离未经处理的粗提样品或组分构成较复杂的样品时,极性相近的目标物间无法分开,为了达到较好的分离效果往往需要采取一定的辅助措施。如,石闻华[10]和宋学英[11]均在利用HSCCC 分离纯化药用植物有效成分时,采用了二次分离,大大提高获得化合物的纯度。
五倍子主要有效组分为鞣质、没食子酸等,均具有较多邻位酚羟基的结构。其中鞣质是五倍子的主要组分,含量可达60%~70%[12],是一类结构比较复杂的多酚类化合物,在酸性条件下鞣质水解可得到没食子酸。郑曙明等[13]在研究渔用抗菌剂复方五倍子有效组分及体外抑菌试验时,通过薄层分析法发现并得出五倍子中所含的没食子酸具有较好的抑菌活性。没食子酸可溶解于水、乙醇等溶剂,黄建军[14]报道乙醇提取没食子酸的含量明显高于水提取,因此本试验选用70%乙醇作为提取溶剂。目前植物多酚类物质的提取正由传统的提取方法向更高效的方法转变(如色谱法和超临界萃取等),其中高速逆流色谱在多酚粗品分离纯化领域取得了较好的效果。Han 等[15]采用溶剂系统正己烷-乙酸乙酯-甲醇-水(1∶20∶1∶20,v/v/v/v)分离纯化300 mg 诃子的浸提物(60%甲醇水溶液浸提),分离得到33.2 mg 诃黎勒酸和15.5 mg 诃子酸,纯度分别是95.3%和96.1%。Li 等[16]用正己烷-乙酸乙酯-乙醇-水(3∶7∶1∶9,v/v/v/v)为溶剂系统,HSCCC 法从500 mg丹参粗提物中得到纯度大于98%的丹参酚酸B 342 mg。本研究参考HSCCC 分离多酚类物质的相关文献,采用分析型HSCCC 筛选五倍子醇提物中的抗菌组分。结果发现,采用体系乙酸乙酯-乙醇-水(5∶1∶5,v/v/v)可以达到较好的分离效果,且各组分分离度较高。其他体系如乙酸乙酯-甲醇-水(5∶1∶5,v/v/v)、乙酸乙酯-正丁醇-甲醇-水(4∶2∶0.5∶6,v/v/v)和乙酸乙酯-正丁醇-水(4∶1∶5,v/v/v)等均不能达到有效分离,且体系不稳定,重复性差。
微量热法测得五倍子各色谱分离组分对菌株G1-1 均有一定程度的抑菌效果,与五倍子醇提物的最低抑菌浓度0.5 mg/mL 相比,发现组分P4、P5、P6、P7 的对弧菌G1-1 的抑制作用增强,其最低抑菌浓度均有不同程度降低,而且它们含量总和占62.5%(表1),因此可推测它们为五倍子发挥抑菌效果的主要组分。结合HPLC 测得的各组分峰的纯度分析(表1),P4、P6、P7 的纯度分别为83.1%、98.5%和94.2%,抑制弧菌G1-1 的最低抑菌浓度分别为0.27、0.24 mg/mL 和0.41 mg/mL。在HSCCC 分离制备得到7 种组分中,P5 对弧菌G1-1 的抑制作用最强,其最低抑菌浓度为0.10 mg/mL,但是HPLC 测得的纯度仅为48.7%,推测其中含有特强的抑菌组分,还需进一步纯化,并鉴定其化学结构。
1 Stefan H,Helmut P,Karin NB,et al.Isolation of Vibrio alginolyticus from seawater aquaria.Int J Hyg Environ Health,2010,203:169-175.
2 Kaneko T,Colwell RR.Ecology of Vibrio parahaemolyticus and related organisms in the Atlantic ocean off South Carolina and Georgia.Appl Microbiol,2009,28:1009-1017.
3 Carlos R,Aliciae T,Juan LB,et al.Association of Aeromomas hydrophila and vibrio alginolyticus with Larval Mortalities of Scallop (Argopecten purpuratus).J Invertebr Pathol,2006,67:213-218.
4 Hu CQ(胡超群),Tao BH(陶保华).Penaeid shrimp vibriosis and immune prevention:a review.J Tropical Oceanogr(热带海洋),2000,19:84-94.
5 Feng HR(封会茹),You JR(游京蓉),Liu YT(刘玉堂),et al.Research of one abrupt food poisoning caused by Vibrioalginolyticus.Chin J Food Hygiene (中国食品卫生杂志),2003,15:331-334.
6 Zheng GX(郑国兴),Zhou K(周凯).Drug resistance of Aeromonas hydrophila strains isolated from skin ulcer of Anguilla anguilla.J Fish Sci China (中国水产科学),1999,6(3):69-71.
7 Wang YE(王玉娥),Xing CG(邢晨光),Wang GL(王国良).Susceptibilities of five marine pathogenic Vibrios to 34 Chinese Herbs.Fish Sci(水产科学),2008,27:221-225.
8 Dai ChM,Wang JB,Kong WJ.Investigation of anti-microbial activity of catechin on Escherichia coli growth by microcalorimetry.Environ Toxico Pharm,2010,30:284-288.
9 Qu XS(屈啸声),Lin RS(林瑞森),Fang WJ(方文军).Microcalorimetry investigation on active position of vitex negundo linn against E.coli.Acta Chim Sin (化学学 报),2009,67:2692-2696.
10 Shi WH(石闻华),Chen GL(陈贵林).Separation and purification of polyphenols from Cynomorium songaricum Rupr with high-speed countercurrent chromatography.Hohhot:Inner Mongolia University (内蒙古大学),MSc.2009.
11 Song XY(宋学英),Yin ZS(殷志爽),Zhao YS(赵逸松),et al.Isolation and purification of pentagalloyl glucose from radix paeoniae alba by high-speed counter-current chromatography.Nat Prod Res Dev(天然产物研究与开发),2012,24:303-306.
12 Lin QS(林启寿).The Chemical Components of Chinese Herbal Medicine.Beijing:Science Press,2007.168-172.
13 Zheng SM(郑曙明),Huang JJ(黄建军),Wu Q(吴青),et al.Studies on separation and antibacterial activity of the effective components of Chinese Herbal Compounds gallnut for fishery antimicrobial agent.Acta Hydrobiol Sin(水生生物学报),2010,34:57-64.
14 Huang JJ(黄建军),Zheng SM(郑曙明).Extraction and pharmacodynamic studies on effective components of Chinese herbal compounds gallnut.Chongqing:Southwest University(西南大学),MSc.2006.
15 Han QB,Song JZ,Qiao CF,et al.Preparative isolation of hydrolysable tannins chebullagic acid and chebulinic acid from Terrninalia chebula by high-speed counter-current chromatography.J Sep Sci,2006,29:1653-1657.
16 Li HB,Lai JP,Jiang Y,et al.Preparative isolation and purification of salcianolic acid B from the Chinese medical plant Salvia rniltiorrhiza by high-speed counter-current chromatography.J Chromatogr A,2002,943:235-239.
