白皮杉醇苷在大鼠体内外的葡萄糖醛酸结合代谢研究
2015-01-08张靖悦郝盛源李方悦
张靖悦,刘 卉,郝盛源,李方悦,许 卉
烟台大学药学院,烟台 264005
白皮杉醇(反式-3,5,3',4'-四羟基茋,PE)是天然抗氧化剂白藜芦醇的3'-羟基衍生物,在自然界中以苷的形式广泛存在于多种植物中[1,2]。研究发现,在野生资源丰富的大黄类藏药藏边大黄(Rheum emodi Wall.)中,白皮杉醇的4'-O-β-D-吡喃葡萄糖苷(白皮杉醇苷,PG)含量高达7.5%以上,是其中含量最高的茋类成分[3,4],并具有显著的抗氧化活性[5,6],为藏边大黄多种以抗氧化为基础药效作用的重要功效成分之一。近年来,针对PG 作为天然抗氧剂候选药物的深入研发备受关注。
ADME 特性是影响新药发现和开发成败的关键因素。我们在前期实验研究[7]中发现,PG 在大鼠体内的口服生物利用度不足1%;经静脉注射途径给予大鼠PG,在给药15 min 内即可在胆汁中发现多种代谢产物,并在相当长的时间内维持较高水平,但PG 原型药物经胆汁和尿排泄的量都很低(<5%)。基于LC-MS 的定性分析研究进一步发现,其中多种代谢产物为PG 或其衍生物的葡萄糖醛酸结合物。这一研究结果提示,与白藜芦醇等天然茋类化合物相似[8,9],PG 在体内可能经肝脏被快速地广泛代谢,葡萄糖醛酸结合代谢则可能是其体内消除的重要途径之一。本文在课题组前期研究基础上,首次针对PG 在大鼠体内外的葡萄糖醛酸结合代谢特征进行系统的探索分析,以期为深入了解这一活性天然产物的体内代谢过程和后续研发提供科学依据。
1 材料与方法
1.1 药品与试剂
PG 由本实验室从藏边大黄药材中经分离、纯化制得,HPLC 纯度>98%,其化学结构经NMR 测试数据与文献[10]对照确证;对硝基苯酚(4-NP,批号:20090710,天津市科密欧化学试剂有限公司);对硝基 苯 酚-β-葡 萄 糖 醛 酸 苷 (4-NPG,批 号:035K3796V)、尿苷-二磷酸葡萄糖醛酸(UDPGA,批号:SLBC9398V)购自Sigma 公司;其他试剂和溶剂均为市售分析纯或色谱纯。
1.2 仪器
Agilent 1100 高效液相色谱仪(美国Agilent 公司),包括在线脱气机、二元高压泵、自动进样器和VWD 检测器;Thermo TSQ Quantum Access 三重四级杆串联质谱仪(美国Thermo Fisher Scientific Inc.),包括电喷雾离子源,串连四级杆质谱检测器和Xcalibur 色谱工作站。
1.3 动物
健康SD 大鼠,雄性,体重(220 ± 20)g,北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2012-0001。
1.4 方法
1.4.1 大鼠胆汁样品采集与处理
大鼠经腹腔注射10%水合氯醛麻醉后做胆管插管手术,结扎固定,收集一定体积空白胆汁后,经尾静脉注射给予PG(20 mg/kg),按一定时间间隔收集含药胆汁样品。取胆汁样品100 μL,加10 μL 5%甲酸水,涡旋混匀后加3 mL 乙酸乙酯-正丁醇(5∶1,v/v)混合溶剂,继续涡旋5 min,离心(8000 rpm)10 min,取上清,40 ℃水浴下氮气吹干,残渣以100 μL 流动相复溶,离心(12000 rpm)10 min,取上清,进行HPLC-UV 及LC-MS 分析。
1.4.2 大鼠肝微粒体制备与表征
大鼠于实验前禁食12 h,自由饮水。断头处死后,迅速取出肝脏,称重,剪碎,置冰水浴中,加入适量蔗糖溶液(0.25 mol/L),混匀,4 ℃下离心(11500 rpm)20 min 得肝S9 组分,经进一步的钙沉淀法制备肝细胞液和肝微粒体[11],于-80 ℃下分装保存,备用。考马斯亮蓝染色法测定所制肝微粒体的蛋白浓度为(12.8 ± 0.16)mg/mL(n=6);肝微粒体UGTs 酶活力以HPLC-UV 法测定4-NP 葡萄糖醛酸结合代谢物4-NPG 生成速率表征[12],结果为(9.68± 0.09)nmol/(min(mg)(n=6)。
1.4.3 肝微粒体体外温孵代谢[13,14]
孵育体系含2 mmol/L MgCl2、适量UDPGA 辅因子和大鼠肝微粒体(含微粒体蛋白1.2 mg/mL),以磷酸盐缓冲液(pH 7.4,0.1 mol/L)调节总体积至400 μL,置37 ℃恒温水浴中振荡预孵育2 min,加入PG 溶液10 μL,继续孵育一定时间后,加10%甲酸水溶液100 μL 终止反应,按1.4.1 项下方法进行萃取处理,待测。
1.4.4 色谱与质谱条件
色谱条件:Diamonsil C18色谱柱(250 mm ×4.6 mm,5 μm),流动相:乙腈-水(含0.1%甲酸)20∶80(v/v),流速1.0 mL/min、柱温30 ℃、检测波长320 nm、进样量20 μL;质谱条件:进样方式:分流进样(分流比为3∶1),电喷雾(ESI)离子源,负离子(Negative)方式检测,扫描范围质核比(m/z)100-1000,气动辅助电喷雾离子化,喷雾电压3.5 kV,毛细传输管温度350 ℃,鞘气压力30 psi,辅助气压力5 bar,碰撞气(氦气)、鞘气(氮气)流速0.75 L/min,辅助气(氮气)流速0.15 L/min。
1.4.5 数据处理
以底物消除法测定酶促代谢反应速率,分别绘制Michaelis -Menten 曲线和Lineweaver -Buck 双倒数曲线,据此进一步计算得PG 在大鼠肝微粒体中葡萄糖醛酸结合代谢的动力学参数,包括最大反应速度Vmax(方程截距的倒数)、米氏常数Km(方程斜率与截距的比值)和肝内消除率CLint(Vmax/Km)。
2 实验结果
2.1 PG 在大鼠体内外葡萄糖醛酸结合代谢及其一致性分析
2.1.1 大鼠胆汁中PG 葡萄糖醛酸结合代谢产物分析
在PG 的最大UV 吸收波长(320 nm)下分别对大鼠空白胆汁、加标的空白胆汁以及给药后的胆汁样品进行HPLC-UV 测定,结果如图1(A、B、C)所示。在分析条件下,大鼠胆汁中内源性物质几乎不出峰(图1-A),不干扰对PG 的检测(图1-B),但在i.v.给药15 min 后的大鼠胆汁样品色谱图(图1-C)中明显可见PG 和多个峰面积显著高于PG 的非内源性物质色谱峰。进一步的LC-MS 分析结果(图2)显示,色谱保留时间分别为4.53 min 和5.48 min的M1、M2 m/z([M-H]-)均为581 Da,较原形药物PG 的m/z([M-H]-)405 Da 增加了176 Da,推测为PG 分子结构中不同位置上羟基的单葡萄糖醛酸结合物;M3 为8.65 min 处的色谱峰,其m/z([M-H]-)为433 Da,较PG 苷元PE 的m/z([M-H]-)243 Da增加了190 Da (14 +176 Da),推测M3 可能为PG在体内水解为苷元PE 后,其分子结构中两个羟基分别结合一个甲基和一个葡萄糖醛酸的代谢产物。
2.1.2 PG 在大鼠肝微粒体中的葡萄糖醛酸结合代谢
对比不同肝微粒体体外温孵体系的HPLC-UV分析结果(图1-D、E、F),发现PG 与不含UDPGA 辅因子的大鼠肝微粒体共孵育时基本没有发生改变,在孵育体系中未出现除PG 外的非内源性物质色谱峰,表明PG 在大鼠肝微粒体孵育体系中具有良好的非代谢稳定性。在PG 与大鼠肝微粒体共孵育8 min 的体系中,在PG 色谱峰前增加了两个明显的非内源性物质色谱峰(图1F),且其色谱峰面积在一定时间内随温孵时间延长逐渐增大,而PG 的色谱峰面积相应减小。上述研究结果表明,PG 在大鼠肝微粒体体外温孵体系中发生了经UGTs 介导的代谢转化。进一步针对相同分析条件下的体内外代谢样品HPLC-UV 谱图(图1-C、1-F)进行对比分析,发现PG在大鼠肝微粒体孵育体系中生成的两个主要代谢产物峰与给药胆汁样品中的单葡萄糖醛酸结合代谢物M1、M2 色谱保留时间基本一致(tR分别为4.53 min、5.48 min),且M1 的丰度均高于M2,表明PG在大鼠体内外的葡萄糖醛酸结合代谢具有良好的一致性。
2.2 HPLC-UV 测定大鼠肝微粒体孵育体系中PG含量方法的建立与考察
2.2.1 专属性与线性
如图1 所示,在所建立的HPLC 分析条件下,大鼠肝微粒体中PG 的色谱峰型良好,且与其代谢产物及内源性物质均有足够的分离度,表明大鼠肝微粒体中内源性物质不干扰PG 的测定,所建立HPLC-UV 方法专属性良好。PG 的色谱峰面积(Y)与肝微粒体中PG 浓度(X,mmol/L)间线性回归的典型方程为:Y=90.05X +0.014(r=0.9992),在0.05~0.70 mmol/L 范围内线性关系良好。

图1 PG 及其在大鼠体内外代谢产物的HPLC-UV 色谱图Fig.1 HPLC-UV chromatograms of PG and its metabolites in rat in vivo and in vitro
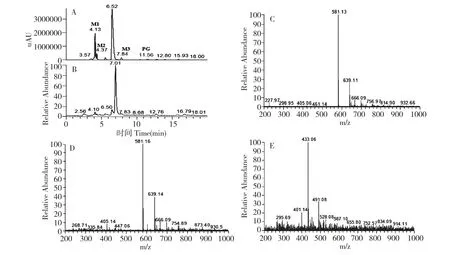
图2 给药15 min 后大鼠胆汁样品的HPLC-UV 色谱图(A)、TIC 图(B)及葡萄糖醛酸结合代谢物M1(C)、M2(D)、M3(E)的一级质谱图Fig.2 HPLC-UV (A)and total ion (B)chromatograms of bile sample of rat after administration 15 min and HPLC-MS spectrum of glucuronide metabolites M1 (C),M2 (D)and M3 (E)
2.2.2 精密度
以灭活大鼠肝微粒体为基质,分别配制含PG 0.1、0.3、0.6 mmol/L 的低、中、高浓度QC 样品,按1.4.3 项下处理后进行HPLC-UV 分析。分别按照测定方法在1 d 内每个浓度平行测定6 个样品,并在6 d 内重复测定6 次。根据测定结果,计算得低、中、高三个浓度下肝微粒体中PG 含量测定的日内精密度(RSD,n=6)分别为3.01%、2.86% 和3.43%;日间精密度(RSD,n=6)分别为4.16%、3.37%、3.52%。精密度符合生物样品测定要求。
2.2.3 回收率与准确度
以灭活大鼠肝微粒体为基质,分别配制含PG 0.1、0.3、0.6 mmol/L 的低、中、高浓度QC 样品,按1.4.3 项下处理。同时以空白缓冲液代替肝微粒体基质制备各浓度QC 样品的对照溶液。根据对各样品的HPLC-UV 测定结果,计算得低、中、高浓度下PG 测定的回收率(n=6)均在80%以上,分别为(80.5 ±3.0)%、(89.3 ±2.1)%、(91.6 ±1.4)%;准确度(相对回收率,n=6)分别为(101.5 ±3.4)%、(100.2 ±2.5)%、(98.9 ±2.7)%,均在85%~115%范围内。研究结果表明,本文所建立的HPLC-UV 方法符合生物样品测定的准确度要求,适用于肝微粒体中PG 含量的测定。
2.3 大鼠肝微粒体中PG 葡萄糖醛酸结合代谢的酶促反应动力学
2.3.1 时间的影响
设置温孵体系中PG 的初始浓度为0.16 mmol/L,肝微粒体蛋白浓度为1.2 mg/mL,在37 ℃水浴中振荡温孵,分别于1、3、5、8、10、15、20 min 取样,按1.4.3 项下方法处理后测定PG 浓度。如图3-A 所示,在温孵1~8 min 内PG 基本呈线性消除(r=0.9986),此后代谢消除迅速减缓,至20 min 达到最大反应速度。
2.3.2 UDPGA 供体浓度的影响
设置温孵体系中PG 的初始浓度为0.16 mmol/L,肝微粒体蛋白浓度为1.2 mg/mL,UDPGA 的浓度分别为0.6、1.25、1.5、2、2.5、3 mmol/L,温孵8 min后取样,按1.4.3 项下方法处理后测定PG 浓度。如图3-B 所示,在UDPGA 供体浓度在0.25~2.5 mmol/L 范围时PG 基本呈线性消除(r=0.9912),此后代谢消除逐渐减缓,至3 mmol/L 达到最大反应速度。
2.3.3 底物浓度对代谢速率的影响
设置温孵体系中肝微粒体蛋白浓度为1.2 mg/mL,UDPGA 供体浓度为2.5 mmol/L,在0.1~0.6 mmol/L 范围内改变底物PG 的初始浓度,温孵时间8 min 后取样,按1.4.3 项下方法处理后测定PG 浓度。如图4-A 所示,在0.1~0.6 mmol/L 底物浓度范围内,PG 的代谢反应速率随底物浓度增加而增加,此后,不再随底物浓度增大继续增加,表明孵育体系中代谢酶与底物的结合已趋饱和状态。
根据孵育体系中的肝微粒体蛋白浓度以及反应时间,计算酶促反应速率,分别绘制Michaelis -Menten 曲线和Lineweaver -Buck 双倒数曲线如图4-A、B 所示。进一步计算得PG 在大鼠肝微粒体中葡萄糖醛酸结合代谢反应的最大反应速率Vmax、米氏常数Km和肝内清除率CLint(Vmax/Km)分别为10.11 nmol/(min·mg)、0.36 mmol/L、0.028 mL/(min·mg)。

图3 在大鼠肝微粒体孵育体系中,孵育时间(A)和UDPGA 浓度(B)对PG 代谢的影响Fig.3 Effect of incubation time (A)and concentration of UDPGA (B)on metabolism of PG in the incubation system of rat liver microsomes
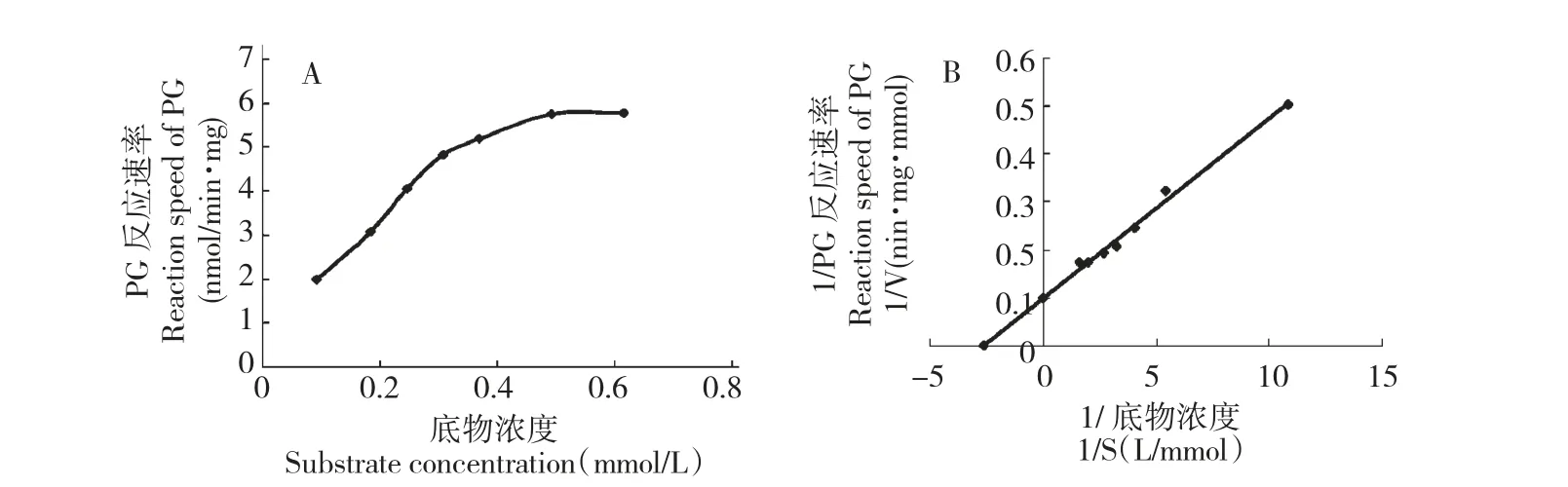
图4 大鼠肝微粒体孵育体系中PG 葡萄糖醛酸结合代谢的米氏动力学曲线(A)和双倒数曲线(B)Fig.4 Michaelis-Menten kinetic curve (A)and Lineweaver-Buck double reciprocal curve (B)of glucuronidation of PG in the incubation system of rat liver microsomes
3 讨论
PG 是藏边大黄中含量最高的茋类成分,具有显著的抗氧化活性,近年来作为天然抗氧剂候选药物被广泛关注。本文在前期研究基础上,首次通过HPLC-UV 和LC-MS 分析研究了PG 在大鼠体内外的葡萄糖醛酸结合代谢。结果发现,经静脉注射途径进入大鼠体内的PG 会经肝脏快速代谢生成多种葡萄糖醛酸结合物,其中以羟基的单葡萄糖醛酸结合产物为主;在大鼠肝微粒体体外温孵体系中,PG经UGTs 介导发生快速的葡萄糖醛酸结合代谢,主要生成两个在结构和丰度上均与体内一致的单葡萄糖醛酸代谢物,表明PG 的葡萄糖醛酸结合代谢具有较好的体内外一致性。后续可通过体外重组酶实验进一步进行代谢表型的深入研究。
本文研究建立了大鼠肝微粒体中PG 含量的HPLC-UV 方法,经专属性、线性、精密度、回收率与准确度验证项目考察,表明该方法具有灵敏、准确、快速的特点,适用于底物消除法研究PG 在大鼠肝微粒体温孵代谢的反应动力学。在肝微粒体蛋白浓度为1.2 mg/mL、供体浓度为2.5 mmol/L 温孵代谢反应8 min 的大鼠肝微粒体体外温孵体系中,PG 的葡萄糖醛酸结合代谢呈现饱和动力学特征,其代谢消除符合米氏方程。酶促代谢反应的主要动力学参数Vmax、Km、CLint(Vmax/Km)分别为10.11 nmol/(min·mg)、0.36 mmol/L、0.028 mL/(min·mg),与白藜芦醇的Km值[15]基本一致,表明大鼠肝脏中UGTs酶对PG 具有较强的亲和力,可催化其发生快速的葡萄糖醛酸结合代谢。
1 Piotrowska H,Kucinska M,Murias M.Biological activity of piceatannol:leaving the shadow of resveratrol.Mutat Res,2012,750:60-82.
2 Potter GA,Patterson LH,Wanogho E,et al.The cancer preventative agent resveratrol is converted to the anticancer agent piceatannol by the cytochrome P450 enzyme CYP1B1.Br J Cancer,2002,86:774-778.
3 Lu JG (卢敬光),Wang S (王曙),Yan XL (严晓梁),et al.Content determination of piceatannol-4'-O-β-D-glucopyranoside in Rheum emodi Wall.West China J Pharm Sci (华西药学杂志),2008,23:704-705.
4 Liu B (刘兵).The quality standard and evaluation study of Rhubarb from Rheum emodi Wall.Chengdu:Sichuan University (四川大学),PhD.2007.
5 Rajkumar V,Guha G,Ashok KR.Antioxidant and anti-cancer potentials of Rheum emodi rhizome extracts.Evid Based Complement Alternat Med,2011,2011:697986.
6 Chai YY,Wang F,Li YL,et al.Antioxidant activities of stilbenoids from Rheum emodi Wall.Evid Based Complement Alternat Med,2012,2012:603678.
7 Chai YY (柴媛媛).Study on antioxidant activity and pharmacokinetics of piceatannol and its glucoside.Yantai:Yantai University (烟台大学),MSD.2012.
8 Yu C,Shin YG,Chow A,et al.Human,rat,and mouse metabolism of resveratrol.Pharm Res,2002,19:1907-1914.
9 Niles RM,Cook CP,Meadows GG,et al.Resveratrol is rapidly metabolized in athymic (nu/nu)mice and does not inhibit human melanoma xenograft tumor growth.J Nutri,2006,136:1542-1546.
10 Liu B (刘兵),Yang J (杨静),Wang S (王曙).The chemical constituents in rhubarb rhizomes and roots derived from Rheum emodi Wall.West China J Pharm Sci (华西药学杂志),2007,22:35-37.
11 Pekka T,Seppo K.Catechol-O-methyltransferase (COMT):biochemistry,molecular biology,pharmacology,and clinical efficacy of the new selective COMT inhibitors.Pharmacol Rev,1999,51:593-628.
12 Li YL (李艳丽),Tian HC (田红翠),Zhai WT (翟文婷),et al.Effect of salvianolic acid A on rat hepatic uridine diphosphate glucolactone transferases activity.Tradit Chin Drug Res Clin Pharm(中药新药与临床药理),2013,24:558-562.
13 Jin XL (金学利),Fang ZZ (房中则),Qu YQ (曲衍清),et al.Study on the glucuronidation of alpinetin in human liver microsomes.Chin J Clin Pharm(中国临床药理学杂志),2011,27:847-850.
14 Deng QT (邓婧婷),Zhuang XM (庄笑梅),Li H (李桦).In vitro comparison of thienorphine metabolism in liver microsomes of human,Beagle dog and rat.Acta Pharm Sin (药学学报),2010,45:98-103.
15 Tan AP (谭爱萍),Wang LY (王丽岩),Zhao S (赵姗).Metabolic kinetics of trans-resveratrol in human liver microsomal enzyme.Lishizhen Med Mater Med Res (时珍国医国药),2012,23:1449-1451.
