夏季室外光生物反应器培养Chlorella sorokiniana
2015-01-06张姗姗
张姗姗, 刘 和
(江南大学 环境与土木工程学院,江苏 无锡 214122)
夏季室外光生物反应器培养Chlorella sorokiniana
张姗姗, 刘 和*
(江南大学 环境与土木工程学院,江苏 无锡 214122)
搭建了一个6 L容积曝气型垂直柱光生物反应器,在6—8月期间置于室外屋顶运行,旨在考察夏季室外培养微藻Chlorella sorokiniana的可行性。室外培养时,若pH超过8.5,微藻会出现明显絮凝沉淀现象。太阳光入射到反应器的高达(1 700±137)μmol/(m2·s)的光照强度带来的光抑制作用及随之引起的超过48℃的高温,对微藻细胞的损伤造成了室外培养的抑制现象。当培养液温度超过40℃时,Chlorella sorokiniana几乎不能生长。在反应器周围放置金属镀层反射隔热膜反射板,可以减少(42.21±4.7)%的光照强度,使培养液温度下降2~4℃,但晴天时光照强度仍然可达900 μmol/(m2·s)以上,光抑制作用不能很好被解除。为实现微藻在室外反应器中可持续地快速增长,仍需进一步采取措施减弱光照强度。
微藻;光生物反应器;室外培养;光照强度;温度
近些年来,以可固定CO2的微藻为原料生产环境友好型第三代生物燃料的研发引起广泛关注,目前大多数研究仍停留在实验阶段,其商业化生产面临的最突出的瓶颈是培养成本过高[1]。Norsker等指出[2],约有7%~11%的微藻培养成本来自于化学药品的使用,其中氮磷是微藻培养所需的主要化学药品,占到80%~85%。大量研究表明,利用富含氮磷的废水培养微藻不但可以减少微藻培养营养盐投入,而且能在用生物法处理废水的同时,生产可转变为生物燃料的微藻生物质[3-4]。若在该生物处理法运行过程中,利用免费且持续存在的太阳光作为替代光源,将会有效地进一步减少微藻产生物燃料的总体投入[5]。有很多研究已经尝试在室外培养微藻,常用的培养装置主要分为两类:开放的跑道式培养池及封闭的光生物反应器。后者又包括垂直曝气柱状、管状及平板式光生物反应器等。
不论使用何种设计的反应器,在培养过程中都必须考虑以下几个影响微藻生长的环境因素:营养盐供应、pH、混匀、气体交换、温度及光照。其中,前四者可通过化学或物理的方法进行有效控制,如Huang等[6]为平板式光生物反应器专门设计了3种特殊搅拌器,以提高光暗循环及提高微藻生长速率。然而在室外培养时,入射至反应器的单位面积光照强度及培养液温度很大程度上取决于当地的天气、季节及时间,因此有较大的波动。本文作者在6~8月期间研究夏季阳光充裕时进行微藻室外培养的可行性及可能遇到的主要瓶颈,所用反应器为6 L容积曝气型垂直柱状光生物反应器,微藻培养模式是光合自养型。封闭光生物反应器可以避免杂菌的污染,减少水分的损失且较容易控制反应器内运行条件[7]。
1 材料与方法
1.1 微藻的接种培养
所用微藻Chlorella sorokiniana 211/8k,购买于英国剑桥的藻类及原生生物培养中心。所用培养基是BG11培养基。微藻的接种培养在8个250 mL容积经过灭菌处理的蓝盖试剂瓶中进行,每个瓶子配有一个自制的插入通气管的培养棉塞,以10 mL/ min(0.05 L/(L·min))的速率持续通入质量分数5%的CO2[8]。培养灯光来自于3个40 W荧光灯,光照强度为(62.1±3.2)μmol/(m2·s),光照时间为24 h。培养温度为(27±2)℃。
1.2 培养装置的搭建
图1为一个3层的带万向轮的不锈钢支架,最上面放置光生物反应器;中间为辅助设施,如CO2气瓶,进料蠕动泵(Cole-Parmer,L/S 07553-77分体式驱动器,L/S Easy-Load II 77200-62泵头,美国制),空气泵(HIBLOW,C-5F,菲律宾制),调控CO2及空气比例的气体流量计 (Dwyer,RMC-101-SSV,美国制)等;下面放置新进料及微藻收获液;旁边配置了防雨电源厢。此外,使用的蠕动泵、空气泵虽是防水的,但为了保护这些易耗损的装置,试验后期仍为中间层安装了防雨亚克力塑料厢。
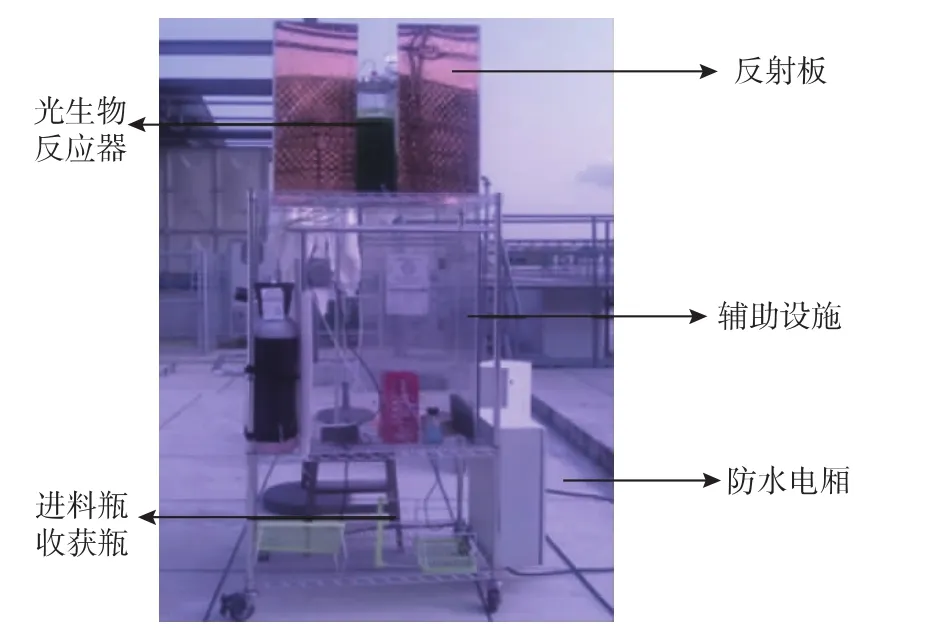
图1 室外微藻培养系统Fig.1 Outdoor microalgae cultivation system
1.3 微藻培养液的准备
首先将按1.1所述方法培养得到的处于对数生长期的藻液在3 500 r/min转速下离心5 min进行浓缩,用蒸馏水洗两遍后,加一定体积的浓缩藻液到已经调节pH于6.5~7.5之间的新鲜配置的5 L BG11培养液中,用蠕动泵将混合均匀后的微藻培养液转移至经121℃、20 min高压灭菌的反应器中,于室内培养。质量分数5%CO2以600 mL/min(0.1 L/(L·min))的速率从反应器中心通过一个气体分散器连续通入。反应器周围以合理的间隔放置12个LED灯,提供连续24 h光照,正对着LED灯的反应器表面及其余地方光照强度分别为 (133.2± 9.3)μmol/(m2·s)及(78.4±5.5)μmol/(m2·s),培养温度为(27±2)℃。用2 mol/L HCl调节培养液pH至6.5~7.5。微藻进入对数生长期时,转移2.5 L容积室内反应器中的培养液至室外6 L容积光生物反应器中,并同时向室内室外反应器中添加2.5 L新的BG11培养液。
1.4室内温度调控对微藻生长的影响
将处于对数生长期微藻接种液以3 500 r/min离心5 min后得到微藻浓缩液,用蒸馏水洗两遍后,取相同体积的浓缩藻液至已调节pH的新鲜配置的4份200 mL BG11培养液中,培养器为250 mL的锥形瓶,将这4个锥形瓶放置于水浴摇床,调节初始温度为35℃。培养8 d后,收获所有的培养液,以3 500 r/min离心5 min后得到微藻浓缩液。向锥形瓶中加入200 mL已调节pH的新鲜配置的BG11,接种相同体积的35℃培养温度下收获的浓缩藻液,调控水浴摇床温度为38℃,培养8 d。以相同的方式,继续做两个温度梯度,40℃及42℃。整个培养过程中,摇床速度控制在150 r/min左右,所有培养液中以10 mL/min(0.05 L/(L·min))的速率持续通入质量分数5%的CO2,光照12 h,光照由固定在放置于水浴摇床上方支架上的4个LED灯提供,光照强度为(43.1±2.6)μmol/(m2·s)。
1.5 自制反射光装置的安装
运行后期,两块贴有金属镀层反射隔热膜(美国3 M)的自制反射板分别放置在光生物反应器两侧(见图1),用于减弱太阳光直射,缓解反应器表面光照强度及下调培养液温度。
1.6 分析指标及方法
pH用Mettler Toledo G20型Compact滴定仪的pH探针DG115-SC进行测量;光密度OD750用紫外分光光度计(Varian,Cary 50型,美国制)测量;所有样品经0.45 μm滤膜过滤后用Hach试剂盒TNT系列进行硝态氮、总磷的测定,由Hach DR/2800型分光光度计读取最终浓度;光照强度通过带有LI-192SA水下量子传感器的LI-250A测光计 (LICOR,美国制)测量所得;温度由插入到反应器中的内置式温度计自动读取;以OD750为生长指标,微藻比生长速率的计算依据OD750自然对数相对于培养时间的线性回归方程计算。
2 结果与讨论
2.1 微藻在室内外光生物反应器中的生长状况
图2以OD750为生长指标,绘制了微藻在未添加反射装置前室内外6 L容积光生物反应器中的生长趋势。可以看出,室内微藻生长明显优于室外。在初始2 d,处于对数生长期的微藻在室内光生物反应器中仍保持增长趋势,OD750从 1.710增长至3.604,最大生长速率为0.619 d-1,在第3天开始出现轻微下降,微藻进入稳定期,接下来是衰亡期。
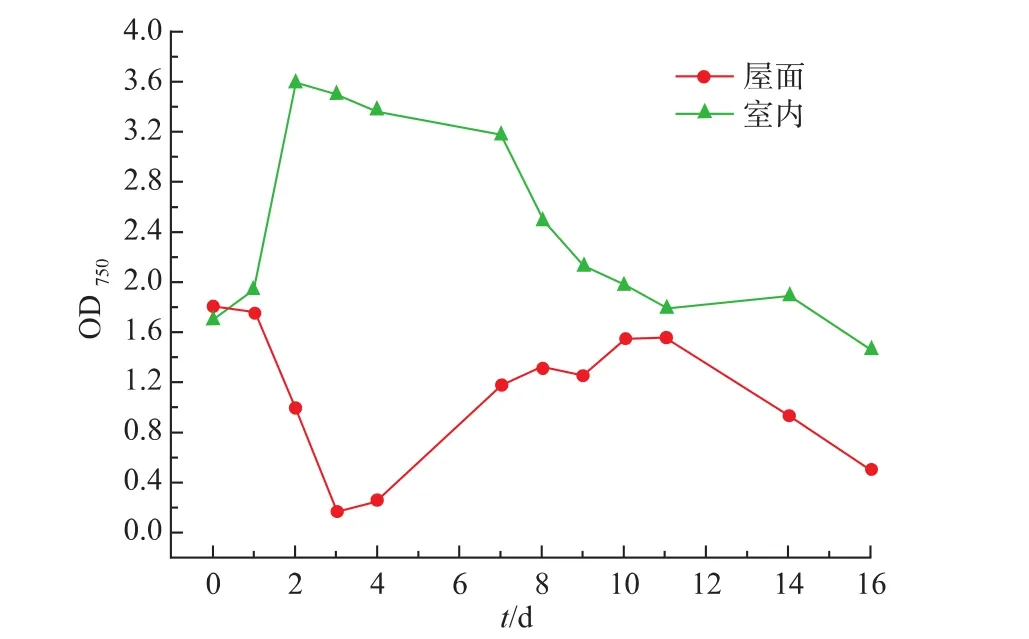
图2 室内外光生物反应器中微藻的生长Fig.2 Microalgalgrowth in indoor and outdoor photobioreactors
前3 d内楼顶反应器中微藻却呈持续下降趋势,甚至第3天时,微藻出现大量絮凝沉淀,致使培养液OD750仅为0.181,培养液颜色经历了深绿、浅绿至浅黄的改变。然而,在第4天下过雨后,室外反应器中微藻开始出现再次生长的现象,OD750有微小回升,继续放置3 d后,OD750增加至1.194,3 d内的增长速率为0.511 d-1,其生长曲线类似于微藻的对数增长期,第7天后OD750缓慢增长至1.571后开始快速下降。室外反应器中微藻的生长在整体上并不乐观,中间甚至经历了大多数微藻严重附着于反应器壁上,同时也有大量微藻沉在反应器底部。分析可能的原因有3个:培养液中pH上升致使微藻与培养液中镁、钙、磷等元素发生絮凝沉淀;长时间地接受直接阳光照射使微藻光合机制受到损伤;培养液温度升高超过了微藻可以忍耐的温度。
2.2 pH变化对微藻生长的影响
如图3所示,室内反应器中前2 d的pH持续增长,这是由于用以硝酸钠为氮源的BG11培养基作为微藻培养液时,随着微藻的增长,硝态氮的消耗会使培养液中pH呈上升趋势。而在室外反应器中,前2 d pH维持在7左右,培养液中硝酸钠质量浓度仅消耗15 mg/L,这与图2中表现出的微藻下降趋势相符。第4天时,pH突然增长至9.57,主要原因是CO2被用完,微藻OD750的下降趋势比第一两天更快,降至0.181,微藻出现大量絮凝沉淀。Sukenik等[9]报道了不同pH条件下室外培养液中发生絮凝沉淀后微藻生物量的去除率,在pH 5.0~7.5之间,微藻不会发生絮凝沉淀,但pH超过8.5时,开始呈现明显絮凝沉淀现象,甚至有98%的微藻生物量会从培养液中被去除。
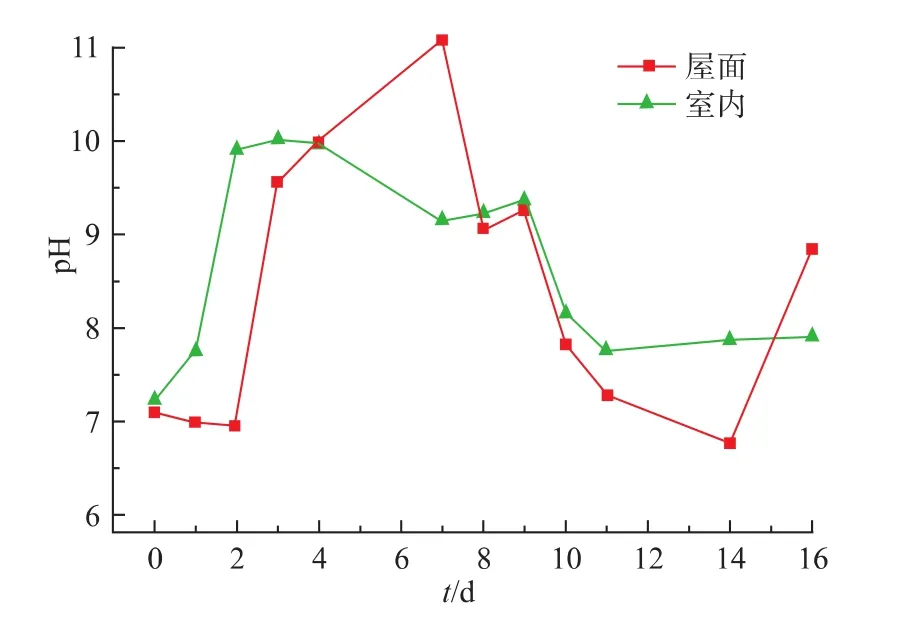
图3 室内外光生物反应器中的pH变化Fig. 3 pH variations of indoor and outdoor photobioreactors
然而,第4天微藻出现大量絮凝沉淀后的3 d内,由于没有及时更换新的CO2气瓶,pH继续维持上升至11.102,微藻却呈现再次生长的趋势。与室内反应器的运行进行对比,虽然Gordon等[10]指出,室内培养时,当曝气且pH缓冲能力较差的培养液pH>10时,培养液中微藻会与钙、镁、磷等元素发生絮凝沉淀。但结合图2知,pH在10左右的室内培养液中并没有出现严重的微藻附着现象,只表现出轻微的OD750下降趋势。因此,室外培养时,pH升高可能是引起微藻发生絮凝沉淀的原因,但并不是关键因素。
2.3 光照强度及培养液温度对微藻生长的影响
光照是微藻自养培养光合作用所必需的,光照强度、波长范围、光照时间是优化微藻产率主要考虑的三大因素。其中,光照强度是最重要因素,低于最优点时,它会成为一个限制因素。营养物充足时,提高光照强度会促进微藻光合作用,一旦超过该饱和点,继续增加会破坏微藻光受体、降低光合活性,该现象被称为光抑制。太阳光是室外光合自养系统的主要光来源,它包含全部光谱,可以通过过滤为特定种属微藻的培养提供合适波长的光和辐射,但光照强度却是一个不可调控的因素。微藻生长的最佳光照强度一般低于200 μmol/(m2·s)。然而,太阳光所能提供的光照强度一般都远远大于最佳值,到达地面的光强在1 800 μmol/(m2·s)以上,晴天时甚至会超过2 000 μmol/(m2·s)。这比建议的最佳光照强度高出10倍[11]。长时间直接入射这样光照强度的阳光,会损伤反应器中微藻光合色素,从而破坏光合机制,致使培养中微藻延迟生长或失去活性,发生絮凝沉淀[12]。
图4(a)为室外培养过程中早上10:00至下午17:00之间每半个小时在反应器表面随机取5个点测得的平均光照强度,图4(b)为同一时间培养液温度。 Li等[13]研究了不同光照强度对绿藻Pseudochlorococcum sp.生长的影响,结果显示,光照强度在20~300 μmol/(m2·s)没有出现光抑制现象,在600 μmol/(m2·s)时开始出现轻微的光抑制现象,随着光照强度升高至800 μmol/(m2·s),光抑制现象越来越严重。在本研究中,1~3 d内光照强度平均为(1 700±137)μmol/(m2·s),微藻经历了严重的光抑制。此外,由图4(b)知,1~3 d内培养液温度持续上升,最高温度达48.3℃。Wu等[14]的研究表明,微藻Monoraphidium sp.SB2可以在25~35℃下生长良好,在40℃时出现衰退。Park等[15]指出,虽然微藻生长的最佳温度取决于藻种及培养液中营养物浓度,但大多数藻种适宜生长的温度均在28~35℃之间,突然的温度变化会大幅度降低微藻的产率。1~3 d内光照强度及温度的变化合理解释了图2中初始3 d室外微藻OD750的持续下降。由于连续3 d的降雨,第4—7天光照强度突然下降,低至244 μmol/(m2·s),温度下降至28℃以下,室外微藻OD750开始回升。第8天转晴后,随着光照强度的增加,培养液温度逐渐回升,室外微藻OD750维持3 d后(见图2)再次出现快速下降。这充分证明,到达反应器表面的光照强度及培养液温度是影响微藻室外培养的限制性因素。
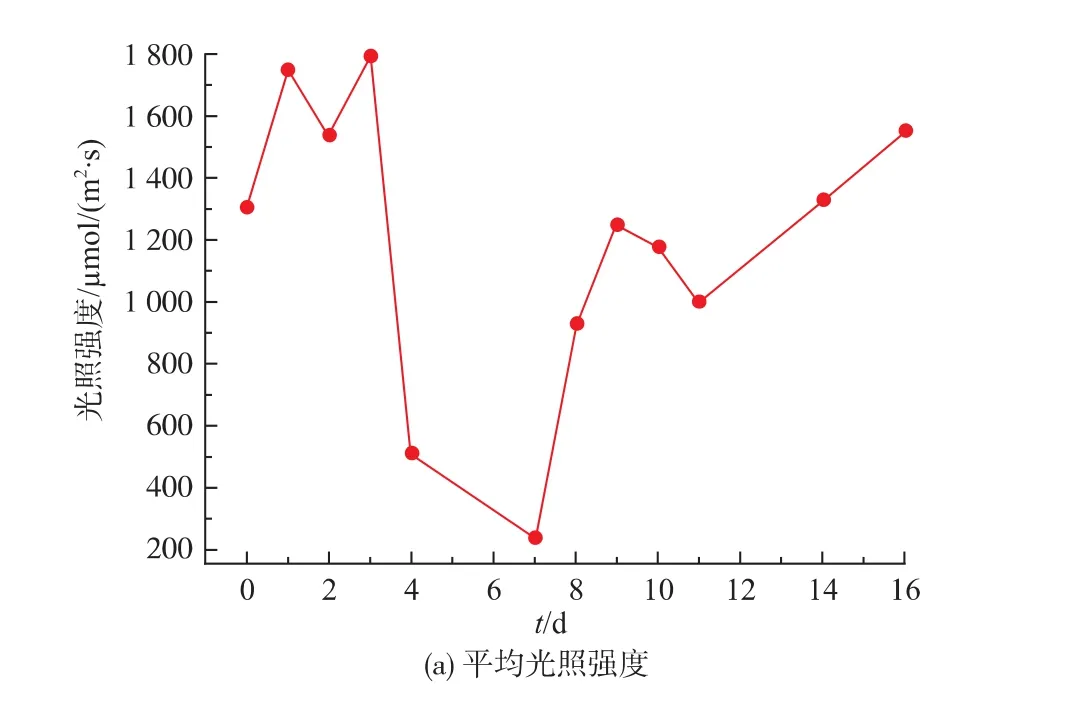
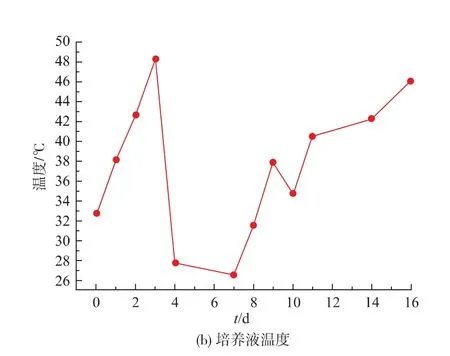
图4 室外反应器表面光照强度及培养液温度Fig.4 Light intensity on the surface of outdoor photobioreactor and temperature of culture
2.4 温度影响微藻生长的室内验证
大多数工业用微藻都是嗜中温型的,最佳生存温度在20~30℃之间。然而,室外培养系统受温度及光照影响很大,其中光照又是培养液热度的主要来源。Quinn等[16]指出,微藻培养液可以100%吸收入射太阳光的所有光谱,但仅有5%甚至更少被转换为生化能,其余能量就贡献给了培养液的热度,单独依靠反应器外的热对流不能有效降低培养液温度,在晴天时反应器中温度甚至可能超过55℃,这是需要被避免的。
为了找出Chlorella sorokiniana可以承受的最高温度,在实验室水浴摇床内进行了一批逐渐升温的驯化培养试验,温度分别为27、35、38、40℃及42℃。微藻在这几组温度下的生长状况见图5。可以明显看出,27℃及35℃下的微藻生长良好且前者可以较快地进入稳定期,最大比生长速率分别为(0.735±0.02)d-1和(0.278±0.008)d-1;当温度在38℃及40℃,微藻生长非常缓慢,最大比生长速率仅为(0.148±0.004)d-1;在42℃时,微藻完全不可以生长。因此,认为本课题研究中所用藻种培养温度不适宜超过40℃,结合图2及图4(b),合理解释了室外反应器中第2天后微藻OD750的加速下降。de-Bashan等也证明小球藻Chlorella sorokiniana在经历5 d的适应期后可以在40℃下生长[17]。
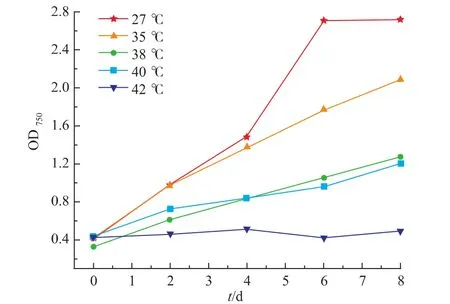
图5 室内不同温度下微藻的生长Fig.5 Microalgal growth under different indoor temperatures
2.5 反射光装置的安装对室外培养系统的影响
通过分析总结得知,室外培养时,微藻培养液可以吸收除了微藻进行光合作用所需的波长400~700 nm外的其它光谱,这加大了培养液的热度负荷。因此,限制微藻在室外光生物反应器中生长的主要因素是太阳光入射到反应器的高光照强度及随之引起的培养液高温度。基于这个原因,在反应器左右两边分别放置了贴有金属镀层反射隔热膜(美国3 M)的反射板。表1列出了安装反射膜前后室外培养系统中光照强度、培养液温度变化及微藻生长状况。

表1 安装反射装置前后室外培养条件及微藻生长状况的变化Table 1 Change of outdoor cultivation conditions and microalgae growth after reflectors installation
图6为安装反射板前后,1 d内不同时刻反应器表面光照强度及微藻培养液中温度的变化,光照强度在每天上午10:00到下午17:00之间,每30 min随机在反应器表面取5个点测量其平均值,温度由内置式温度计每隔4 min自动读取。在上午10:00至下午17:00光照加强、温度上升期间,安装反射装置的反应器中有 (42.21±4.7)%入射光被反射,但光照强度依旧可以达到900 μmol/(m2·s)以上。Liu等指出[18],通过在反应器表面添加特殊材质的反射膜可以减少50%的培养液热负荷。结合表1知,光照强度下降 (543±175)μmol/(m2·s),温度降低2~4℃,最高在36℃左右。
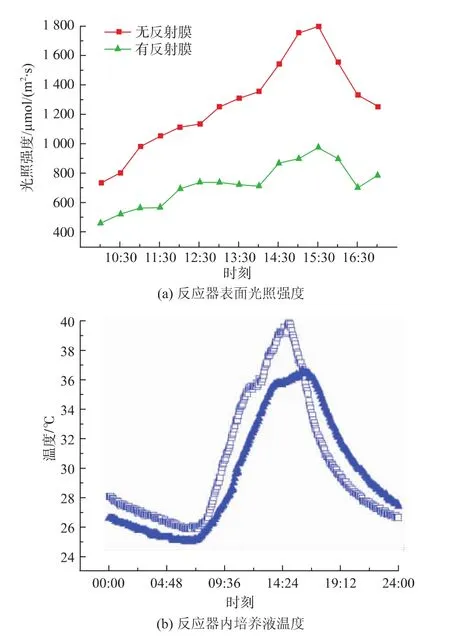
图6 安装反射装置前后一天内不同时刻反应器表面光照强度及培养液温度Fig.6 Light intensity on the surface of reactor and culture temperature during differentmoment before and after reflectors installation
然而,由表1可以看出,安装反射装置后,在初始OD750相差不大的状况下,虽然反映其表面光照强度减弱,培养液中温度有所下降,微藻生长并未得到明显改观,能达到的最高OD750仅比没有安装反射装置条件下高出19%,最大比生长速率高出16.7%。这是由于即使反射装置的安装可以减弱(42.21±4.7)%的光照强度,到达反应器表面的光照强度仍然可以达到900 μmol/(m2·s)以上(见图6),光抑制作用并没有得到缓解。因此,微藻室外生长最重要的限制因素是过高的光照强度。Monica等也指出,微藻室外培养产率很大程度上被光饱和效应限制[19]。目前还没有实现室外微藻的可持续培养,仍需要进一步改善装置来减弱可到达光生物反应器表面的光照强度。
3 结语
室外运行光生物反应器进行微藻培养,当培养液pH超过8.5时,微藻会出现明显絮凝沉淀现象,甚至有98%的微藻生物量会从培养液中被去除。pH升高可能是引起微藻发生严重絮凝沉淀的原因之一,但并不是关键因素。限制微藻在室外光生物反应器中良好生长的关键因素是太阳光入射到反应器的高达(1 700±137)μmol/(m2·s)的光照强度所带来的光抑制作用,以及随之引起的48℃高温对微藻细胞的损伤。当培养液温度超过40℃时,Chlorella sorokiniana几乎不能生长。反射装置的安装可以减少(42.21±4.7)%的光照强度,使培养液温度下降2~4℃,但反应器表面的光照强度仍然达到900 μmol/(m2·s)以上,过高的光照强度是微藻室外培养的最大限制因素。微藻的室外培养尚未实现可持续增长,仍需要进一步改善装置减弱光照强度。
[1]Williams P J B,Laurens L M L.Microalgae as biodiesel&biomass feedstocks:Review&analysis of the biochemistry,energetics &economics[J].Energy Env Sci,2010,3(5):554-590.
[2]Norsker N H,Barbosa M J,Vermue M H,et al.Microalgal production-a close look at the economics[J].Biotechnol Adv,2011,29(1):24-27.
[3]Andriana F A,Marios A.Selection of microalgae for wastewater treatment and potential lipids production[J].Bioresour Technol,2013,147:130-134.
[4]Ashish K S,Jon S,Tina T.Utilisation of wastewater nutrients for microalgae growth for anaerobic co-digestion[J].J Environ Manage,2013,122(15):113-120.
[5]Feng P Z,Deng Z Y,Hu Z Y,et al.Lipid accumulation and growth of Chlorella zofingiensis in flat plate photobioreactors outdoors [J].Bioresour Technol,2011,102(22):10577-10584.
[6]Huang J K,Li Y G,Wan M X,et al.Novel flat-plate photobioreactors for microalgae cultivation with special mixers to promote mixing along the light gradient[J].Bioresour Technol,2014,159(1):8-16.
[7]Singh R N,Sharma S.Development of suitable photobioreactor for algae production-A review[J].Renew Sust Energ Rev,2012,16(4):2347-2353.
[8]Lim C Y,Chen C L,Wang J Y.A strategy for urban outdoor production of high-concentration algal biomass for green biorefining [J].Bioresour Technol,2013,135:175-181.
[9]Sukenik A,Schroder W,Lauer J,et al.Coprecipitation of microalgal biomass with calcium and phosphate ions[J].Water Res,1985,19(1):127-129.
[10]Gordon M S,Chapman D J,Kawasaki L Y,et al.Aquacultural approaches to recycling of dissolved nutrients in secondarily treated domestic wastewaters-IV:Conclusions,design and operational considerations for artificial food chains[J].Water Res,1982,16(1):67-71.
[11]Kumar K,Dasgupta C N,Nayak B,et al.Development of suitable photobioreactors for CO2sequestration addressing global warming using green algae and cyanobacteria[J].Bioresour Technol,2011,102(8):4945-4953.
[12]Wang J,Han D,Lu C,et al.Effect of initial biomass density on growth and astaxanthin production of Haematococcus pluvialis in an outdoor photobioreactor[J].J Appl Phys,2013,25(1):253-260.
[13]Li Y,Han D,Sommerfeld M,et al.Photosynthetic carbon partitioning and lipid production in the oleaginous microalga Pseudochlorococcum sp.(Chlorophyceae)under nitrogen-limited conditions[J].Bioresour Technol,2011,102(1):123-129.
[14]Wu L F,Chen P C,Lee C M.The effects of nitrogen sources and temperature on cell growth and lipid accumulation of microalgae [J].Int Biodeterior Biodegr,2013,85:506-510.
[15]Park J B K,Craggs R J,Shilton A N.Wastewater treatment high rate algal ponds for biofuel production[J].Bioresour Technol,2011,102(1):35-42.
[16]Quinn J C,Yates T,Douglas N,et al.Nannochlorposis production metrics in a scalable outdoor photobioreactor for commercial applications[J].Bioresour Technol,2012,117:164-171.
[17]de-Bashan L E,Trejo A,Huss V A R,et al.Chlorella sorokiniana UTEX 2805,a heat and intense,sunlight-tolerant microalga with potential for removing ammonium from wastewater[J].Bioresour Technol,2008,99(11):4980-4989.
[18]Liu J,Zheng S,Gerken H.Recent Advances in Microalgal Biotechnology[M].[S.I.]:OMICS Group eBooks,2014.
[19]Monica M,Agnese C,Marco B.Experimental investigation of a local recirculation photobioreactor for mass cultures of photosynthetic microorganisms[J].Water Res,2014,55(2):29-39.
Outdoor Chlorella sorokiniana Cultivation Using Photobioreactor in Summer
ZHANG Shanshan, LIU He*
(School of Environmental and Civil Engineering,Jiangnan University,Wuxi 214122,China)
Aimed to investigate the feasibility of growing Chlorella sorokiniana outdoor in summer,a 6 L aerated vertical column photobioreactor was performed from Jun to Aug on the rooftop.When cultivated outdoor,algae auto-flocculation will happen heavily once pH was over 8.5.The photoinhibition caused by high incident light intensity(1 700±137 μmol/(m2·s))and the algal cells damage resulted from high temperature (48℃)lead to inhibition of algal growth.Chlorella sorokiniana is not able to grow well when temperature is over 40℃.The installation of reflectors,which covered by reflective thermal insulation mental coatings,could decrease light intensity by 42.21±4.7%,resulting in 2~4℃temperature decrease.However,light intensity still could be more than 900 μmol/(m2·s)on sunny days,making photoinhibition hard to be relieved.To achieve faster algal growth as well as continuous cultivation outdoor,more effort should be made to moderate the light intensity.
microalgae,photobioreactor,outdoor cultivation,light intensity,temperature
X 505
A
1673—1689(2015)03—0260—07
2014-03-26
国家新世纪优秀人才支持计划项目(NCET-10-0455)。
*通信作者:刘 和(1974—),男,江西吉安人,工学博士,教授,硕士研究生导师,主要从事污泥无害化、资源化及环境微生物技术应用于污染控制的研究。E-mail:liuhe@jiangnan.edu.cn
