丙肝病毒基因组、免疫逃逸及其疫苗研究进展
2015-01-06张成成张立张文军
张成成,张立,张文军,3
综述
丙肝病毒基因组、免疫逃逸及其疫苗研究进展
张成成1,张立2,张文军1,3
(1.广东药学院基础学院,广东广州510006;2.中山大学中山眼科中心,广东广州510060;3.武汉大学病毒学国家重点实验室,湖北武汉430072)
丙型肝炎标准疗法(SoC)及一些新型抗病毒药物的应用,存在治疗效果欠佳,费用昂贵,副作用多等问题。随着生物技术的不断发展和完善,丙肝病毒疫苗的研制取得了重大进展。虽然目前还没有一种疫苗能够直接应用于临床,但是丙肝病毒疫苗在治疗和预防丙肝方面仍有巨大的前景。本文将重点阐述HCV基因组结构及特点、相关免疫逃逸机制以及一些颇具前景的候选疫苗。
丙肝病毒;基因组;免疫逃逸;疫苗
丙型肝炎病毒(hepatitis C virus,HCV)是一种经过血液传播的肝炎病毒。目前,丙型肝炎呈全球性流行趋势,是欧美、日本及中国等国家慢性肝炎、肝硬化甚至肝癌的重要原因之一。据统计,全球约有3%的人口(约1.7亿人)感染HCV,每年新增丙型肝炎病例300~400万例[1-2]。我国血清流行病学调查结果显示,国内一般人群抗HCV阳性率为3.2%。抗HCV阳性率随年龄增长而逐渐上升。HCV1和2a型在我国最为常见,其中以1b型为主;部分地区有1a、2b和3b型相关报道;6型多要见于港、澳地区。虽然常规的抗病毒治疗方案(标准疗法SoC、新型抗病毒药物DAAs)能取得一定的治疗效果,但是其费用高,副作用大,而且不能从根本上解决丙肝的治疗难题,因此,HCV疫苗的研制势在必行。随着生物技术的不断发展和完善,丙肝病毒疫苗的研制也取得了重大的进展。虽然目前还没有一种疫苗能直接应用于临床,但是丙肝病毒疫苗在治疗和预防丙肝方面仍有巨大的前景。本文将重点阐述HCV基因组结构,相关免疫逃逸机制以及一些颇具前景的候选疫苗。
1 HCV基因组的结构及功能
HCV属黄病毒科丙型肝炎病毒属,为单股正链RNA病毒,基因组全长9 600个碱基对(bp),含有1个开放的编码区(OFR),可编码一个多聚蛋白前体,该蛋白前体由宿主和病毒的信号肽酶剪接成3个结构蛋白(核心蛋白、E1、E2)和7个非结构蛋白(NS1、NS2、NS3、NS4A、NS4B、NS5A、NS5B)[3]。HCV核心蛋白为病毒核衣壳的重要组成部分,通过与病毒RNA的结合来调节HCV基因组的翻译。包膜糖蛋白E1和E2分别构成病毒的外膜,介导病毒进入宿主细胞。E2区N 端HVR1高度变异,导致HCV易于逃避宿主免疫应答[4]。
1.1 结构蛋白区
1.1.1 核心蛋白(HCV core protein,HCV C) HCV C
蛋白由191个氨基酸残基组成,是HCV基组中较为保守的结构区域,位于 HCV基因组342~914 nt区段。HCV C蛋白为病毒核衣壳的重要组成部分,与糖蛋白作用组装出完整的HCV病毒颗粒。C蛋白通过与病毒RNA的结合来调节HCV基因组的翻译。有研究表明HCV C蛋白可抑制肿瘤抑制基因p53启动子的活性,与肝癌的发生密切相关[5]。
1.1.2 包膜糖蛋白(envelope glycoproteins) 包膜区基因包括E1和E2两部分,分别位于基因组的第915~1 490 nt区段(E1)和1491~2579 nt区段(E2),分别编码相对应的两种蛋白,构成病毒的外膜。E2区C端相对保守,N端变异较大。N端有两个高变区,即HVR1 和HVR2。由于该区中的HVR1易变性,使新的变异株可逃避机体的免疫攻击,致使 HCV感染易慢性化,且给疫苗制造带来困难[6]。因此研究包膜蛋白的抗原变异及宿主免疫应答规律,对HCV疫苗的研制和开发有重要的指导意义。
1.2 非结构蛋白区(non-structural protein,NS)
非结构蛋白区包括NS1、NS2、NS3、NS4A、NS4B、NS5A、NS5B。
NS1基因编码一段含有63个氨基酸的多肽 p7。Griffin等[7]研究证实,p7蛋白在HepG2细胞内可以形成六聚体,构成离子通道,对于病毒的成熟和释放极为重要,同时可以作为抗病毒治疗的潜在靶位。NS2基因编码由 216个氨基酸组成的跨膜蛋白 p23。Ogata 等[8]研究认为,在某些特定条件下 NS2蛋白酶可以通过Trans方式介导裂解,实验中观察到 EDTA能抑制NS2/NS3蛋白酶的活性,而 Zn2+可将其激活。NS3基因编码含有631个氨基酸的p72蛋白。Jhaveri等[9]最近研究认为NS3 L106A和F43A位点突变可抑制丝氨酸蛋白酶活性,并阻碍NS3-p53复合物形成,可能成为抑制HCV复制及致癌性的新靶位。NS4基因位于HCV基因组第5313~6257 nt区段,其编码的蛋白被加工处理为两部分,即NS4A和NS4B。其主要作用包括抑制翻译,调节NS5B RNA依赖的RNA聚合酶(RNA dependent RNA polymerase,RdRp)的活性等。NS4B主要集中在内质网腔中,可以诱导内质网膜的网状改变,为病毒复制复合体的形成提供支架[10]。NS5基因位于HCV基因组6528~9371 nt区段,编码的蛋白被加工处理为两部分,即 NS5A和 NS5B蛋白。Hiscott 等[11]研究证实,RNA依赖的 RNA聚合酶能在体外催化HCV RNA产生双链RNA发夹样分子,NS5B介导的RNA聚合酶通过还原拷贝机制,引发模板的延伸。
2 丙肝病毒的免疫逃逸机制
HCV逃避宿主免疫监视,实现体内持续感染的原因是复杂的:①病毒变异:病毒基因编码的抗原不断发生变异,产生新的HCV准毒株,逃避宿主的免疫监视,这是导致HCV持续感染和慢性化的一个主要原因。②HCV病毒蛋白可以影响机体的免疫功能。基因型la 和1b的E2以及NS5A可以干扰IFN的应答,使病毒逃脱机体非特异性免疫反应,并导致IFN耐药。NS3/ 4A阻断病毒感染所诱发的IRF-3活化,抑制宿主的免疫反应。NS5B可下调MHC-I分子的表达,抑制T淋巴细胞的细胞毒作用,降低机体对感染HCV细胞的清除。③HCV对机体免疫细胞功能造成损害:包括B细胞、NK细胞、T细胞、树突状细胞相关的免疫损伤。事实上,丙肝病毒的免疫逃逸是通过细胞免疫和体液免疫两个重要的途径来进行的,如表1和表2分别通过T细胞应答和抗体免疫应答来简要概括了丙肝病毒的免疫逃逸机制[12-27]。

表1 T细胞应答免疫逃逸机制Table 1 Mechanisms of escaping from T cell responses

表2 抗体免疫应答逃逸机制Table 2 Mechanisms of escaping from antibody responses
3 研制中的丙肝候选疫苗
3.1 治疗性疫苗
3.1.1 重组蛋白疫苗(recombinant protein-based vaccines)
重组蛋白疫苗的原理是分离编码靶蛋白的基因并在细菌、酵母或者哺乳动物细胞中进行表达,并分离、纯化该重组蛋白。这类重组蛋白具有HCV特定的保护性抗原表位,可诱导机体产生抗病毒免疫应答.GI5005是一种治疗性的蛋白疫苗产品,它是由加热灭活的酵母细胞改造而来,同时混合了NS3和核心蛋白,可以诱导强烈的T细胞应答。Torresi等[28]研究表明:GI5005具有良好的耐受性,且能诱发明显的特异性T细胞免疫应答。试验组外周血内病毒载量减少约1.41 g,而对照组减少量小于0.751 g。目前,GI5005联合标准疗法(SoC)的方案正在开展Ⅱ期临床试验,研究结果还未见公布[29]。
3.1.2 多肽疫苗(peptide-based vaccines) 多肽疫苗是按照病原体抗原基因中已知或预测的某段抗原表位的氨基酸序列,通过化学合成技术制备的疫苗。丙肝多肽疫苗经由疫苗肽链,通过HLA分子识别把信息传递给T细胞受体,诱导HCV特异性T细胞免疫。它能通过多个表位来诱导CTL和Th免疫应答来防止免疫逃逸。一般情况下,这些疫苗免疫源性较弱,通常需要联合佐剂来使用。IC41是一种多肽疫苗[30],这种疫苗含有5种合成肽,包括1型和2型HCV核心抗原和NS3和NS4蛋白上的4个保守区,另外还包括4个已知的HLA-2A抗原表位及3个杂合CD4+T细胞表位,再配以poly-L-arginine。Firbas等[31]的I期临床试验纳入128例HLA-2A阳性受试者接受该疫苗注射,其研
究结果表明,该疫苗耐受性较好,能诱导T细胞应答。但是Klade等[32]的Ⅱ期临床试验结果显示:IC41虽然可诱导CTL和Th细胞免疫应答,但作用甚微。
3.1.3 DNA疫苗(DNA-based vaccines) 质粒DNA能编码具有免疫原性的HCV蛋白或者各种大小的肽链抗原决定基,它直接应用于活体内诱导体液免疫和细胞免疫反应,具有高度的适应性。CIGB-230作为首个治疗性DNA疫苗,它融合了HCV核心蛋白及能表达HCV结构蛋白的质粒,已经处于临床研究的一期临床试验阶段。有研究表明,该疫苗具有良好的耐受性,能诱导相关抗体及核心蛋白特异性T细胞应答[33]。第2 个DNA疫苗现在正处于Ⅱ期临床试验阶段。
3.1.4 病毒载体疫苗(viral vector-based vaccines) 针对丙肝病毒RNA的病毒载体疫苗是一种有潜力的疫苗。通过腺病毒(adenovirus,Ad)、牛痘病毒、修饰的痘苗病毒安卡拉株(modified vaccinia Ankara,MVA)和禽痘病毒等病毒载体生产出HCV的各种结构蛋白和非结构蛋白作为抗原可诱导T细胞应答。这种病毒疫苗与DNA疫苗相似,它不仅能编码目标蛋白或者多肽,而且比DNA疫苗具有更强免疫原性。TG4040是一种病毒载体疫苗,由改造过的MVA的减毒载体再次改造而成,能表达NS3、NS4、NS5B等多种抗原。动物试验研究显示[34],它能诱导小鼠机体产生分泌γ干扰素(interferon γ,IFN-γ)的 T细胞及 CTL。Habersetzer 等[35]的Ⅰ期临床研究显示:TG4040能诱导产生分泌INF-γ的T细胞并能在体内持续6个月。其Ⅱ期临床试验的已完成,但相关资料未见公开发表。
3.1.5 树突细胞疫苗(dendritic cells-based vaccines)
树突细胞疫苗目前被作为一种安全、有效、有前景的治疗性疫苗,在体外通过将抗原或抗原基因导入树突细胞(dendritic cells,DCs),使抗原表位与树突细胞的MHC结合,呈现在细胞表面即成为树突细胞疫苗。DC细胞作为抗原呈递能力最强的细胞,可将提呈的抗原信息传递给T、B细胞,从而诱导体液免疫和细胞免疫应答[36]。将外源性抗原基因导入树突细胞较常用的方法应用重建病毒感染树突细胞,复制缺陷性腺病毒载体和痘苗病毒载体是目前最常用的病毒载体。关于DCs疫苗的有效性和安全性的第一阶段的临床试验已经开展[37]。
3.1.6 类病毒颗粒疫苗(VLP-based vaccines) 类病毒颗粒疫苗(VLPs)可能是未来疫苗的发展方向,它通过表达HCV结构蛋白的病毒样颗粒诱导机体产生抗体和T细胞应答。这种疫苗已经成功应用于人乳头瘤病毒[38]和 HBV[39]感染,它能沉默病毒的持续感染。因为它的相对大小和重复的结构,VLPs具有高度的免疫原性。此外,大多数的VLPs不需要通过佐剂来刺激免疫应答。可以相信,不久的将来类病毒样颗粒疫苗(VLPs)也会应用于动物实验和临床研究。
3.2 预防性疫苗
目前,全球研制的主要丙肝病毒疫苗基本属于治疗性疫苗,但事实上预防性疫苗的研制具有更大的社会意义。理想中的预防性疫苗应能使机体对HCV及其变异型产生强烈的细胞免疫和体液免疫应答,一旦病毒入侵,可以达到根除病毒的目的。但是,从实际角度出发,进行预防性疫苗的研究有一定的风险,因为它可能让健康的人体感染病毒,并且动物模型的实验结果也不能完全代表临床实验。然而,如果这样的疫苗一旦研制成功,那么在预防慢性感染方面将是一个可靠的选择。以下将讨论几类正在研制中的预防性候选疫苗。
3.2.1 重组蛋白疫苗(recombinant protein-based vaccines) HCV E1E2疫苗是由HCV的E1E2蛋白联合MF59C.1佐剂而成。有研究表明[40],使用重组蛋白HCV E1E2,在黑猩猩体内诱导交叉中和抗体(cross-nAbs),能保护HCV感染的黑猩猩。Frey[41]的一期临床试验,入选60名健康志愿者,给予不同剂量的HCV E1E2蛋白(基因型为1a),并联合MF59C.1佐剂,研究结果显示:实验组能测量到E1和E2抗体的存在,实验组和对照组在不良反应方面差异无统计学意义。另一种重组蛋白疫苗是HCV核心蛋白联合佐剂(ISCOMATRIXTM),目前也在进行Ⅰ期临床试验,有30个健康受试者入组。30例受试者中29例的体液免疫应答能被检测到,抗体滴定度>10[42]。
3.2.2 DNA疫苗(DNA-based vaccines) DNA疫苗可以通过编码细胞表面包膜糖蛋白E2诱导体内抗E2抗体发挥抗病毒作用。Forns[43]通过动物试验发现,黑猩猩2768在3次免疫接种之后仅能产生低浓度的抗E2抗体,当出现HCV病毒感染时,免疫记忆功能就会启动。其研究发现,丙肝病毒依然可以感染被疫苗接种过的黑猩猩,但是疫苗接种能解决早期的感染问题,而没有接种疫苗的对照组动物出现慢性感染。DNA疫苗不能消除免疫反应,但是它似乎能减轻感染,阻止丙肝的慢性化。
3.2.3 病毒载体疫苗(viral vector-based vaccines) 病毒载体疫苗是利用腺病毒良好的免疫原性,通过选择不感染人的血清型腺病毒(人类腺病毒6,Ad6;黑猩猩腺病毒3,ChAd3)来避免体内现存的中和抗体(nAbs)的干扰。这种疫苗接种能直接诱导机体产生强烈的T细胞免疫应答。有研究表明[44],MRKAd6NSmut和 DNA boosts在能产生显著的CD4+T和CD8+T反应。所有被感染HCV的动物,其HCV复制水平低于100倍。4/5接种免疫的黑猩猩能够清除病毒,与未接种疫苗的动物相比,接种疫苗的黑猩猩能够显著缩短病毒血症的时间。在所有免疫接种的动物中,肝脏的转氨酶未见明显升高。以黑猩猩源腺病毒 3(chimpanzee adenovirus 3,ChAd3)和人源腺病毒 Ad6为载体[45],把HCV的非结构蛋白NS3-NS5B区插入腺病毒载体,可以诱导 T细胞产生 IL-1、IFN-γ和肿瘤坏死因子 α (tumor necrosis factor α,TNF-α),具有较好的有效性和安全性。
3.2.4 病毒样颗粒疫苗(VLP-based vaccines) 重组蛋白疫苗在先前疫苗的设计上存在不足之处,主要困难在于蛋白质的正确折叠和产生过程。为了克服这些问题,Elmowalid[46]研制了病毒样颗粒疫苗(VLPs),作为一种有潜力的候选疫苗,它能表达HCV结构蛋白。在研究中,所有注入VLPs的试验动物均能产生CD4+T 和CD8+T细胞免疫应答。4只被感染HCV的黑猩猩有3只黑猩猩在10周能完全清除体内病毒,1只黑猩猩存在低剂量的HCV RNA病毒滴度。
4 展望
新型直接抗病毒药物(DAAs)的出现将HCV的抗病毒治疗提高到了一个新的水平,但是疫苗的研制和发展仍然具有重要的临床意义,尤其是对于那些HCV广泛流行区域的人们以及那些抗病毒治疗效果不佳的患者。通过更好地理解有效免疫应答的相关性,HCV疫苗的研制已经取得实质性进展。到目前为止,一些颇具前景的候选疫苗(如表3)已经进入动物实验或临床试验,但是有关这些疫苗的有效期和安全性的研究数据还十分有限,目前还没有疫苗进入临床Ⅲ期试验。基于肽链或者蛋白的T细胞疫苗仅仅能产生微弱的T细胞应答,这一应答过程很可能是通过佐剂的作用来适当提高免疫应答而不产生严重的副作用。DNA疫苗能产生有限的体液免疫和细胞免疫应答,这一过程需要佐剂来提高疫苗的免疫原性。病毒样颗粒疫苗(VLPs)存在很多免疫原性特征,是目前最有前景的HCV待选疫苗。迫切需要一种有效的疫苗来治疗这种疾病,从而减轻全球的负担。随着有效的免疫应答被进一步研究清楚,相信将来定会研制出一种有效的疫苗来解决这些困难。
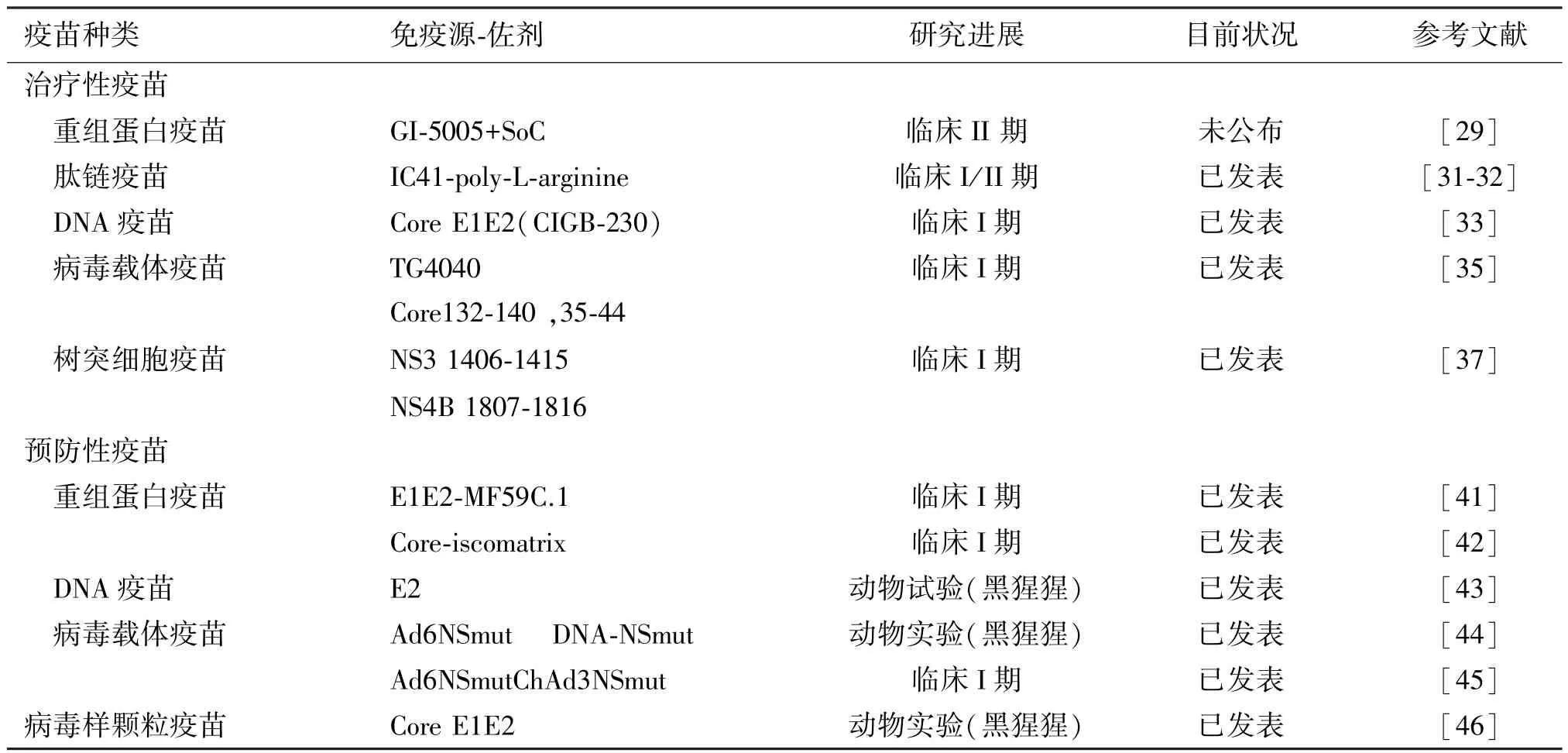
表3 进入动物实验和临床试验的候选疫苗Table 3 Candidate vaccines in preclinical animal experiments and clinical trials
[1]BUKH J.Animal models for the study of hepatitis C virus infection and related liver disease[J].Gastroenterology,2012,142(6):1279-1287.
[2]DAVIS G L,ALTER M J,EL-SERAG H,et al.Aging of hepatitis C virus(HCV)-infected persons in the United States:a multiple cohort modelof HCV prevalence and disease progression[J]. Gastroenterology,2010,138(2):513-521.
[3]CIESEK S,STEINMANN E,WEDEMEYER H,et al.Cyclosporine A inhibits hepatitis C virus nonstructural protein 2 through cyclophilin A[J].Hepatology,2009,50(5):1638-1645.
[4]SHE Yinglong,HAN Tao,YE Linbai,et al.Hepatitis C virus NS23 protease regulates HCV RES-dependent translation and NS5B RdRp activity[J]Arch Virol,2009,154(9):1465-1473.
[5]BARTENSCHLAGER R,SPARACIO S.Hepatitis C virus molecular clones and their replication capacity in vivo and in cell culture[J]. Virus Res,2007,127(2):195-207.
[6]FISCHER G,GALLAY P,HOPKINS S.Cyclophilin inhibitors for the treatment of HCV infection[J].Curr Opin Investig Drugs,2010,11 (8):911-918.
[7]GRIFFIN S D,BEALES L P,CLARKE D S,et al.The p7 protein of hepatitis C virus forms an ion channel that is blocked by the antiviral drug,Amantadine[J].FEBS Lett,2003,535(1/2/3):34-38.
[8]OGATA S,FLORESE R H,NAGANO-FUJII M,et al.Identification of hepatitis C virus(HCV)subtype 1b strains that are highly,or only weakly,associated with hepatocellular carcinoma on the basis of the secondary structure of an amino-terminal potion of the HCV NS3 protein[J].J Clin Microbiol,2003,41(7):2835-2841.
[9]JHAVERI R,KTMDU P,SHAPIRO A M,et al.Effect of heptitis C virus core protein on cellular gene expression:specific inhibition of cyclooxygenase 2[J].J lnfec Dis,2005,191(9):1498-1506.
[10]EIAZAR M,LIU P,RICE C M,et al.An N-terminal amphipathic helix in hepatitis C virus(HCV)NS4B mediates membrane association,correct localization of replication complex proteins,and HCV RNA replication[J].J Virol,2004,78(20):11393-11400.
[11]HISCOTT J,LACUSTE J,LIN R.Recruitment of an interferon molecular signaling complex to the mitochondrial membrane: disruption by hepatitis C virus NS3-4A protease[J].Biochem Pharmacol,2006,72(11):1477-1484.
[12]TIMM J,LAUER G M,KAVANAGH,et al.CD8 epitope escape and reversion in acute HCV infection[J].J Exp Med,2004,200(12): 1593-1604.
[13]COX A L,MOSBRUGER T,LAUER GM,et al.Comprehensive analyses of CD8+T cell responses during longitudinal study of acute human hepatitis C[J].Hepatology,2005,42(1):104-112.
[14]KUNTZEN T,TIMM J,BERICAL A,et al.Viral sequence evolution in acute hepatitis C virus infection[J].J Virol,2007,81(21): 11658-11668.
[15]KASPROWICZ V,SCHULZE ZURWIESCH J,KUNTZEN T,et al. High level of PD-1 expression on hepatitis C virus(HCV)-specific CD8+and CD4+T cells during acute HCV infection irrespective of clinical outcome[J].J Virol,2008,82(2):3154-3160.
[16]URBANI S,AMADEI B,FISICARO P,et al.Outcome of acute hepatitis C is related to virus-specific CD4 function and maturation of antiviral memory CD8 responses[J].Hematology,2006,44(1): 126-139.
[17]ACCAPEZZATO D,FRANCAVILLA V,PAROLI M,et al.Hepatic expansion of a virus-specific regulatory CD8+T cell population in chronic hepatitis C virus infection[J].J Clin Invest,2004,113(7): 963-972.
[18]SUGIMOTO K,IKEDA F,STADANLICK J,et al.Suppression of HCV-specific T cells without differential hierarchy demonstrated ex vivo in persistent HCV infection[J].Hepatology,2003,38(6): 1437-1448.
[19]KARED H,FABRE T,BEDARD N,et al.Galectin-9 and IL-21mediate cross-regulation between Th17 and Treg cells during acute hepatitis C[J].PLoS Pathog,2013,9(6):e1003422-e1003422.
[20]VON HAHN T,YOON J C,ALTER H,et al.Hepatitis C virus continuously escapes from neutralizing antibody and T-cell responses during chronic infection in vivo[J].Gastroenterology,2007,132(2):667-678.
[21]GAL-TANAMY M,KECK Z Y,YI M,et al.In vitro selection of a neutralization-resistant hepatitis C virus escape mutant[J].Proc Natl Acad Sci USA,2008,105(49):19450-19455.
[22]HELLE F,VIEYRES G,ELKRIEF L,et al.Role of N-linked glycans in the functions of hepatitis C virus envelope proteins incorporated into infectious virions[J].J Virol,2010,84(22): 11905-11915.
[23]BRIMACOMBE C L,GROVE J,MEREDITH L W,et al. Neutralizing antibody-resistant hepatitis C virus cell-to-cell transmission[J].J Virol,2011,85(1):596-605.
[24]TIMPE J M,STAMATAKI Z,JENNINGS A,et al.Hepatitis C virus cell-cell transmission in hepatoma cellsin the presence of neutralizing antibodies[J].Hepatology,2008,47(1):17-24.
[25]GROVE J,NIELSEN S,ZHONG Jin,et al.Identification of a residue in hepatitis C virus E2 glycoprotein that determines scavenger receptorBIand CD81 receptordependency and sensitivity to neutralizing antibodies[J].J Virol,2008,82(24): 12020-12029.
[26]ZHANG Pei,ZHONG Lilin,STRUBLE E B,et al.Depletion of interfering antibodies in chronic hepatitis C patients and vaccinated chimpanzees reveals broad cross-genotype neutralizing activity[J]. Proc Natl Acad Sci USA,2009,106(18):7537-7541
[27]FOFANA I,FAFI-KREMER S,CAROLLA P,et al.Mutations that alter use of hepatitis C virus cell entry factors mediate escape from neutralizing antibodies[J].Gastroenterology,2012,143(1):223-233.
[28]TORRESI J,JOHNSON D,WEDEMEYER H.Progress in the development of preventive and therapeutic vaccines for hepatitis C virus[J].J Hepatol,2011,54(6):1273-1285.
[29]XUE Jihua,ZHU Haihong,CHEN Zhi.Therapeutic vaccines against hepatitis C virus[J].Infect Genet Evol,2014,22(3):120-129.
[30]BAUMERT T F,FAUVELLE C,CHEN D Y,et al.A prophylactic hepatitis C virus vaccine:a distant peak still worth climbing[J].J Hepatol,2014,61(9):34-44.
[31]FIRBAS C,JILMA B,TAUBER E,et al.Immunogenicity and safety of a novel therapeutic hepatitis C virus(HCV)peptide vaccine:a randomized,placebo controlled trial for dose optimization in 128 healthy subjects[J].Vaccine,2006,24(20):4343-4353.
[32]KLADE C S,WEDEMEYER H,BERG T,et al.Therapeutic vaccination of chronic hepatitis C nonresponder patients with the peptide vaccine IC41[J].Gastroenterology,2008,134(5):1385-1395.
[33]ALVAREZ-LAJONCHERE L,SHOUKRY N H,GRA B,et al. Immunogenicity ofCIGB-230,a therapeutic DNA vaccine preparation,in HCV chronically infected individuals in a Phase I clinical trial[J].J Viral Hepat,2009,16(3):156-167.
[34]FOURNILLIER A,GEROSSIER E,EVLASHEV A,et al.An accelerated vaccine schedule with a poly-antigenic hepatitis C virus MVA-based candidate vaccine induces potent,long lasting and in vivo cross-reactive T cell responses[J].Vaccine,2007,25(42): 7339-7353.
[35]HABERSETZER F,HONNET G,BAIN C,et al.A poxvirus vaccine is safe,induces T-cell responses,and decreases viral load in patients with chronic hepatitis C[J].Gastroenterology,2011,141 (3):890-899.
[36]LARSSON M.The dendritic cell:the immune system’s adjuvant-a strategy to develop a HCV vaccine[J].Gastroenterology,2006,130 (2):603-606.
[37]GOWANS E J,ROBERTS S,JONES K,et al.A phase I clinical trial of dendritic cell immunotherapy in HCV-infected individuals [J].J Hepatol,2010,53(4):599-607.
[38]HILLEMAN M R.Overview of the pathogenesis,prophylaxis and therapeusis of viral hepatitis B,with focus on reduction to practical applications[J].Vaccine,2001,19(15/16):1837-1848.
[39]GIANNINI S L,HANON E,MORIS P,et al.Enhanced humoral and memory B cellular immunity using HPV1618 L1 VLP vaccine formulated with the MPL aluminium salt combination(AS04) compared to aluminium salt only[J].Vaccine,2006,24(33/34): 5937-5949.
[40]MEUNIER J C,GOTTWEIN J M,HOUGHTON M,et al.Vaccineinduced cross-genotype reactive neutralizing antibodies against hepatitis C virus[J].J Infect Dis,2011,204(8):1186-1190.
[41]FREY S E,HOUGHTON M,COATES S,et al.Safety and immunogenicity of HCV E1E2 vaccine adjuvanted with MF59 administered to healthy adults[J].Vaccine,2010,28(28):6367-6373.
[42]DRANE D,MARASKOVSKY E,GIBSON R,et al.Priming of CD4+and CD8+T cell responses using a HCV core ISCOMATRIX vaccine:a phase I study in healthy volunteers[J].Hum Vacci,2009,5(3):151-157.
[43]FORNS X,PAYETTE P J,MA X,et al.Vaccination of chimpanzees with plasmid DNA encoding the hepatitis C virus(HCV)envelope E2 protein modified the infection after challenge with homologous monoclonal HCV[J].Hepatology,2000,32(3):618-625.
[44]FOLGORI A,CAPONE S,RUGGERI L,et al.A T-cell HCV vaccine eliciting effective immunity against heterologous virus challenge in chimpanzees[J].Nat Med,2006,12(2):190-197.
[45]BARNES E,FOLGORI A,CAPONE S,et al.Novel adenovirusbased vaccines induce broad and sustained T cell responses to HCV in man[J].Sci Transl Med,2012,4(115):115.
[46]ELMOWALID G A,QIAO Ming,SONG Jie,et al.Immunization with hepatitis C virus-like particles results in control of hepatitis C virus infection in chimpanzees[J].Proc Natl Acad Sci USA,2007,104(20):8427-8432.
(责任编辑:王昌栋)
Progress on the genome,immune-evasion and vaccines of hepatitis C virus
ZHANG Chengcheng1,ZHANG Li2,ZHANG Wenjun1,3
(1.Guangdong Pharmaceutical University,Guangzhou 510006,China;2.Zhongshan Ophthalmic Center,Sun Yat-Sen University,Guangzhou 510060,China;3.State Key Laboratory of Virology,Wuhan University,Wuhan 430072,China)
Standard-of-care(SoC)therapy and new antiviral agents for hepatitis C are inadequate and expensive with lots of side effects.Great progress has been made on the HCV vaccine with the development of biotechnology.Although there is no HCV vaccine that can be directly used in the clinical treatment at present,we still have great therapeutic and prophylactic prospect on HCV vaccine.In this review,we will mainly discuss the characteristics of the HCV gene,related immune mechanisms of escape and promising HCV vaccine candidates.
hepatitis C virus;genome;immune-evasion;vaccine
R186
:A
10.3969/j.issn.1006-8783.2015.05.028
1006-8783(2015)05-0682-06
2015-06-29
中国博士后科研基金(2013M540601)
张成成,女,2013级硕士研究生,Email:313797228@qq.com;通信作者:张文军,男,副教授,硕士生导师,主要从事病原生物的致病作用及防治研究,Email:zhangwj@gdpu.edu.cn。
时间:2015-09-22 16:23
http://www.cnki.net/kcms/detail/44.1413.R.20150922.1623.002.html
