STR-PCR在异基因造血干细胞移植中植入效果监测的应用
2015-01-06朱素敏
张 涛,王 芳,朱素敏,毛 伟,黄 霞
(重庆市血液中心输血研究所 400015)
论著·临床研究
STR-PCR在异基因造血干细胞移植中植入效果监测的应用
张 涛,王 芳,朱素敏,毛 伟,黄 霞△
(重庆市血液中心输血研究所 400015)
目的 建立适用于重庆地区造血干细胞移植后监测的PCR扩增荧光标记短串联重复序列(STR-PCR)检测方法,为造血干细胞移植疗效评价提供可靠依据。方法收集术前供者、受者EDTA抗凝静脉血及受者术后不同时间EDTA抗凝静脉血,采用STR-PCR技术对65例allo-HSCT患者的15个STR位点和1个性别位点进行分析。结果65例异基因造血干细胞移植术的病例,术后检测患者STR位点呈现受者源、供者源和供受者嵌合3种状态,有54例的移植后监测呈现供者源状态,8例移植后监测到嵌合体状态,3例移植后监测呈现受者源状态,且发现3种状态之间可相互转化,每种状态的最早检出时间和持续时间及转化时间存在差异,其中出现供者源状态的最早时间是术后第17天,持续最长时间为7多个月。而出现嵌合状态的最早时间为术后第16天,最晚在移植后5个月才监测到嵌合。在嵌合持续时间上,持续时间最短为2个月,持续时间最长者达7个月。结论allo-HSCT患者术后STR位点转化情况存在差异,要建立起适用于该地区的STR-PCR方法需要正确留取供受者标本,同时应掌握好恰当的检测时机和适宜的STR位点。
造血干细胞移植;PCR扩增荧光标记;短串联重复序列;效果监测
造血干细胞移植术后植入状况的监测对于判断移植成功与否及疾病转归具有重要影响[1],一直以来也是临床医生较为关注的一个问题。近年来通过PCR扩增荧光标记的短串联重复序列(shore tandem repeat,STR)并结合毛细管电泳技术,可以敏感显示出造血干细胞移植物的植入状态,目前已有诸多文献报道了其在造血干细胞移植后监测中的应用价值[2-5]。但限于技术支持、标准缺乏等方面的原因,临床对这一技术的应用仍少见和不规范,实验人员对监测时机、位点选择等缺乏统一意见。因此,笔者拟采用STR-PCR方法,对重庆地区65例接受异基因造血干细胞移植术患者移植前、后及供者的基因型进行检测和追踪监测,探讨STR-PCR方法在异基因造血干细胞移植植入监测中有关监测时机、位点选择、指导意义等方面的具体应用,以及建立适用于本地区人群特点的异基因造血干细胞移植植入后的STR-PCR监测方法。
1 资料与方法
1.1 一般资料 研究者来自第三军医大学新桥医院、重庆医科大学附属第一医院、重庆医科大学附属儿童医院、第三军医大学大坪医院等几所三甲医院血液科,于2009~2012年行异基因造血干细胞移植的血液病患者共计65例。其中外周血干细胞移植60例,脐带血移植5例。其中男30例,女35例;患者移植年龄0.9~58.0岁,中位年龄29岁;诊断为白血病患者51例,地中海贫血1例,再生障碍性贫血6例,骨髓增生障碍综合征4例,淋巴瘤3例,免疫缺陷型高免疫球蛋白M(IgM)连锁血症1例。
1.2 方法
1.2.1 样本采集 采集前与临床医生沟通,交流STR-PCR技术要点、实验原则、临床意义等。按照实验设计要求,移植前收集供、受者术前新鲜EDTA抗凝静脉血5 mL即时送检,移植后每7~15天收集1次受者外周血样,至受者达到可评价的终点(即临床治愈或死亡)时为止。

表1 65例造血干细胞移植病例植入存活状况检测结果(n)

表2 存在嵌合现象的移植病例嵌合监测情况
1.2.2 基因组DNA提取 分别取新鲜EDTA抗凝全血300 μL,按Gentra盐析法DNA提取试剂盒说明的步骤进行DNA提取。用紫外分光光度仪测定DNA水平后4 ℃保存。
1.2.3 DNA扩增程序 对16个STR位点(D8S1179、D21S11、D7S820、CSF1PO、D3S1358、TH01、D13S317、D16S539D、2S1338、D19S433、VWA、TPOX、D18S51、D5S818、FGA和Amelogenin性别判断标记)进行PCR复合扩增:PCR反应总体积25 μL,其中含Re-mix液10 μL,Primer set液5 μL,Gold Taq酶0.5 μL,模板DNA 10 μL。按下述条件进行PCR反应(2700型扩增仪):95 ℃11 min→(94 ℃ 1 min→59 ℃ 1 min→72 ℃ 1 min)×28 个循环→60 ℃ 60 min→4~25 ℃保温。
1.2.4 电泳样品制备 取1.5 μL扩增产物,加入Hi-Di甲酰胺10.0 μL和GeneScan-500Liz分子量标记0.7 μL对扩增产物进行变性,按1.5∶10.0∶0.7比例混匀后于95 ℃变性3 min,随即冰浴3 min。
1.2.5 电泳 取电泳样品2 μL于96孔板内,ABI 3100利用POP-4(Performance Optimized Polymer4)胶、36 cm毛细管进行全自动电泳。电压3 000 V收集1.5 h。利用Data Collection收集数据。用Gene-MapperTMSoftware version 3.5根据DNA片断长度及等位基因梯分析各位点基因型。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,分类变量资料采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 65例造血干细胞移植病例植入存活状况检测结果 65例造血干细胞移植病例中,有2例仅监测到受者源状态,没有出现供者基因型,显示移植失败。54例监测完全表现为供者源型,其中监测到出现供者源状态的最早时间是术后第17天,最长时间为7个多月后患者仍为供者源状态。其余8例监测到有供受者嵌合状态,其中2例先为供者源状态后转化为嵌合状态,2例先由嵌合状态最终转化为供者源状态,此4例转化时间均存在差异。其余4例监测一直为嵌合状态。监测出现嵌合状态的最早时间为术后第16天,最晚在移植后5个月。在嵌合持续时间上,持续时间最短为2个月,持续时间最长者达7个月。同时根据监测结果,发现HLA-ABDR不全相合移植和全相合移植之间移植效果存在差异,3/6~5/6相合移植中监测到转化为供者源状态的比例是58%,而6/6相合移植中转化为供者源状态的比例是92.45%,两组差异有统计学意义(χ2=6.90,P<0.01),HLA全相合移植效果优于3/6~5/6相合移植,见表1。
2.2 8例监测到嵌合状态患者的具体结果 不同患者嵌合状态的出现时间并不一致,即使是同一患者,其嵌合状态也存在变化。受嵌合比例的变化和检测能力的影响,在具体检出嵌合体的位点上也存在变化。即使已全转为供者源状态后患者仍有可能转变为嵌合体状态,通过临床信息追踪,发现嵌合状态的出现常伴随患者疾病复发或加重甚至死亡等情况,且65例病例中在整个监测过程中监测到有嵌合现象的患者疾病预后均较差,见表2。
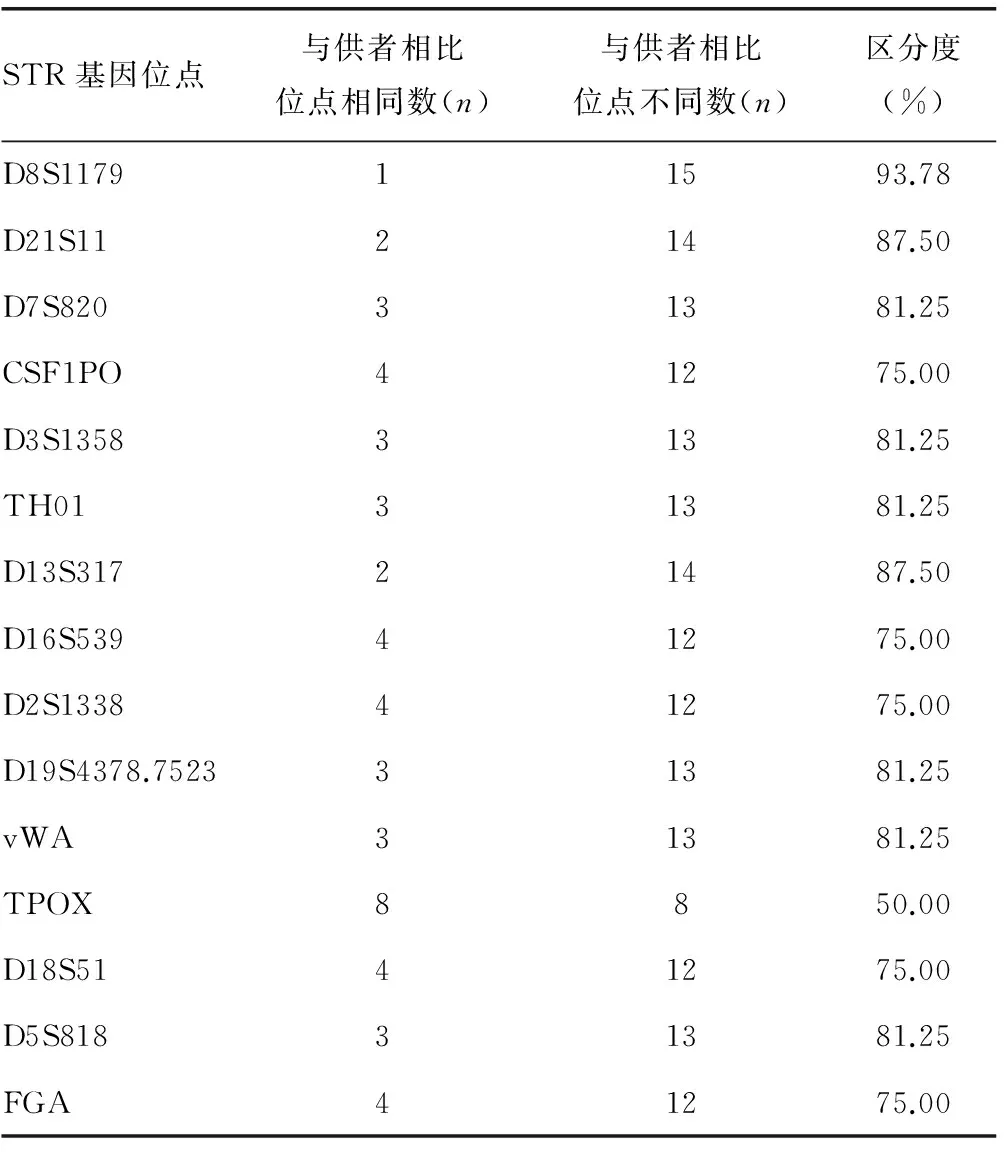
表3 16例HSCT患者中15个STR基因位点的区分度
2.3 排除性别位点后的15个STR基因位点的区分度 由于医院采集标本的困难及患者依从性的原因,65例病例患者在移植前和移植后均留有标本进行STR检测,并能与供者的STR结果进行比较的例数为16例。计算这16例患者移植前后15个STR位点的各自的区分度发现,区分度最低者TPOX位点为50.00%,最高者D8S1179位点为93.78%,其余多数位点区分度波动在75.00%~87.50%,平均区分度为78.75%,见表3。
3 讨 论
STR由于具有高度的多态性和遗传稳定性,作为遗传学DNA分子标记,目前已广泛应用于遗传制图、连锁性分析、亲子鉴定、疾病基因定位和物种多态性研究等诸多领域[6]。但在各个地区,具体应用STR-PCR技术时均面临诸多的实际问题,比如标本的留取,检测时机及检测位点的选取等。如何建立适用于本地区的异基因造血干细胞移植植入后的STR-PCR监测方法,无疑值得探讨。
首先面临的一个问题便是监测标本的选择问题。在已有的研究中,有选取患者移植前后血液标本进行比对的,有选取患者移植后血液标本和口腔黏膜标本进行比对的,在这些研究中,往往忽略了对供者标本的留取并对其STR位点进行分析和比对。单纯留取患者移植前后血液标本进行自身比对或者移植后与口腔黏膜标本进行自身比对,均不能直观、可靠地作为参考,并且有研究报道随着移植时间的延长,患者口腔黏膜也有转化为供者型的可能。本实验中留取移植前供、受者血液标本进行STR位点分析,移植后再留取患者标本进行STR位点分析,并与移植前标本及供者血液标本进行比对,直观可靠、清晰明了地观察到患者移植后的嵌合状态,有效排除了许多因素的影响。强调留取供者标本及移植前患者标本,虽然有可能增加患者检测费用,但随着此项技术的普及和检测标本量的增加,相关的检测费用会进一步下降。
其次,应用STR-PCR技术时监测时机的选择也是一个值得重视的问题。嵌合体的形成是一个动态变化过程。完全的供者源状态和混合嵌合体可以出现在移植后的不同时期,并可随病情的演化和时间的推移而相互转化,因此对嵌合体进行持续监测比间断性监测更具有临床指导意义。只有选择了适当的检测时间,才能更好地监测到嵌合体的变化状况及获得有意义的信息,以便及时做出相应的治疗措施。在本实验中,观察到了65例病例中转变为供者型的最早时间和最迟时间,同时也观察到嵌合体出现的最早时间和最迟时间,并了解了嵌合体可以长期持续存在一段时间等情况。综合已有的研究报道,笔者认为移植后最迟不超过7 d即应留取移植检测标本,在最初的前3个月内,应每7~15天留取标本,加强早期的移植后患者嵌合率的监测。随着病情发生变化,更应及时留取标本,以便发现移植后的转变和发展。
最后,STR位点选择是PCR-STR技术在干细胞移植中能否应用成功的关键。STR位点等位基因数目众多,分布情况存在人群、地区差异性[7],如何选择位点错配少,个体识别能力高、易于分型而且等位基因频率在人群中分布较好的STR位点,真正建立适用于本地区的异基因干细胞移植植入后的PCR-STR监测方法,是本研究主要探讨的问题。本实验中笔者与重庆市司法鉴定所合作,根据其既往的STR群体遗传资料研究表明,15个STR基因座(CSF1PO、D13S317、D16S539、D18S51、D19S433、D21S11、D2S1338、D3S1358、D5S818、D7S820、D8S1179、FGA、TH01、TPOX、vWA)在重庆地区汉族人群中有很高的遗传多态性,累积DP>0.999 999 999,累积PE值为0.999 999 042,适用于作为重庆地区汉族人群个体识别、亲子鉴定的科学依据及建立该地区汉族人群的STR基因数据库的基础数据[8]。因此,笔者选择这15个位点进行复合扩增用于HSCT移植后分析的位点。结果显示,选择的15个STR位点具有高度多态性和区别能力,其中区分度最高者达93.78%,最低的区分度亦有50.00%。考虑到进行统计分析的这16例患者大多数为直系亲属间移植,STR位点的同源性降低了检测的区分度,倘若是在非亲缘关系移植间的监测中,则15个STR位点的检测区分度应尚能大幅提升,因此15个STR基因位点对患者移植前后的移植状态能很好地监测,可联合应用于移植后植入状态的监测。
综上所述,在干细胞移植后正确留取供、受者标本,掌握好恰当的检测时机,采用适宜的STR位点进行STR-PCR监测,建立起真正适用于本地区的STR-PCR方法,可以早期识别移植物植入、检测残留微小病变、预测移植效果等,这样才能真正发挥STR-PCR方法的最大优势。
[1]李丹,王易,胡绍燕.人脐带间充质干细胞治疗白血病患儿异基因造血干细胞移植术后急性移植物抗宿主病疗效观察[J].中国实用儿科杂志,2012,27(12):937-939.
[2]Odriozola A,Riancho JA,Mijares V,et al.Chimerism detection by short tandem repeat analysis when donor and recipient genotypes are not known[J].Clin Chim Acta,2012,413(5/6):548-551.
[3]Park M,Koh KN,Seo JJ,et al.Clinical implications of chimerism after allogeneic hematopoietic stem cell transplantation in children with non-malignant diseases[J].Korean J Hematol,2011,46(4):258-264.
[4]Taira C,Matsuda K,Takezawa Y,et al.Development of multiplex short tandem repeat (STR)-PCR for chimerism analysis in patients with hematological malignancies and comparison of chimerism in different sample sources[J].Rinsho Byori,2011,59(1):24-30.
[5]Li SX,Zhu HL,Guo B,et al.Application of short-tandem-repeat amplification and fluorescent-multiplex PCR for chimerism analysis[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2011,19(3):749-753.
[6]Odriozola A,Riancho JA,Colorado M,et al.Evaluation of the sensitivity of two recently developed STR multiplexes for the analysis of chimerism after haematopoietic stem cell transplantation[J].Int J Immunogenet,2013,40(2):88-92.
[7]Thompson R,Zoppis S,McCord B.An overview of DNA typing methods for human identification:past,present,and future[J].Methods Mol Biol,2012(830):3-16.
[8]黄霞,王芳,毛伟,等.重庆地区汉族人群15个STR基因座遗传多态性研究[J].重庆医学,2008,37(1):58-60.
Application of STR-PCR in monitoring the effect of allogeneic hematopoietic stem cell transplantation*
ZhangTao,WangFang,ZhuSumin,MaoWei,HuangXia△
(TheTransfusionInstitute,ChongqingBloodCenter,Chongqing400015,China)
Objective To establish multiple short tandem repeat (STR) amplification by fluorescence labeling polymerase chain reaction (PCR) for monitoring the effect of allogeneic hematopoietic stem cell transplantation.Methods Sixty-five patients were analyzed.DNA from peripheral blood of donors and recipients in pre transplantation and post transplantation were extracted,15 STR loci and sexual loci were amplified by PCR.Results After allo-HSCT,54 patients obtained type of donors,but 3 patients did not;eight patients showed mixed chimerism.Two cases of type of donor converted into mixed chimerism and two cases of mixed chimerism converted into type of donors after some time.The time of earliest detection,duration and transformation of each state was different.The earliest detection showed on the 16th day after surgery,and the last one showed five months later.As to the duration,the shortest and longest were two months and seven months,respectively.Conclusion The key factors that significantly influence the application of STR-PCR in monitoring the effect of allogeneic hematopoietic stem cell transplantation were samples,STR loci and proper monitoring time.So to establish the suitable method for this region could truly take maximum advantage of the PCR-STR method.While a appropriate detecting time and STR loci should be chose.
hematopoietic stem cell transplantation;STR-PCR;effect examination
:10.3969/j.issn.1671-8348.2015.19.014
重庆市卫生局医学科研项目资助(2008-2-265)。
张涛(1982-),主治医师,在读硕士,主要从事输血医学相关研究。
△通讯作者,Tel:13018355909;E-mail:xiahuangyy@163.com。
R551.3
A
1671-8348(2015)19-2632-03
2014-12-18
2015-02-26)
