MBD4蛋白在子宫内膜腺癌中的表达及临床意义*
2015-01-06刘晓丽史晓雨程国艳齐丽宁宋菲菲李学慧
刘晓丽,史晓雨,程国艳,齐丽宁,宋菲菲,李学慧
(河北医科大学第一医院妇产科,石家庄 050011)
论著·临床研究
MBD4蛋白在子宫内膜腺癌中的表达及临床意义*
刘晓丽,史晓雨,程国艳,齐丽宁,宋菲菲,李学慧△
(河北医科大学第一医院妇产科,石家庄 050011)
目的探讨MBD4蛋白在子宫内膜腺癌中的表达及临床意义。方法采用免疫组织化学SP法检测45例正常子宫内膜和60例子宫内膜腺癌中MBD4蛋白的表达,并分析其与临床分期和病理分级的关系。结果MBD4蛋白在正常子宫内膜和子宫内膜腺癌中的阳性表达率分别为60%及25%,呈降低趋势,差异具有统计学意义(P<0.05)。MBD4蛋白的表达与子宫内膜腺癌的临床分期、病理分级、子宫肌层浸润深度、淋巴转移无相关性。结论MBD4蛋白的缺失在子宫内膜腺癌发病及治疗中有一定作用。
子宫内膜肿瘤;MBD4蛋白;妇科肿瘤
子宫内膜癌(endometrial carcinoma)是女性生殖道三大恶性肿瘤之一,比例为20%~30%,占女性全身恶性肿瘤的7%。近年来,全世界子宫内膜癌的发病率逐年上升。每年大约7.4万女性死于子宫内膜癌,主要由于癌症的复发和转移[1]。手术结合放化疗为目前最主要的治疗子宫内膜癌的方法。MBD4(methyl-CpG-binding domain 4)作为一种抑癌基因,其在食管鳞状细胞癌、肺癌中的表达已有相关报道[2-4],本文拟研究MBD4蛋白在子宫内膜腺癌中的表达,为子宫内膜腺癌的发现及治疗提供实验依据。
1 资料与方法
1.1 一般资料 收集河北医科大学第一医院2010年1月至2014年1月病理科各项临床资料完整的子宫内膜腺癌蜡块60例。所有病理诊断均由病理科主任医师复核确认。子宫内膜癌患者年龄范围为22~75岁,中位年龄为52岁。所有研究对象均未接受放疗、化疗、激素治疗或其他抗肿瘤治疗。另取同期因子宫肌瘤切除子宫并经病理检查确诊为正常子宫内膜的45例蜡块作为对照,正常子宫内膜者年龄范围为25~51岁,中位年龄为42岁。
1.2 试剂 一抗兔抗MBD4(HPA002031)购自美国Sigma公司,SP免疫组化染色试剂盒购自河北博海生物工程有限公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 方法 石蜡包埋组织以5 Hm厚度连续切片,烤箱60~65 ℃过夜,常规脱蜡和水化,柠檬酸缓冲液煮沸修复抗原,采用SP免疫组化法染色,严格按照免疫组化试剂盒说明书步骤进行:滴加3%H2O2消除内源性过氧化物酶的活性;正常山羊血清封闭后滴加一抗,4 ℃过夜后,依次滴加生物素、辣根酶标记链霉卵白素,DAB显色,自来水终止,苏木素复染,脱水、透明、封片、镜检。以已知MBD4蛋白阳性切片作为阳性对照,以PBS液代替一抗作为阴性对照。
1.4 免疫组化结果判定 MBD4在子宫内膜细胞核及细胞质出现棕黄色颗粒为阳性。每张切片随机选出10个不重复、不重叠高倍视野(×400),计数取各视野平均值。采用 Allred score评分系统,Allred score=阳性细胞比例分值+阳性强度分值。阳性细胞比例分值:无染色0分,<1%染色为1分,1%~10%染色为2分,11%~33%为3分,34%~66%为4分,67%~100%为5分。阳性强度分值:阴性0分,弱阳性1分,中等阳性2分,强阳性3分,相加分值范围为0~8分。相加分值大于或等于3分为阳性[5]。需注意染色阳性仅出现在组织边缘视为边缘效应不计入分值;染色模糊考虑人工假象需排除。
1.5 统计学处理 采用SPSS 13.0软件进行统计学分析,计数资料用百分率表示,不同组间采用卡方检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 MBD4在正常和子宫内膜腺癌组织中的表达 正常子宫内膜组织中27例阳性,阳性率为60%(图1A、图1B)。子宫内膜腺癌组织中阳性表达为15例,阳性表达率为25%(图1C、图1D)。统计分析结果示子宫内膜腺癌的阳性表达率与正常子宫内膜比较差异具有统计学意义(P<0.05)。
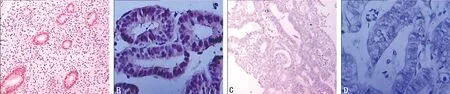
A:正常子宫内膜腺体中的阳性表达(SP×40);B:正常子宫内膜腺体中的阳性表达(SP×100);C:子宫内膜癌腺体中的阴性表达(SP×40);D:子宫内膜癌腺体中的阴性表达(SP×100)。
图1 MBD4在子宫内膜中的表达
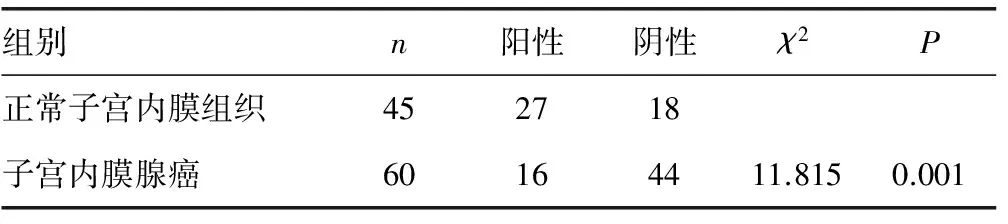
表1 MBD4在正常子宫内膜和子宫内膜腺癌组织中的表达
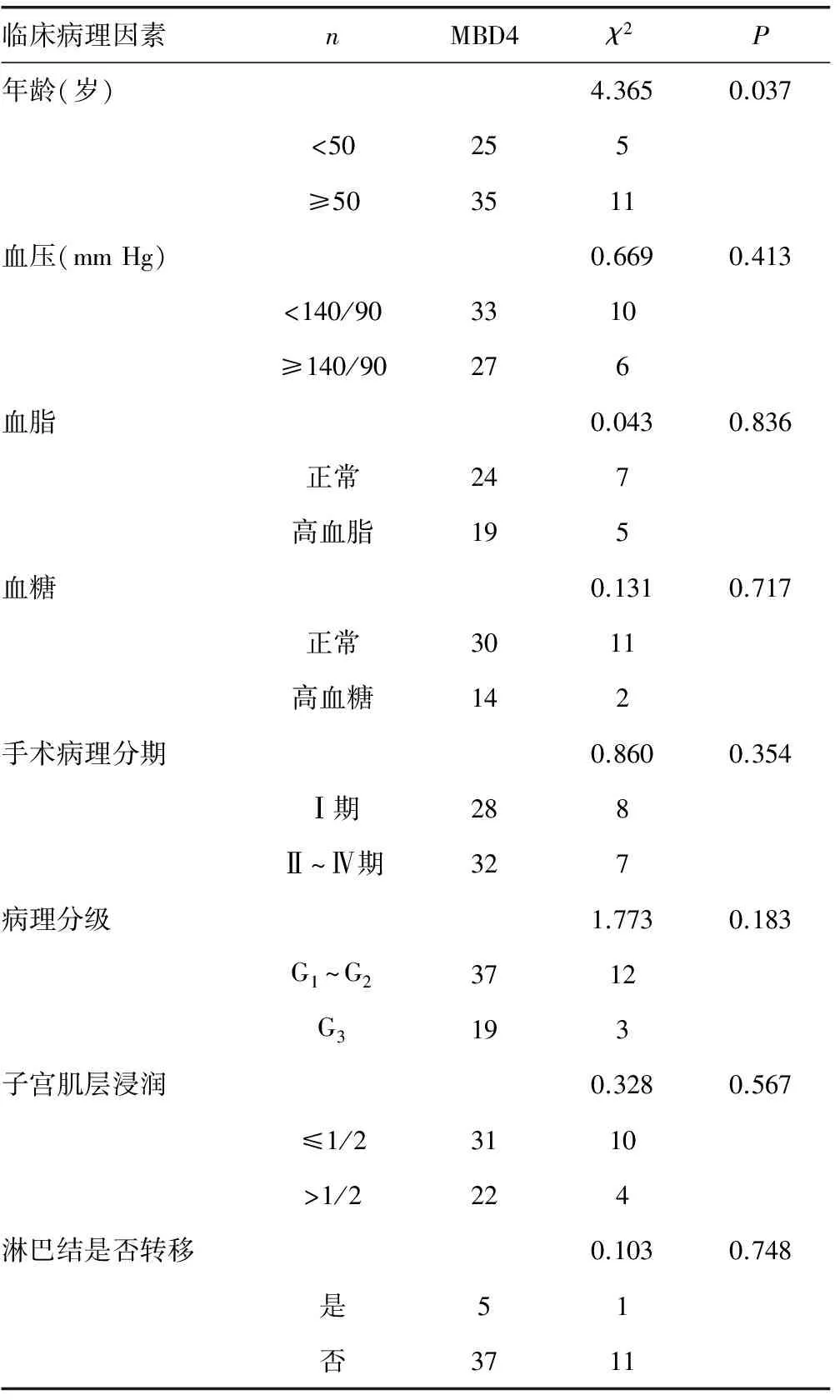
表2 MBD4蛋白表达与子宫内膜腺癌患者临床病理特征关系
2.2 MBD4蛋白表达与临床病理特征的关系 实验结果示,MBD4蛋白在子宫内膜腺癌中的表达与患者的血压、血脂、血糖高低、临床分期、病理分级、子宫肌层浸润、淋巴转移无明显相关性(P>0.05)。MBD4蛋白在高年龄组子宫内膜腺癌组织中表达高于低年龄组,差异具有统计学意义(P<0.05),见表2。
3 讨 论
MBD4基因可编码MBD4蛋白,该蛋白又称甲基化CpG结合域蛋白4,是DNA碱基切除修复通路(base excision repair,BER)的重要成员之一。自1998年被分离鉴定以来,大量的功能学研究结果证实:MBD4在肿瘤的发生发展、临床治疗及预后中发挥重要的作用。MBD4蛋白可以特异性地切除DNA序列中甲基化或半甲基化的胞嘧啶(C)和错配的胸腺嘧啶(T)或尿嘧啶(U),从而维护基因组的稳定性,抑制基因突变,因而MBD4基因被认为是一种抑癌基因[6]。近年来研究结果指出,MBD4除具有碱基切除修复的特异生物学功能外,还具有其他广泛的功能,如可以与MHLI蛋白结合参与DNA的错配修复通路,与Fas相关死亡结构域蛋白(fas-associated death domain protein,FADD)结合参与细胞的程序性细胞凋亡[7],可通过调节P21蛋白的表达而阻滞细胞周期[8],可影响铂类等多种化疗药物发挥功能[9-12],通过多种途径影响肿瘤的发生、发展及预后。本实验结果显示MBD4蛋白在子宫内膜腺癌的阳性表达与正常子宫内膜的阳性表达有统计学意义,不少学者也证明MBD4的多态性和对肿瘤易感性的关系,例如食管鳞状细胞癌、肺癌等[2-4]由此推断,MBD4蛋白的缺失可一定程度上导致了子宫内膜腺癌的发生。
MBD4蛋白在子宫内膜腺癌中的表达情况与临床分期、病理分级、子宫肌层浸润、淋巴转移无明显相关性,可以考虑MBD4蛋白缺失是子宫内膜腺癌发生的原因之一,而与其发展和转移等中晚期事件无关,可以推断MBD4蛋白不能作为评估子宫内膜腺癌恶性程度和判断预后的参考指标,考虑到样本量的选择和各个分期的构成比差异会导致一定的抽样误差,进一步增加样本量进行研究是必要的。MBD4基因表达与铂类化疗药物的临床疗效发挥有关[9],同时,MBD4基因缺失小鼠不能正常修复铂类引起的DNA损伤,研究发现,MBD4基因的较短剪切产物可以造成整个基因组的突变,甚至导致化疗药物的耐受[13],此截短突变与染色体的重组有关,DLD1细胞系中MBD4(tru)基因型的过表达影响了铂类制剂暴露后的存活时间[14],铂类是子宫内膜腺癌治疗常用的化疗药物,以上研究结果提示MBD4基因改变与子宫内膜腺癌临床化疗的疗效及预后存在相关性,可能是子宫内膜腺癌的预后因素。此外,MBD4蛋白参与调控细胞周期,尤其是DNA损伤后的细胞周期阻滞和凋亡过程[15],这也提示MBD4基因改变可能影响细胞周期化疗药物和放射治疗的临床疗效,从多个方面影响肿瘤的预后。
总之,MBD4蛋白的表达在子宫内膜腺癌临床治疗和预后的各个环节发挥着重要作用,有望成为子宫内膜腺癌的易感标志物和预后因子,具有潜在的子宫内膜腺癌防治和个体化临床治疗的指导意义,但在MBD4蛋白与子宫内膜腺癌发展中的作用,需要进一步研究。
[1]Van der Horst PH,Wang Y,Vandenput I,et al.Progesterone inhibits epithelial-to-mesenchymal transition in endometrial cancer[J].PLoS One,2012,7(1):e30840.
[2]Hao B,Wang H,Zhou K,et al.Identification of genetic variants in base excision repair pathway and their associations with risk of esophageal squamous cell carcinoma[J].Cancer Res,2004,64(12):4378-4384.
[3]Shin MC,Lee SJ,Cha SI,et al.Glu346Lys polymorphism in the methyl-CpG binding domain 4 gene and the risk of primary lung cancer[J].Jpn J Clin Oncol,2006,36(8):483-488.
[4]Miao R,Gu H,Liu H,et al.Tagging single nucleotide polymorphisms in MBD4 are associated with risk of lung cancer in a Chinese population[J].Lung Cancer,2008,62(3):281-286.
[5]Madeira KP,Daltoé RD,Sirtoli GM,et al.Comparison of immunohistochemical analysis with estrogen receptor SP1 and 1D5 monoclonal antibodies in breast cancer[J].Pathol Res Pract,2012,208(11):657-661.
[6]Millar CB,Guy J,Sansom OJ,et al.Enhanced CpG mutability and tumorigenesis in MBD4-deficient mice[J].Science,2002,297(5580):403-405.
[7]Screaton RA,Kiessling S,Sansom OJ,et al.Fas-associated death domain protein interacts with methyl-CpG binding domain protein 4:a potential link between genome surveillance and apoptosis[J].Proc Natl Acad Sci USA,2003,100(9):5211-5216.
[8]Donner AJ,Szostek S,Hoover JM,et al.CDK8 is a stimulus-specific positive coregulator of p53 target genes[J].Molecular Cell,2007,27(1):121-133.
[9]Cortellino S,Turner D,Masciullo V,et al.The base excision repair enzyme MED 1 mediates DNA damage response to antitumor drugs and is associated with mismatch repair system integrity[J].Proc Natl Acad Sci USA,2003,100(25):15071-15076.
[10]Sansom OJ,Zabkiewicz JBishop SM,Bird A,et al.MBD4 deficiency reduces the apoptotic response to DNA-damaging agents in the murine small intestine[J].Oncogene,2003,22(46):7130-7136.
[11]Parsons BL.MED 1:a central molecule for maintenance of genome integrity and response to DNA damage[J].Proc Natl Acad Sci USA,2003,100(25):14601-14602.
[12]Turner DP,Cortellino S,Schupp JE,et al.The DNA N-glycosylase MED 1 exhibits preference for halogenated pyrimidines and is involved in the cytotoxicity of 5-iododeoxyuridine[J].Cancer Res,2006,66(15):7686-7693.
[13]Bader SA,Walker M,Harrison DJ.A human cancer-associated truncation of MBD4 causes dominant negative impairment of DNA repair in colon cancer cells[J].Br J Cancen,2007,96(4):660-666.
[14]Abdel-Rahnlan WM,Knuutila S,Peltomaki P,et al.Truncation of MBD4 predisposes to reciprocal chromosomal translocations and alters the response to therapeutic agents in colon cancer cells[J].DNA Repair,2008,7(2):321-328.
[15]Donner AJ,Szostek S JM,Espinosa JM.CDK8 is a stimulus-specific positive coregulator of p53 target genes[J].Molecular Cell,2007,27(1):121-133.
Expression of MBD4 protein and its clinical significance in endometrial adenocarcinoma*
LiuXiaoli,ShiXiaoyu,ChengGuoyan,QiLining,LiXuehui△
(DepartmentofObstetricsandGynecology,FirstHospital,HebeiMedicalUniversity,Shijiazhuang,Hebei050011,China)
ObjectiveTo study the expression and clinical significance of MBD4 protein in endometrial adenocarcinoma.MethodsThe MBD4 expression was examined by adopting the SP immunohistochemical method in 45 normal endometrial samples and 60 endometrial adenocarcinoma samples and to analyze its relationship with the clinical staging and pathologic grading.ResultsThe positive expression rate of MBD4 protein in normal endometrium was 60%,which was significantly higher than 25% in endometrial adenocarcinoma,indicating the decreasing trend,the difference was statistically significant(P<0.05).The MBD4 protein expression in endometrial adenocarcinoma had no obvious correlation with the clinical staging,pathologic stage,myometrium invasion depth and lymph node metastasis.ConclusionThe lack of MBD4 protein in endometrial adenocarcinoma may play a role in the occurrence and treatment of endometrial adenocarcinoma.
endometrial adenocarcinoma;MBD4 protein;gynecological tumors
10.3969/j.issn.1671-8348.2015.26.010
资助基金:河北省自然科学基金资助项目(H2012206040)。
:刘晓丽(1970-),本科,主治医师,主要从事临床妇产科工作。△
,E-mail:xzblxh@aliyun.com。
R711.32
A
1671-8348(2015)26-3631-03
2015-04-08
2015-06-14)
