一体化人工湿地微生物群落结构与分布特征
2015-01-05税永红蒲剑红
税永红,蒲剑红
(1.成都纺织高等专科学校,四川成都611731;2.四川大学建筑与环境学院,四川成都610041)
0 引言
湿地在维持生物多样性、促进区域生态与环境建设、保障城市的持续健康发展以及人与自然和谐共存等方面具有不可替代的作用,人工湿地因其成本低、处理效果好、管理运行简单等优点,被单独或与其他技术组合广泛用于校园生活污水、社区污水、奶产品加工废水、农业面源污染控制、工业废水、石油开采废水、养殖废水以及水体富营养化治理等领域[1-5]。目前,对于人工湿地的研究主要集中在人工湿地优化设计、出水水质的提高、营养盐的去除及在水、基质和植物之间的转化等方面[6-8],对湿地微生物特别是浮游生物的研究相对缺乏,而微生物又是湿地污水净化过程中重要的影响因子,它具有提高湿地的初级生产力、净化环境污染等不可替代的重要生态功能。
微生物主要指形体微小、单细胞或个体结构简单的多细胞、甚至无细胞结构,用肉眼看不见或看不清楚的低等生物的总称,一般需要借助显微镜来观察研究[9]。对湿地微生物的研究,大都集中在对于病原微生物的去除、湿地植物根系和湿地基质中微生物的群落结构、微生物种类和活性、微生物空间分布特点以及影响其分布因素的探讨及酶活性等的研究[10-13]。而对湿地中浮游藻类、原生及后生动物的研究几乎没有,对进入稳定运行期的人工湿地微生物群落结构及分布对人工湿地净化机理研究有着重要的指导意义。针对这种现状,本文利用我们自主构建的,具有自主知识产权的,已稳定运行二年的一体化人工湿地处理系统,于2012年4月~5月,观察人工湿地植物浮床生物膜区不同深度水层以及总出水中的微生物群落结构,分析了其在时空分布上的差异特征,并结合水质理化指标,进行相关分析。
传统显微镜观察可同时获得观测点浮游生物的种类组成和数量,但由于光学显微镜下进行的形态和生态特征研究主要为大于20um和3um的小型浮游生物(micro-phytoplankon)和微型浮游生物(nano-phytoplankon),因此,本研究所述浮游微生物不包括超微型浮游生物(pico-phytoplankon)。
1 材料和方法
1.1 试验装置
试验装置为安置于成都纺织高等专科学校实验楼顶楼且运行稳定的一体化人工湿地箱,由PVC塑料构成,其长×宽×高为2m×1m×1m,如图1所示。

图1 一体化人工湿地装置
一体化系统由三部分构成:
(1)一级处理系统:一级湿地含由泡沫构成的人工浮床,其上生长有植物三叶草,同时在水体中挂有由无纺布材质构成的生物膜载体,供微生物附着生长。
(2)主湿地区:湿地植物由芦苇、菖蒲、香蒲、水草四种构成,主要植物为芦苇和菖蒲。填料由粒径不同的卵石、碎石、碎砖、土组成,填料铺设高度为85cm。
(3)出水区:出水区生长有挺水植物睡莲,填料由细沙构成,填料高度为40cm,填料距水面高度约40cm。
1.2 试验污水及运行
试验污水来源于食堂及实验楼化粪池发黑发臭的混合污水(如图2)。系统采用间歇进水方式运行,每周300L污水以10~13L/h的流速24小时内全部进入湿地系统。

图2 人工湿地进水采集点
1.3 分析方法
试验微生物的群落结构分析方法采用显微镜镜检法。采样时间上午9:00~10:00间,在一级湿地的上、中、下层、人工生物膜以及出水共设5个采样点,采样方法如下:
一级处理系统:用碱式滴定管(去掉下面的橡胶管)分别在距水面20cm、45cm、60cm深处各采集水样100ml,每层布设8个采样点,然后混合各采样点的水样。
生物膜:用特定的刮片在选取的几片生物膜上刮取适量的附着物,然后用蒸馏水稀释至100ml,混匀。
出水:用上述碱式滴定管分别在出水区离水面10cm、20cm、30cm 深处采集水样共 100ml,每层水样采样点布设如上所述。
对每个样点采集的样品各取10ml(一个样点取两个样本水样)上清液,分别进行定性和半定量的镜检,其中半定量样品在获取后尽快加入福尔马林溶液进行固定,并借助血球计数板在显微镜下进行半定量观察,同时利用显微镜附带的成像功能对所观察到的微生物进行成像鉴定。
2 结果与分析
2.1 浮游藻类组成
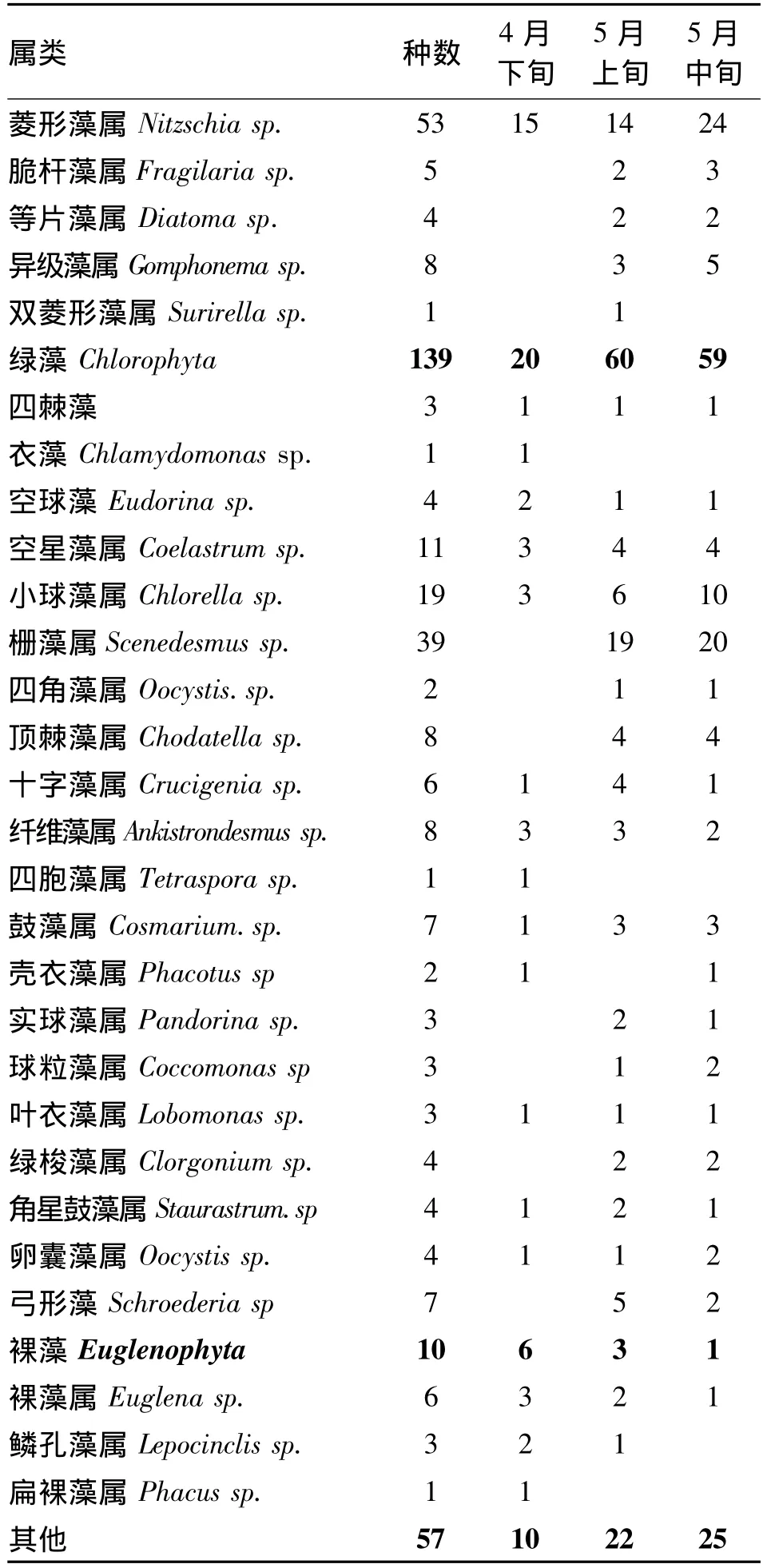
对一体化人工湿地微生物群落组成的观察集中在4月下旬到5月中旬,每旬对一级湿地和出水采集一次样品进行定性和半定量的观察,每个样品观察10个样片。表1列出了150个样片浮游藻类显微镜镜检结果。

表1 人工湿地浮游藻类的组成变化
(接上表)
4-5月镜检结果显示,150个样片中共检出浮游藻类4门34属以及其他藻57种共组成,这四门分别为蓝藻门、绿藻门、硅藻门、裸藻门。优势种群为绿藻和硅藻,占总计数藻类的42%和37%(图3)。
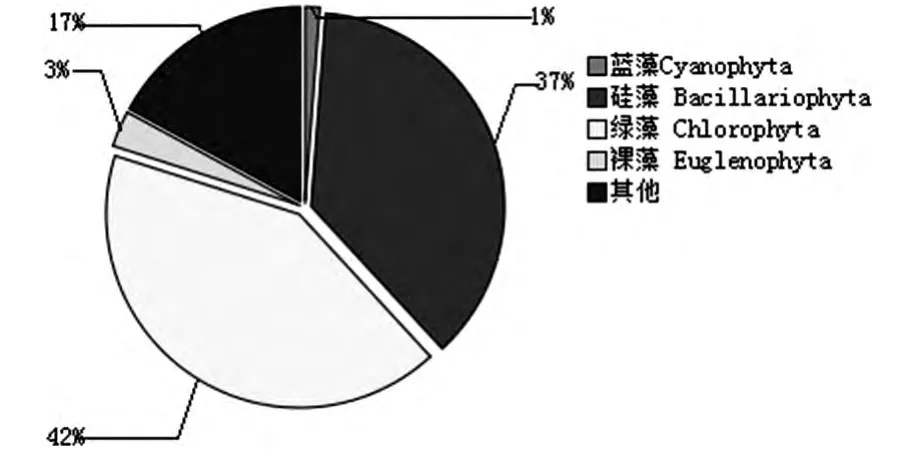
图3 人工湿地浮游生物组成
随着时间的推移,温度不断升高,藻的种类变化比较明显,湿地系统浮游藻类的种类也在增加,硅藻中的菱形藻、舟形藻、羽纹藻,绿藻中的栅藻、顶棘藻、四角藻种类较多。
2.2 浮游动物组成
人工湿地中除浮游藻类外,还观察到部分浮游动物,表2列出了浮游动物显微镜镜检结果。
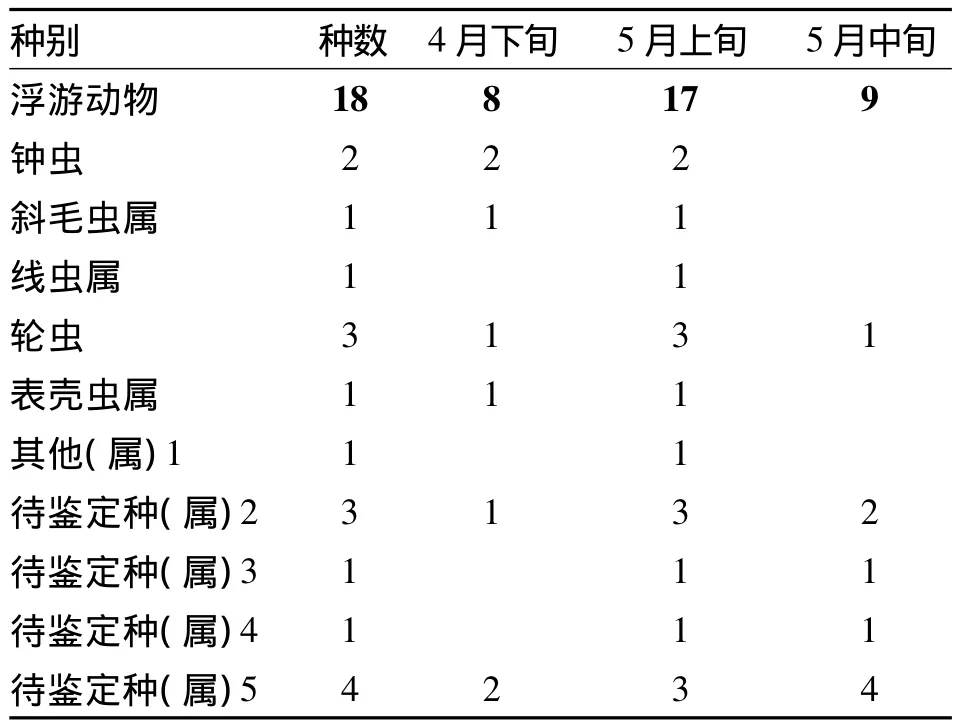
表2 人工湿地浮游动物组成
从表2可以看出湿地中浮游动物的种类不是很多,主要以游泳形纤毛虫为代表的原生动物为主,共计18种(属)。且其种随时间的变化规律不是很明显。
在显微镜下观察发现斜毛虫属和表壳虫属只在湿地一级处理系统上、中、下层发现,且下层最多,中层次之,上层最少,且其在显微镜下表现为畏光,当刚移动到视野中央,其很快就会运动到视野之外,说明这两种生物是不喜在强光照和较高温度下生存,这也就是为何从4月下旬到5月中旬随着温度的升高和光照的增强,最后在显微镜下观察不到这两种生物的原因了。
2.3 浮游藻类多样性变化
在采集样本进行微生物观察时发现湿地一级处理系统上、中、下三个水层采集的水样中下层水样颜色最深,呈明显的绿色;中层水样除含有一些悬浮物外几乎无色,上层水样除含较多悬浮物外,还呈明显的白色浑浊。在显微镜下观察发现一级处理系统下层水样藻类种类数最多,上层次之,中层最少,而生物膜上的藻种类最丰富。湿地总出水无色透明,在显微镜下观察到的藻种类和数量也相对较少,如图4所示。
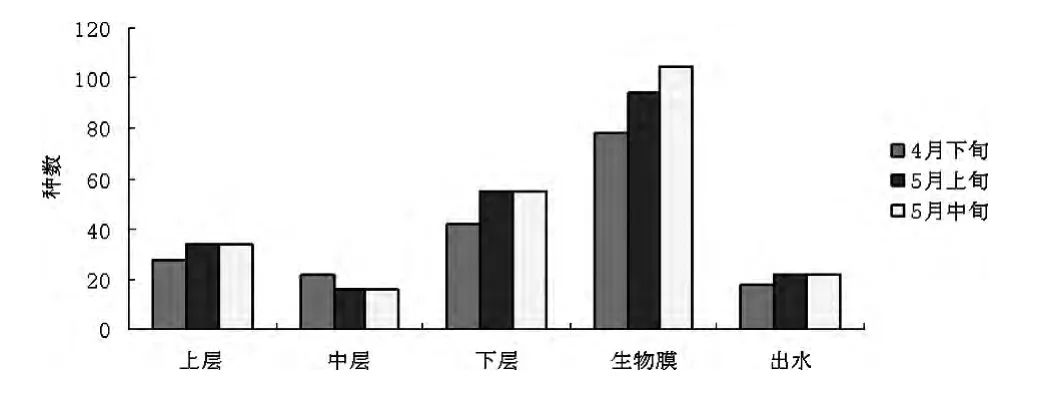
图4 各个取样点藻类的种类数的变化
从图4可以看出,一级系统分层采样及出水中浮游藻类以生物膜上种类最为丰富,数量最多,增长也最快,在一级系统上、中、下层水样中观察到的藻几乎都能在生物膜上观察到。而上、中、下层藻的主要属类差异不大。这是因为一级系统上、中、下层处于相似的环境,只是在种类和数量上,下层更丰富、上层次之,中层最少,而总出水藻的种类也相对较少。随着气温的升高,5月湿地处理系统浮游藻类种群总量达到较大值,由4月62种上升到130种以上(包括重复种计数),增长了近220%。其中,浮游藻类主要以硅藻门和绿藻门为主(图5)。
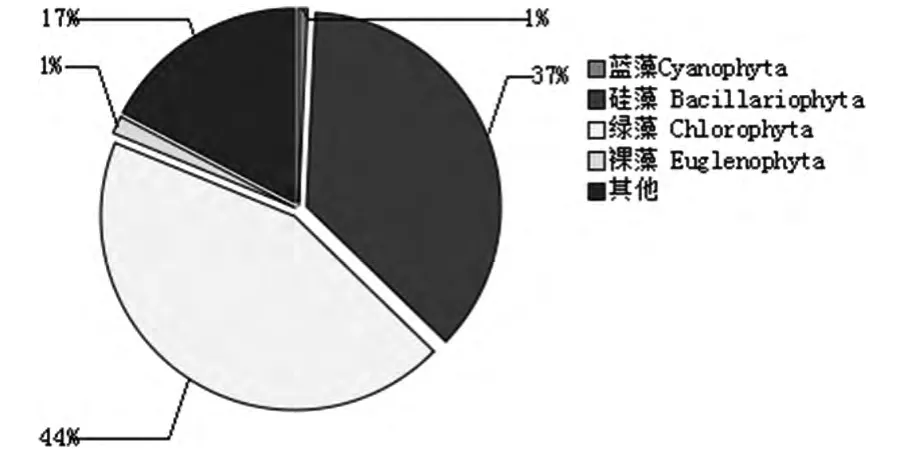
图5 5月人工湿地浮游生物组成
从图5可看出,5月浮游藻类中硅藻门藻类最多,占44%,其次是绿藻门藻类,占37%,硅藻门和绿藻门占观察到的浮游藻类的81%,且生物多样性丰富。
分析硅藻门及绿藻门中浮游藻类的组成,硅藻门中以菱形藻属最多,占硅藻门的38%,其次是舟形藻,占硅藻门的23%。绿藻门中的优势种为栅藻属占绿藻门33%。观察到的浮游藻类优势种群结构如图6和7所示。
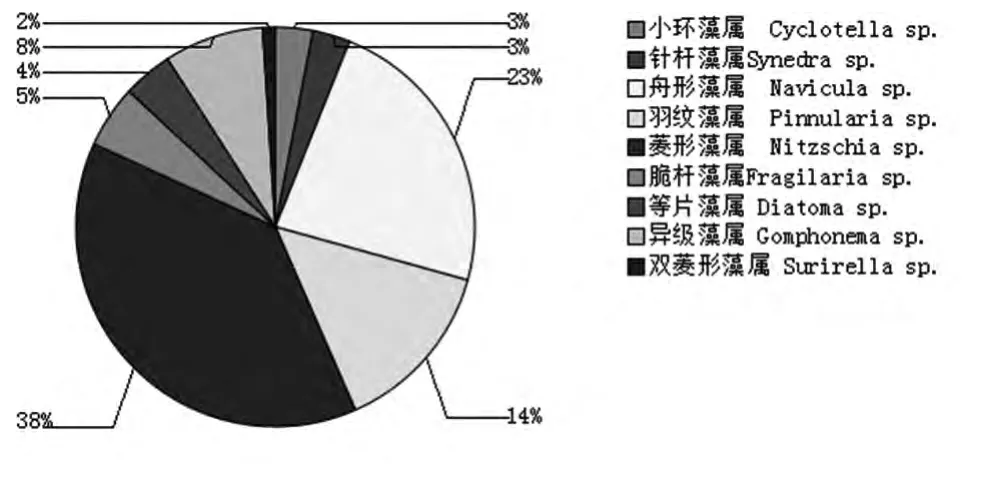
图6 硅藻门种属组成
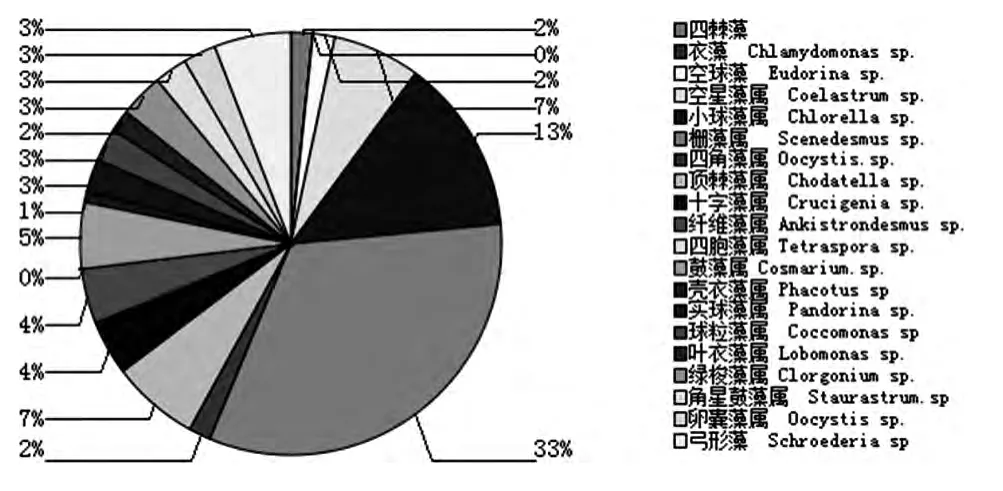
图7 绿藻门种属组成
2.4 与水质净化的关系
20世纪初德国学者B.科尔克维茨和M.马松提出指示生物的概念,水污染指示生物是在一定水质条件下生存,对水体环境质量的变化反应敏感而被用来监测和评价水体污染状况的水生生物。浮游生物、水生微型动物、大型底栖无脊椎动物、颤蚓、溞、摇蚊幼虫、硅藻、小球藻、栅藻、水生维管束植物等均可用来作为水污染的指示生物。利用指示生物可以对水体污染程度作出综合判断并进行定性分析。
水中浮游生物的藻类植物是有机物和氧气的重要来源。无论是在淡水,还是在海水中,藻类都是水生生态系统中生产者的重要成员。据估计,自然界光合作用制造的有机物中,有近一半是由藻类等微生物产生的,这些有机物作为浮游动物和高等水生动物的食料。水中浮游生物的原生动物及后生动物是水中微环境食物链的顶端,它们可以通过牧食对污水起到净化作用。
由于藻类对环境变化非常敏感或具有耐受力,人们根据水体中藻类的种类及数量变化,判断水质是否受到污染物及污染程度,从而在水体环境监测中起到指示作用,水体清洁状况与藻类的对应关系如表3。

表3 水体状况与藻类的对应关系
同时由于不同藻对污染物耐受性的不同,还可依据水体中存在的某些藻的种类和数量判定水体藻的污染程度。
从我们对5月上旬处理系统一级上、中、下三个水层及出水浮游生物的观察发现,观察到的优势种与水质有一定的相关性。5月上旬优势种藻及水质在湿地系统的空间分布如表4和5所示。
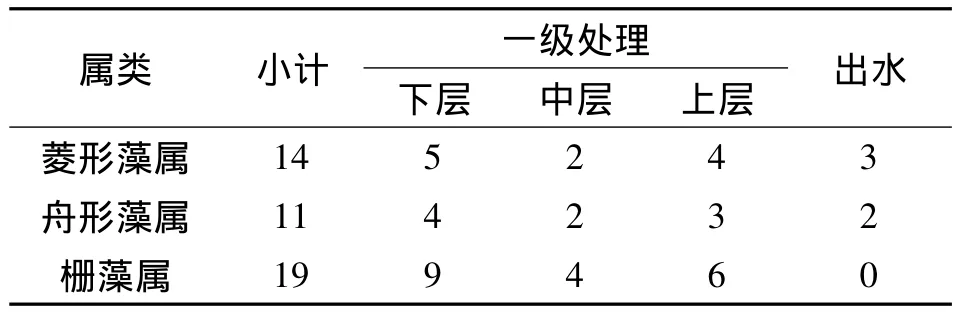
表4 5月上旬优势种藻在湿地系统的空间分布
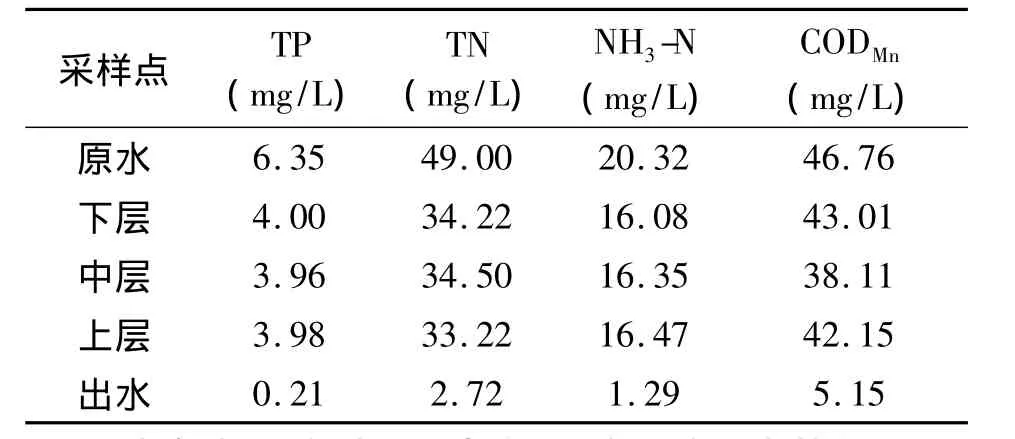
表5 5月上旬湿地系统的水质空间变化
结合表4和表5,我们可以看出,硅藻的二个优势种(菱形藻和舟形藻)在一级处理区上、中、下层和出水均有检出,且在一级处理区下层分布较多,这表明水质均受一定的污染,且一级处理区污染较严重,与水质监测结果是一致的。
同时,我们从上面二个表中还可以看出,绿藻优势种栅藻仅在一级处理区检出,出水中未检出,这表明在湿一级处理区的污染程度远远大于出水,这是由于栅藻在污水净化过程中,可为细菌提供氧以分解有机物并破坏其他有害物质,这也与我们水质监测结果相一致。
3 结论
通过镜检,4~5月湿地系统包含蓝藻、硅藻、绿藻和裸藻四门34属以及其他藻种(属)共332种,浮游动物及其它微生物共18种;随气温变暖上升,随着气温的升高,湿地处理系统浮游藻类种群更加丰富,较4月增长了近220%,浮游藻类主要以硅藻门和绿藻门为主,生物膜上藻的种类最丰富,包含了一级处理系统中上、中、下层所出现的藻类。
根据水体中浮游藻类优势种群在湿地空间变化与相应主要污染物的检测比对,硅藻优势种(菱形藻和舟形藻)及绿藻优势种栅藻的数量可以定性判断水质受污染的状况和相对洁净程度。
[1]Tamara Bianca Horn,Felipi Vargas Zerwes,Lourdes Teresinha Kist.et al.Constructed wetland and photocatalytic ozonation for university sewage treatment[J].Ecological Engineering,2014(63):134 -141.
[2]Kivaisi,A.K.The potential for constructed wetlands for wastewater treatment and reuse in developing countries:a review[J].Ecol.Eng,2001(16):545 – 560.
[3]陈长太,王雪,祈继英.国外人工湿地的应用及研究进展.中国给水排水,2003,19(12):105 -106.
[4]李娟,张龙庄,段亮,等.人工湿地废水处理技术的研究现状及展望[J].南方农业学报,2011,42(1):69-73.
[5]崔丽娟,张曼胤,李伟,等.人工湿地处理富营养化水体的效果研究.生态环境学报,2010,19(9):2142-2148.
[6]Ayaz,S.C.,Aktas,O.,Findik,N.,Akc,a,L.Phosphorus removal and effect of adsorbent type in a constructed wetland system[J].Desalination Water Treat,2012(37):152 –159.
[7]Grafias,P,Xekoukoulotakis,N.P.Mantzavinos,D.Diamadopoulos, E. Pilottreatmentofolivepomace leachate by vertical-flow constructed wetland and electrochemical oxidation:an efficient hybrid process[J].Water Res,2010(44):2773 –2780.
[8]Xiong,J,Guo,G,Mahmood,Q,Yue,M.Nitrogen removal from secondaryeffluent by using integrated constructed wetland system[J].Ecol.Eng,2011(37):659–662.
[9]周德庆.微生物学教程(第三版)[M].北京:高等教育出版社,2011.
[10]梁宁,王敦球,魏彩春.基于人工湿地系统中的微生物研究.环境科学与管理,2010,35(2):130 -133.
[11]吕明姬,汪杰,范铮,等.滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系[J].环境科学学报,2011,31(2):299 -306.
[12]周巧红,王亚芬,吴振斌.人工湿地系统中微生物的研究进展.环境科学与技术,2008,31(7):58-61.
[13]王青璐,彭明春,赵安娜,等.人工湿地中影响微生物空间分布因素的探讨.环境科学导刊,2009,28(2):1-3.
