酸碱滴定中指示剂浓度的影响
2015-01-05李莲云余惠娟尹华勤甘峰
李莲云 余惠娟 尹华勤 甘峰
(中山大学化学与化学工程学院 广东广州 510275)
酸碱滴定中指示剂浓度的影响
李莲云 余惠娟 尹华勤 甘峰
(中山大学化学与化学工程学院 广东广州 510275)
从理论计算和实验两方面对酸碱滴定指示剂浓度的影响进行讨论。通过酸碱滴定通式计算了溴百里酚蓝和酚酞在氢氧化钠滴定盐酸过程中pH的变化情况。结果表明指示剂的浓度过高或过低均不利于判定滴定终点。必须采用合适的指示剂浓度才能实现好的变色和好的准确度。
酸碱滴定 指示剂浓度 溴百里酚蓝 酚酞
在分析化学的理论和实验教学中,指示剂是一个重要的内容[1-3],但长期以来,指示剂对于滴定准确度的影响却并未得到准确的阐述。在教科书中,通常是以计算滴定误差的方式来揭示指示剂对于滴定分析准确度的影响,但是采用不同的计算方式(例如林邦公式)和判定的基准,对于计算结果本身的可信度会有很大的影响。我们在教学中常常会遇到学生提出如下两个问题: ① 既然酸碱滴定中所采用的指示剂是弱酸(或弱碱),它们在滴定过程中必然会参与到滴定过程中,这样是否会影响到滴定的准确度呢? ② 在实际的滴定过程中究竟应该加入多少指示剂?对于这两个问题,我们的答复通常是:当所加入指示剂的量适中时,不会对滴定的准确度产生影响。但是究竟要加入多少量的指示剂,我们并未给出准确的答案。很显然,从来也没有学生对我们的上述答复感到满意。在实际的实验过程中,学生也只是按照教科书上的说明滴加指示剂。
本文采用de Levie[4]的滴定通式来研究两种指示剂(溴百里酚蓝和酚酞)在NaOH滴定HCl过程中的表现。我们设定NaOH和HCl的浓度均为 0.1000 mol/L,此时化学计量点处的体积比将是V(NaOH)/V(HCl) =ρ= 1.000,且pH = 7.00。我们首先计算溴百里酚蓝(pKa为7.1,变色范围为pH6.0~7.6)在不同浓度情况下的滴定曲线;其次计算两种指示剂在ρ= 0.999~1.001(对应±0.1%的误差范围)范围的浓度变化情况;最后,我们将根据计算的结果设计实验,展示两种指示剂在对应pH下的变色情况。
1 指示剂浓度对滴定曲线的影响
为简便计,我们在此只展示溴百里酚蓝指示剂的计算结果。图1 所示为采用不同浓度的溴百里酚蓝指示剂时NaOH滴定HCl的滴定曲线,图中标出了体积比ρ= 1.000处的pH。图1的左上子图显示的是一个非常极端的情况,此时溴百里酚蓝指示剂的浓度达到0.1 mol/L,与HCl的浓度相同。这种情况在实际滴定过程中是不会出现的,但是利用这个图可以清晰地揭示出该指示剂对于整个滴定进程的真实影响。从这个图可以看到,由于溴百里酚蓝指示剂的存在,NaOH滴定HCl的突跃范围实际上已经显著减小了,而且化学计量点处的pH也显著小于7.0。在其他几个子图中,滴定的突跃范围其实也发生了改变,只是左上子图更为明显,但是总的结果均使得计量点处的pH小于7.0。这些结果表明,在溴百里酚蓝存在的情况下,不能简单地认为溴百里酚蓝只是一个“旁观者”。
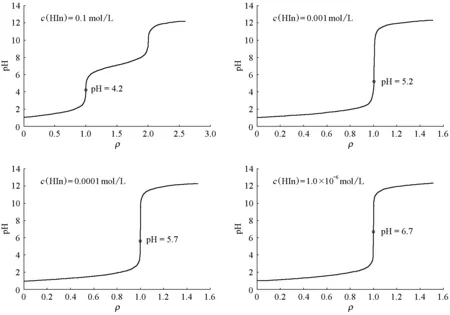
图1 以溴百里酚蓝为指示剂,用NaOH(0.1000 mol/L)滴定HCl(0.1000 mol/L)的滴定曲线
从图1的右下子图还可以看到,当溴百里酚蓝初始浓度小至1.0 × 10-6mol/L时,才有计量点处的pH = 6.7 > 6.0,即化学计量点在溴百里酚蓝的变色区间范围之内。从理论上说,只有在此情况下才可能观察到指示剂在化学计量点附近发生变色。但是,随之而来的一个问题是:在溴百里酚蓝的初始浓度小至1.0 × 10-6mol/L时,能够观察到它的颜色改变吗?须知, pH的范围决定了变色的可能性,而指示剂的碱式(或酸式)基团的浓度决定了人的眼睛能否看到它。因而,有必要对指示剂碱式(或酸式)基团的浓度变化情况进行研究。
2 两种指示剂碱式基团的浓度变化
指示剂的碱式基团的含量取决于溶液体系的pH,而体系的pH又与滴定的进程相关。我们设定的滴定进程范围是ρ= 0.999~1.001,这样可以保证滴定的误差不大于±0.1%。为此,我们将特别关注在ρ= 0.999,1.000和1.001处指示剂的碱式基团的浓度。
表1为溴百里酚蓝在不同初始浓度时其碱式基团的浓度。从中可以看出,当溴百里酚蓝初始浓度大于1.00 × 10-3mol/L时,体积比为ρ= 1.001处的pH = 6.16 < 7.10,因而无法达到颜色的显著改变。结合图1的右上图,此时如果要观察到蓝色的出现,必须继续滴定到更高的pH,这必然导致ρ> 1.001,最终超出允许的误差范围。当溴百里酚蓝的初始浓度小于10-4mol/L 数量级时,ρ= 1.001处的pH已经大于7.60,可以期望溴百里酚蓝会实现很好的颜色变化。然而,此时[In-] 在10-5mol/L或更小的数量级,如此低的浓度是否可以被肉眼敏锐地识别,尚需实验进行验证。

表1 溴百里酚蓝碱性基团的浓度
表2给出了基于5个不同的酚酞指示剂初始浓度计算的3种体积比,其变化规律与溴百里酚蓝指示剂类似,不在此做进一步的讨论。
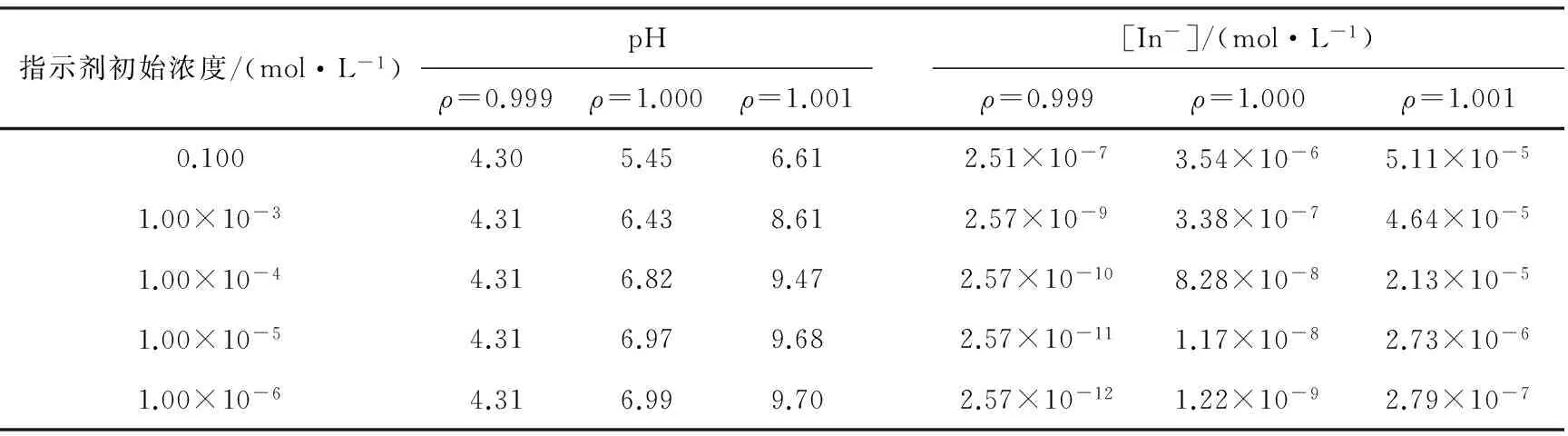
表2 酚酞碱性基团的浓度
3 两种指示剂在不同浓度和不同pH下的颜色比较
由于要精确控制滴定过程达到规定的pH有一定的难度,故不拟从滴定全过程去研究指示剂的变色情况,只通过缓冲溶液设定不同的pH,以此模拟滴定终点的情况。我们用磷酸二氢钠和磷酸氢二钠配制了不同pH的缓冲溶液。针对溴百里酚蓝指示剂,配置了pH为6.16, 8.39和9.70的缓冲溶液(pH 9.7的溶液是通过在缓冲溶液中加入少许NaOH调节的); 针对酚酞指示剂,配制了pH为8.61, 9.47和9.77的缓冲溶液。同时还配制了浓度为1.00×10-3,1.00×10-4,1.00×10-5和1.00×10-6mol/L的两种指示剂溶液。
实现滴定至ρ= 1.001处的方式是: 取3个试管,分别装入25 mL相同浓度的指示剂,并加入25.025 mL不同pH的缓冲溶液。结果表明,当溴百里酚蓝指示剂的浓度低于10-5mol/L数量级的时候,其颜色的改变不敏锐。尽管在此条件下的pH已经达到变色所需要的9.66以上,但是由于指示剂碱式 [In-] 的浓度在10-6mol/L数量级以下,颜色非常弱,已经很难通过肉眼发现颜色的锐变。另一方面,当溴百里酚蓝指示剂的浓度高至10-3mol/L数量级时,指示剂碱式 [In-] 的浓度较大,但是由于过高的酸度导致了ρ = 1.001处的pH = 6.16,仍然使得指示剂保持为黄色而不导致颜色的锐变。只有当溴百里酚蓝指示剂的浓度在10-4mol/L数量级时,才可以观察到指示剂明显地从黄色变为蓝色。此时溴百里酚蓝指示剂的浓度相当于待测HCl浓度的千分之一。当用酚酞作为指示剂进行滴定实验时,其结论与采用溴百里酚蓝指示剂时类似,这里不再做进一步的讨论。
这些理论和实验结果表明,过低浓度或过高浓度的指示剂用量均不利于指示剂正确地指示滴定终点,这对于纠正学生在实验中过量使用指示剂的错误行为是有指导意义的。这些结果也从理论和实验两方面揭示,在讨论酸碱滴定过程的时候,必须将指示剂的影响一并考虑进去,才能得出正确的结论。但是,这也会引入另外一个问题:在未知样品中,酸的浓度是未知的,应该如何使用指示剂的量呢?这是一个看似简单但又非常现实的问题,我们将此问题留给学生自己去思考。
[1] 甘峰.分析化学基础教程.北京:化学工业出版社,2007
[2] 武汉大学.分析化学.第5版.北京:高等教育出版社,2006
[3] Flowers P A.JChemEduc,1997,74:846
[4] De Levie R.AnalChem,1996,68:585
Influence of the Concentration of Indicator on Acid-base Titration
Li Lianyun Yu Huijuan Yin Huaqin Gan Feng*
(SchoolofChemistryandChemicalEngineering,SunYat-SenUniversity,Guangzhou510275,Guangdong,China)
Discussion on the influences of the indicators in acid-base titration had been made based on theoretical calculations and experiments. The pH changes using general expression of acid-base titration were calculated when bromothymol blue and phenolphthalein were used as the indictors in the titration of HCl with NaOH. The results showed that too high or low concentration of the indicators did not help identify the end point. A proper concentration of indicator is the guarantee of sensitive color change, and thus the accuracy of the titration.
Acid-base titration; Concentration of indicator; Bromothymol blue; Phenolphthalein
10.3866/pku.DXHX20150679
*通讯联系人:E-mail:cesgf@mail.sysu.edu.cn
O6; G64
