南海东北部浮游植物对氮、磷加富的响应及与不同水团的关系
2015-01-05李佳俊沈萍萍谭烨辉姜歆周林滨
李佳俊,沈萍萍,谭烨辉*,姜歆,周林滨
(1. 中国科学院 南海海洋研究所 海洋生物资源可持续利用重点实验室,广东 广州 510301; 2. 中国科学院大学,北京 100049; 3. 中国科学院 南海海洋研究所 广东省应用海洋生物学重点实验室,广东 广州 510301)
南海东北部浮游植物对氮、磷加富的响应及与不同水团的关系
李佳俊1,2,3,沈萍萍1,3,谭烨辉1,3*,姜歆1,2,3,周林滨1,3
(1. 中国科学院 南海海洋研究所 海洋生物资源可持续利用重点实验室,广东 广州 510301; 2. 中国科学院大学,北京 100049; 3. 中国科学院 南海海洋研究所 广东省应用海洋生物学重点实验室,广东 广州 510301)
2014年5月搭载“实验3”号科考船对南海东北部海区进行氮、磷营养盐现场加富培养实验。水团分析的结果表明,南海东北部海区的环境参数随着空间的变化大体可以分成3个区域:近岸海区、陆架海区和陆坡、海盆海区。加富培养过程中近岸海区和陆坡、海盆海区浮游植物未发生显著变化。陆架海区浮游植物出现显著增长,该海区浮游植物加富氮、磷以后在48 h出现反应,同时添加氮、磷显著促进了浮游植物的生长。各培养站位均检测到大量束毛藻,加富培养后迅速减少。营养盐的添加改变了海区浮游植物原有的硅甲藻比例与各粒级叶绿素比例,陆架海区培养后的改变最为明显,同时添加氮磷培养72 h后,由甲藻为主的优势种如卡氏前沟藻(Amphidiniumcarterae)、光亮鳍藻(Dinophysisargus)、原甲藻(Prorocentrumsp.)转变成了以硅藻为主如绕孢角毛藻(Chaetoceroscinctus)、旋链角毛藻(Chaetoceroscurvisetus)、放射角毛藻(Chaetocerosradicans)和丹麦细柱藻(Leptocylindrusdanicus)。同时,加富实验表明磷酸盐的添加促进了陆架海区微微型浮游植物聚球藻的生长。
南海东北部;浮游植物;营养盐加富;水团
1 引言
浮游植物是支撑海洋生态系统的基础,浮游植物的丰度、结构等特征与环境因子密不可分,同时浮游植物群落结构也一定程度反映了海洋生态环境。然而不同种类的浮游植物在不同的生活时期有着各自独特的营养需求,营养盐的浓度及其比例对浮游植物群落结构会产生调节作用。传统的观点认为湖泊、河口等区域受磷酸盐的限制而远海环境则受营养盐氮的限制[1—3]。目前增长评估法是研究浮游植物营养盐限制最常用有效的方法[4],而营养盐加富培养实验是该方法的主要研究手段[5—8]。
浮游植物按其粒径可分为小型(20~200 μm)、微型(2~20 μm)、微微型(0.7~2 μm)[9]。微微型浮游植物在贫营养的海洋环境中占相当大的比重,甚至达初级生产力的90%[10—12],可分为3个类群:聚球藻(Synechococcus)、原绿球藻(Prochlorococcus)、微微型真核浮游植物(Pico-eukaryotes)[13]。但是由于粒径较小等原因,以往对南海东北部微微型浮游植物营养元素关系的研究还很少[7,14]。因此,研究营养盐加富对南海东北部微微型浮游植物的影响具有十分重要的意义。
南海东北部存在季节性沿岸上升流,同时夏季珠江冲淡水的影响显著,从而导致夏季近岸海区具有营养盐高的特点[2,15];而该海区东部通过吕宋海峡与西太平洋连接,高温高盐贫营养的海水通过吕宋海峡进入南海东北部,同时海盆区中尺度涡旋出现频繁,从而形成了南海东北部既有低盐高营养的近岸海区,又有高盐营养盐相对较高的冷涡区以及高盐低营养的海盆区生态环境[16—17]。复杂的生态环境不仅造成了初级生产力分布的差异[18],同时形成了南海东北部浮游植物的群落结构。以往研究表明,南海东北部表层海水中聚球藻是分布最广泛、数量最多的微微型浮游生物,作为浮游植物生物量和初级生产力重要的贡献者,在微食物环中起着重要的作用[19—20]。原绿球藻分布范围不如聚球藻广,表层和沿岸水域分布非常少,主要分布于陆架混合水及黑潮水区域。束毛藻在西太平洋边界流的丰度很大[21],常常成为西太平洋入侵南海的指示性生物。南海东北部复杂的环境特征下,不同粒级结构、功能群及种类的浮游植物对黑潮入侵引起的营养盐输送会做出怎样的响应?我们还不清楚,而现场直接采样来研究这种响应,很难覆盖这一变动的整个过程和所有区域,因此本研究拟通过对不同区域营养盐现场加富,研究浮游植物对加富的响应,进而为预测黑潮入侵驱动的营养盐变化而导致群落结构的改变提供理论依据。
2 材料与方法
2.1 研究海域和采样分析方法
2014年5月7日至2014年5月26日,搭载中国科学院南海海洋研究所“实验3”号科考船,在南海东北部海域(20°~24°N,114°~121°E,图1)进行环境参数及浮游植物现场调查取样分析,并于典型站位(2、5、23、29、33、37号站)进行营养盐现场加富培养实验,调查获得样品包括分级叶绿素(Chla)即大型(Micro-)、微型(Nano-)、微微型(Pico-)叶绿素、营养盐、浮游植物、微微型浮游植物等,采样及进行加富培养实验的站位如图1所示。温度、盐度数据由温盐深测量仪CTD(Sea-Bird Electronics,Inc.)获取。海水的营养盐氮、磷用分光光度计测定,参照《海洋调查规范》(2007)进行。用孔径为20 μm、3 μm的聚碳酸酯滤膜和0.7 μm的玻璃纤维滤膜(GF/F)逐级过滤获取Chla样品,实验室处理后用Tunner-Design10荧光计测定Chla浓度[22]。浮游植物样品用Lugol’s 试剂固定,常温避光保存,航次结束后将样品静置24 h以上,用虹吸法去除上清液,浓缩样品,用倒置显微镜对浮游植物进行鉴定及计数[23]。微微型样品每个站位取3个平行样,加富实验取4个平行样,经甲醛(终浓度2%)固定后于液氮保存,采用BD Accuri C6流式细胞仪(488 nm)计数,通过ssc-fl3和fl2-fl3双参数图,区分并计数原绿球藻、聚球藻和微微型真核浮游植物3类微微型浮游植物[14]。

图1 南海东北部采样站位及培养实验分布(红色标记的站位为进行加富实验的站点)Fig.1 The sampling stations and incubation stations in the northeastern South China Sea(Map showing the nutrient entrichment stations with red dot)
所有的生物参数和环境参数预处理后,做生物量与相关环境因子之间的Pearson相关分析,通过方差分析计算不同处理组间差异的显著性,以上分析在SPSS 20.0软件中进行。

表1 现场加富实验无机营养盐加入浓度[7—8]Tab.1 The design of experimental groups
2.2 营养盐现场加富实验
实验海区:为研究南海东北部黑潮影响海区及其他典型海区的营养盐限制与浮游植物对加富的响应,通过历史数据温盐水团分析,在不同区域,选择了3个代表性区域进行加富:南海东北部近岸海区(2、5号站),南海陆架海区(23、29号站),吕宋口黑潮入侵影响区域(33、37号站)。海区水团分析的T-S曲线及温、盐、营养盐的分布图见图2、3所示。

图2 南海东北部海区T-S分布Fig.2 T-S diagram of northeastern South China Sea

图3 南海东北部海区温度、盐度、磷酸盐、硝酸盐的平面分布Fig.3 Surface distributions of temperature, salinity and nutrients in northeastern South China Sea
实验方法:现场培养实验采用2 L聚乙烯培养瓶(Nalgene)培养,培养瓶用稀盐酸浸泡24 h后纯水洗净,用前用现场培养海水润洗。取表层海水50 L用200 μm的筛网过滤后分装到16个培养瓶中。其中5、23号站使用8个培养瓶,每次取样时使用一瓶取叶绿素微微型等样品。培养瓶置于水槽内,用流动海水浴保持培养介质的温度与现场海水温度接近。培养以自然日光光照,每天摇动培养瓶3~4次以保持气体溶解量防止生物聚集。
实验设计:实验共包括4组,实验方案如表1所示:A 空白对照组,B 添加硝酸盐组,C 添加磷酸盐组,D 同时添加氮磷组。每12 h或24 h取一次水样,持续取样24~72 h。本次加富实验中,加富培养的时间控制在24~72 h,其中陆架中部海区的站位(23、29号站)培养72 h,对于初始状态浮游植物较丰富的近岸海区(2、5号站)培养24 h,对营养盐含量极低且浮游植物含量极少的海盆区站位(33、37号站)培养48 h。水样测定的参数包括:Chla浓度、营养盐(硝酸盐、磷酸盐)浓度、微型浮游植物种类及丰度、微微型浮游植物、粒度分级Chla浓度。其中5号站培养前浮游植物种类样品不慎遗失。
3 结果
3.1 Chl a对营养盐加富实验的响应结果
本研究在各典型海区进行现场氮、磷加富培养,加富前站位初始生态参数如表2所示,其中,2、5号站
营养盐含量较高,37号站位无机氮含量较高,其他站位表层海水中营养盐的含量都非常低。近岸的站位(2、5号站)Chla浓度最高,其次是陆架上的站位(23、29号站),靠近吕宋海峡附近的海盆站位(33、37号站)最低。

表2 加富站位生态参数初始值(温度、盐度、无机氮、磷酸盐、Chl a)Tab.2 surface water temperature,salinity,nutrients and Chl a of incubation stations
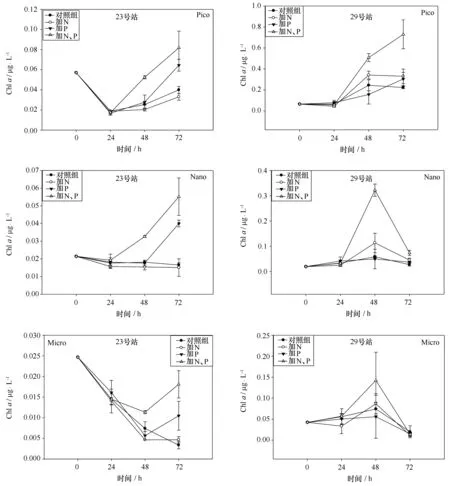
图5 23、29号站加富培养实验分级Chl a的变化Fig.5 Variation of size-fractionated Chl a in station 23 and station 29
添加营养盐后各站位总叶绿素的变化趋势各不相同,如图4其中近岸海区培养24 h内和海盆海区培养48 h内Chla均未增长,但陆架海区站位48 h后总叶绿素出现增长,且同时添加氮磷组显著高于对照组(P<0.01),不同的是29号站48 h后加氮组和同时添加氮磷组Chla均出现增长(P<0.01),而23号站48 h仅同时添加氮磷组Chla出现增长(P<0.01),72 h后添加磷酸盐组和同时添加氮磷组Chla同时增长,培养结束时仅同时添加氮磷组相对于初始状态显著增长(P<0.01)。
分级Chla的变化趋势与总叶绿素的结果大体一致,仅陆架海区发生显著的变化,23、29号站分级叶绿素变化的结果如图5所示,结果显示Nano级和Pico级Chla显著变化且趋势与总Chla相近,24 h两个站的Nano级和Pico级Chla都出现了减少或停滞,48 h后开始出现增长,除29号站Nano级Chla外72 h两级浮游植物Chla继续增长。Micro级Chla含量的变化趋势不同于总Chla,各加富站位均表现出降低趋势,23号站加富实验的结果显示加富72 h内各组Micro级Chla均未超过加富前,但同时添加氮磷组72 h后显著高于控制组和加氮组。29号站Micro级Chla48 h出现增长,各组均无显著差异,加富72 h后含量与加富前无显著差异。
3.2 浮游植物种类和丰度对营养盐加富的响应结果
分析浮游植物种类和丰度的变化(见图6),加富培养前,除29号站细胞数量较高外(1.53×103cell/L),其他加富站位浮游植物细胞数量相当,在0.45~0.69×103cell/L之间。各加富站位初始浮游植物组成差别较大,束毛藻在各个培养站位均被检出,数量较多为各站位的优势种群,极大的数量加上簇状生长的特性造成显微镜检时未准确计数。束毛藻主要为红海束毛藻(Trichodesmiumerythraeum)和铁氏束毛藻(T.thiebautii)。虽然未准确计数,但是可以发现陆架和海盆站位束毛藻的数量很高且明显高于近岸站位,种类组成既含有红海束毛藻又有铁氏束毛藻,近岸站位仅检测到红海束毛藻。加富培养后束毛藻的数量均显著减少,其中陆架海区的23、29号站培养72 h后仅有少量的束毛藻检出,海盆区站位加富培养24 h后束毛藻数量相对减少。

图6 加富培养实验前后浮游植物的生物量及比例Fig.6 Variation of phytoplankton abundance and species composition in different treatments before and after nutrient addition bioassay
受冲淡水影响的2号站浮游植物优势种有柔弱根管藻(Rhizosoleniadelicatula)、微小甲藻(Dinophytaspp.)和环沟藻(Gyrodiniumsp.)。陆架坡33号浮游植物优势种有光亮鳍藻(Dinophysisargus)、齿状原甲藻(Prorocentrumdentatum)、相关亚历山大藻(Alexandriumaffine)和角毛藻(Chaetocerossp.)。海盆区37号站位浮游植物优势种有卡氏前沟藻(Amphidiniumcarterae)、圆筛藻(Coscinodiscussp.)、多米尼环沟藻(Gyrodiniumdominans)、环沟藻(Gyrodiniumsp.)、海洋原甲藻(Prorocentrummicans)和微小甲藻(Dinophytaspp.)。加富培养前后近岸和海盆区的浮游植物优势种变化不大。
台湾南部陆架23号站浮游植物优势种有卡氏前沟藻(Amphidiniumcarterae)、光亮鳍藻(Dinophysisargus)、旋链角毛藻(Chaetoceroscurvisetus)、原甲藻(Prorocentrumsp.)。29号站浮游植物优势种有平滑角毛藻(Chaetoceroslaevis)、螺旋环沟藻(Gyrodiniumspirale)、扁豆原甲藻(Prorocentrumlenticulatum)和锥状斯氏藻(Scrippsiellatrochoidea)。23号站添加磷酸盐组和同时添加氮磷组培养后硅藻所占比例远高于甲藻,相对于初始状态主要优势种由甲藻变为硅藻为主,除了培养前的旋链角毛藻(Chaetoceroscurvisetus)继续为优势种外,还增加了绕孢角毛藻(Chaetoceroscinctus)、根状角毛藻(Chaetocerosradicans)和丹麦细柱藻(Leptocylindrusdanicus)。29号站同时添加氮磷组的生物量显著高于其他各组,浮游植物的种类组成发生了明显变化,主要优势种也由甲藻转变为硅藻,如绕孢角毛藻(Chaetoceroscinctus)和根状角毛藻(Chaetocerosradicans)。
培养前后浮游植物总量及硅藻、甲藻的组成变化见图6,同时添加氮磷组的浮游植物培养后细胞数量显著高于培养前。营养盐的添加改变了各实验组中硅藻和甲藻的相对比例,其中近岸和海盆海区添加磷酸盐组和同时添加氮磷组培养后硅藻比例出现不同程度的增长,陆架区域的23号站和29号站变化最为显著,相对于添加磷酸盐组同时添加氮磷组中硅藻比例占绝对优势,说明营养盐的添加对南海北部陆架以内海域的微小型种群结构改变最大。
3.3 聚球藻对营养盐加富的响应结果
Pico级Chla是南海东北部Chla中最重要的组成部分,但是加富前后三级Chla的比例也发生了很大变化,本次研究调查海区中Pico级Chla贡献了总Chla的60.1%,而2013年11月份在相同区域的调查这一比例达67%(未发表)。在本研究调查的海域,2013年11月和2014年5月两个航次的调查中表层海水中原绿球藻都较少出现,其丰度的垂向最大值位于真光层底部附近。陆架海区加富培养站位培养过程中聚球藻发生显著增长:23站培养实验的结果显示在无机营养盐磷和同时添加氮、磷的实验组中,聚球藻48 h后生物量显著高于其他实验组,72 h后单独加磷组聚球藻的数量占同时添加氮磷组聚球藻生物量的79.05%。29站培养实验的结果同样显示在无机营养盐磷和同时添加氮磷的实验组中,聚球藻的增长显著高于其他各实验组,各实验组聚球藻数目24 h后基本持平,24 h至48 h各组均增长且加富磷酸盐组和同时添加氮、磷组明显高于其他组。聚球藻峰值出现于加富磷酸盐组48 h后,达(70.4±6.1) μL-1,48 h至72 h加富组聚球藻数目均减少。位于近岸的2、5号站,海盆区的33、37号站添加无机营养盐培养的过程中,各实验组聚球藻数量并没有出现显著性变化。
4 讨论
4.1 不同水团影响区Chla粒级结构对营养盐加富的响应
Chla在近岸和海盆区域的加富培养过程中未出现增长,部分站位甚至出现了下降,近岸海区(2、5号站)可能是由于本身营养盐含量比较充足,进行培养时浮游植物已经到达生长的衰退期或培养时间比较短浮游植物对短期大量的氮、磷输入未能作出快速反应;而海盆区(33、37号站)则是由于加富营养盐后束毛藻迅速减少且Chla本身的含量也极低。
陆架海区加富后Chla变化最明显,该区域相对于海盆区受到珠江等陆源冲淡水的影响大,同时受到太平洋贫营养化海水的影响较小,生态环境较稳定培养时间相对较长等原因造成了该区域加富后浮游植物明显的变化。其中23号站位于台湾岛西南,太平洋水通过吕宋海峡进入南海东北部,高氮磷比的深层海水可能爬升至台湾该区域。Chla对于南海营养盐加富的响应,一般的结果认为珠江口等沿岸海域受到磷限制,随着盐度的增加逐渐转变为氮磷共同限制,开阔海区则受到氮限制。Wu等2003年在南海北部的研究则认为,浮游植物仅受到N限制[24]。但是共同限制的观点逐渐被证实[25—26],也有相关的研究结果[27]显示营养盐加富后,Chla仅在同时添加氮磷的情况下显著增长,但是他们多只考虑Nano级浮游植物或者总Chla,并没有考虑不同粒级的浮游植物的限制作用。位于陆架区域的23、29号站Chla的响应结果显示,29号站仅在氮磷同时添加的情况下,Chla在48 h显著高于其他各组而23号站培养72 h时除了同时添加氮磷组外添加磷酸盐组同样促进了叶绿素尤其是Nano级和Pico级叶绿素的增长。对于陆架海区浮游植物培养后相对于初始状态仅在同时添加氮磷的情况下显著增长的解释是加磷适合固氮Pico级聚球藻的生长,但是加富前聚球藻对生物量的贡献的少,而单一添加氮不适合甲藻、硅藻和蓝藻的生长,同时单一添加某种营养盐引起了氮磷比相对Redfield比的严重失衡也可能导致浮游植物未能快速增长。而硅藻对氮磷的利用要快于其他类群,所以加富后硅藻成为优势类群。与29号站不同的是23号站Nano级浮游植物对磷酸盐响应明显,可能是太平洋水进入南海东北部促使深层高氮磷比的海水爬升至该区域造成的。另外,硝酸盐添加组的Chla高于磷酸盐添加组和空白组,但是增长的程度有限,本次加富实验添加的是硝酸盐而不是氨氮,很多浮游植物特别是Pico级生物对氨氮添加的反应更为显著,这也可能影响氮限制的显著性。48 h以后29站对照组和单独添加氮磷组的Chla相对初始状态有所增长,可能是由于培养的表层海水培养前通过了200 μm筛网的过滤,在瓶子中培养时较小的摄食压力和“瓶子效应”造成的。
通过比较南海东北部贫营养海区各个加富实验Chla变化的时间发现,该海区Chla对于营养盐的响应时间在48 h以后,且陆架海区要快于海盆区域。对于大量的营养盐输入,浮游植物相对较丰富近岸站位也不能快速响应。Chla的增长需要浮游植物细胞内有机物质含量的积累,这一过程需要较长的时间,因此添加营养盐初期浮游植物Chla增长停滞甚至减少。贫营养化的南海东北部海区浮游植物的主要组成是Nano级浮游植物和Pico级浮游植物,两级浮游植物对营养盐加富的响应趋势与总Chla的变化相近,较小的粒径有利于高效吸收利用营养盐也使得其Chla更快的响应。
以上各站位进行的加富培养实验,添加磷酸盐的各组初始状态时磷酸盐的加富量为2 μmol/L,处于充分过量状态。分析磷酸盐的含量变化发现,在添加磷酸盐组和氮磷组中磷酸盐含量24 h后快速下降,之后基本处于稳定。Kuenzler提出了藻类对营养盐的“奢侈消费”能力[28],即发生这种现象可能是长期处于寡营养盐状态下的浮游植物在磷酸盐添加下,快速吸收储存并慢慢利用,处于寡营养环境的藻类往往都具有这种适应机制[29]。
4.2 营养盐加富对浮游植物种类和丰度的影响及与水团的关系
分析各加富实验站位的浮游植物种类变化(见图5)发现,甲藻在高温、贫营养的南海东北部海区比硅藻更易于生存,各培养站位加富前硅甲藻的丰度比均小于1。除29号站外其余各站添加硝酸盐组的甲藻比例均有所增长。而5个站位添加磷酸盐组和同时添加氮磷组硅藻相对于初始状态比例有所增长,同时添加氮磷组这一趋势表现的更为明显。营养高的情况下,硅藻对营养盐吸收快会优先生长,而甲藻有储备磷的能力,即先储备后在营养盐较低的情况下利用。近岸海区受陆源径流的影响营养盐含量高,陆源输入的氮源要高于磷,使得近岸海区浮游植物对磷的响应更加明显。陆架海区加富培养72 h后,同时添加氮磷组的丰度和结构变化最显著,培养过程中浮游植物可能首先经历氮限制然后氮磷共同限制[30]。海盆站位(33、37号站)加富前组成丰度相似,增长加富培养时间(33号站)浮游植物的丰度增加,浮游植物对磷酸盐的响应均更加明显,相关的研究指出束毛藻发生赤潮时会引起区域无机氮、有机氮含量快速增加,束毛藻群落为甲藻、硅藻提供了较好的生长环境并为其他提供氮营养源[31],这在一定程度上解释了培养实验中海盆站位浮游植物生物量对磷酸盐响应更加明显,同时也解释了该区域无机氮含量的异常高值。浮游植物种类和丰度的鉴定在显微镜下进行,然而显微镜无法观测到微微型及部分微型个体。故显微镜观察到的浮游植物细胞丰度的增加或减少并不一定对应Chla的增加或减少。
束毛藻广泛的分布于大洋暖水区[32]。台湾岛以东海区束毛藻种群主要由红海束毛藻、铁氏束毛藻、汉氏束毛藻组成,其中铁氏束毛藻分布最为普遍、丰度最高且在吕宋海峡处密集分布[33]。台湾岛以东束毛藻的种群组成与分布在一定程度上解释了23、37号站束毛藻的来源。吕宋海峡南部该季节常年存在暖涡加之太平洋水入侵可能将丰富的束毛藻带到了南海东北部[34]。束毛藻对生活环境的要求非常苛刻、感应非常敏感,而进行加富培养的环境可能达不到束毛藻生活的条件使其加富后迅速死亡。
4.3 不同水团营养区聚球藻对营养盐加富的响应
分析聚球藻对营养盐加富的响应结果(图7),聚球藻细胞数量的变化与总Chla的变化一致。聚球藻数量在近岸高但比例低,而在大洋则比例高,聚球藻在进行加富实验的近岸站位各实验组48 h内未发生显著增长。吕宋海峡附近海盆站位可能存在太平洋水入侵,初始状态叶绿素生物量极低且以聚球藻为主,加富培养48 h未出现显著增长。在远洋陆架站位进行高浓度营养盐添加的环境下,48 h以后才出现数量增长,加磷组和同时添加氮磷组聚球藻数量显著高于其他各组。磷酸盐是驱动聚球藻增长的主要影响因子。一方面由于贫营养化的南海东北部的聚球藻本身具有固氮作用[35],另一方面由于聚球藻个体极小可以高效竞争利用贫营养化海水中的生源要素,南海广泛存在的束毛藻为其提供了生长所需的氮,从聚球藻的生长受到磷酸盐的限制来看,对于研究海区浮游植物的营养盐限制应当分粒级来认识。原绿球藻不能利用硝态氮以及对光照的敏感性等原因使得加富无机营养盐组中未出现原绿球藻丰度的显著提高[36]。尽管微微型生物量的变化与总Chla的变化相一致,但总Chla的增长并不是由微微型浮游植物生物量的增长决定的,如29号站培养实验相对应的Chla的变化主要原因是同时添加氮磷的条件下Nano级Chla生物的生长。

图7 23、29号站加富培养实验聚球藻生物量随时间的变化Fig.7 Temporal variation of abundances of Synechococ-cus in different treatments of nutrient addition
5 小结
(1)根据温度、盐度的分布趋势及水团分析的结果可以将南海东北部海区分成3个典型区域:近岸海区、陆架海区和陆坡海盆海区。
(2)陆架海区培养48 h后出现增加,且表现出了显著的氮磷共同促进,异于传统认识的远海浮游植物受氮限制的观点。同时总Chla对营养盐加富的响应基本和Pico和Nano级Chla的响应一致,该海区营养盐添加72 h内Micro级Chla的变化各实验组均不显著。
(3)营养盐的添加培养改变了各海区原有的种群结构,硅藻和甲藻的比例及组成。各海区初始的生态参数不同、群落结构不同对营养盐的加富响应的程度、快慢也不同。同时添加氮磷组培养的浮游植物响应显著异于其他各组,陆架海区的培养结果最具代表性,靠近吕宋海峡的海盆区表层海水中观测到大量束毛藻,主要是红海束毛藻和铁氏束毛藻,束毛藻的存在为其他浮游植物提供了一定的氮源。
(4)对于南海东北部贫营养化海区浮游植物的营养盐限制不能简单的认为是氮限制或氮磷共同限制,对于不同粒径的浮游植物应有不同的认识,南海东北部表层海水中聚球藻是丰度最高的微微型浮游生物,微微型浮游植物聚球藻由于本身的固氮作用等原因表现出对磷酸盐明显的响应。
致谢:感谢“实验3”号全体成员给予的支持。感谢林秋艳老师在浮游植物鉴定方面给予的帮助。
[1] Satoh Y,Katano T,Satoh T,et al. Nutrient limitation of the primary production of phytoplankton in Lake Baikal[J]. Limnology,2006,7(3): 225-229.
[2] Yin Kedong,Qian Peiyuan,Wu M C S,et al. Shift from P to N limitation of phytoplankton growth across the Pearl River estuarine plume during summer[J]. Marine Ecology Progress Series,2001,221: 17-28.
[3] 王昭玉. 叶绿素荧光参数对氮、磷限制的响应及其在赤潮生消过程中的变化特征研究[D]. 青岛: 中国海洋大学,2013.
Wang Zhaoyu. Responses of Chlorophyllafluorescence parameter to nitrogen or phosphorus limitation and the variation of Chlorophyllafluorescence parameter during the process of algal blooms[D]. Qingdao: Ocean University of China,2013.
[4] Beardall J,Young E,Roberts S. Approaches for determining phytoplankton nutrient limitation[J]. Aquat Sci,2001,63(1): 44-69.
[5] Olli K,Heiskanen A S,Seppälä J. Development and fate ofEutreptiellagymnasticabloom in nutrient-enriched enclosures in the coastal Baltic Sea[J]. Journal of Plankton Research,1996,18(9): 1587-1604.
[6] 王玉珏,洪华生,王大志,等. 台湾海峡上升流区浮游植物对营养盐添加的响应[J]. 生态学报,2008,28(3): 1321-1327.
Wang Yujue,Hong Huasheng,Wang Dazhi,et al. Response of phytoplankton to nutrients addition in the upwelling regions of the Taiwan Strait[J]. Acta Ecologica Sinica,2008,28(3): 1321-1327.
[7] 方涛,李道季,余立华,等. 光照和营养盐磷对微型及微微型浮游植物生长的影响[J]. 生态学报,2006,26(9): 2783-2790.
Fang Tao,Li Daoji,Yu Lihua,et al. Effect of irradiance and phosphate on growth of nanophytoplankton and picophytoplankton[J]. Acta Ecologica Sinica,2006,26(9): 2783-2790.
[8] 朱艾嘉,黄良民,许战洲. 氮、磷对大亚湾大鹏澳海区浮游植物群落的影响 Ⅰ.叶绿素a与初级生产力[J]. 热带海洋学报,2008,27(1): 38-45.
Zhu Aijia,Huang Liangmin,Xu Zhanzhou. Impacts of nitrogen and phosphorus on phytoplankton community structure in Dapeng’ao area of Daya Bay Ⅰ. Chlorophyllaand primary productivity[J]. Journal of Tropical Oceanography,2008,27(1): 38-45.
[9] Wang Haili,Huang Bangqin,Hong Huasheng. Size-fractionated productivity and nutrient dynamics of phytoplankton in subtropical coastal environments[J]. Hydrobiologia,1997,352(1/3): 97-106.
[10] Murphy L S,Haugen E M. The distribution and abundance of phototrophic ultraplankton in the North Atlantic[J]. Limnol Oceanogr,1985,30(1): 47-58.
[11] Uysal Z. Pigments,size and distribution ofSynechococcusspp. in the Black Sea[J]. J Mar Syst,2000,24(3/4): 313-326.
[12] Lebouteiller A L,Blanchot J,Rodier M. Size distribution patterns of phytoplankton in the western Pacific: towards a generalization for the tropical open ocean[J]. Deep-Sea Research Part A. Oceanographic Research Papers,1992,39(5): 805-823.
[13] 焦念志. 海洋微型生物生态学[M]. 北京: 科学出版社,2006.
Jiao Nianzhi. Marine Microbial Ecology[M]. Beijing: Science Press,2006.
[14] Chen Bingzhang,Wang Lei,Song Shuqun,et al. Comparisons of picophytoplankton abundance,size,and fluorescence between summer and winter in northern South China Sea[J]. Continental Shelf Research,2011,31(14): 1527-1540.
[15] Xie Shangping,Xie Qiang,Wang Dongxiao,et al. Summer upwelling in the South China Sea and its role in regional climate variations[J]. J Geophys Res-Oceans,2003,108(C8): 3261.
[16] Caruso M J,Beardsley R C,Gawarkiewicz G G. Interannual variability of the Kuroshio intrusion in the South China Sea[J]. Gayana,2004,68(2): 91-95.
[17] Centurioni L R,Niiler P P,Lee D K. Observations of inflow of Philippine Sea surface water into the South China Sea through the Luzon Strait[J]. Journal of Physical Oceanography,2004,34(1): 113-121.
[18] Chen Y F L. Spatial and seasonal variations of nitrate-based new production and primary production in the South China Sea[J]. Deep-Sea Research Part Ⅰ: Oceanographic Research Papers,2005,52(2): 319-340.
[19] Burkill P H,Leakey R J G,Owens N J P,et al.Synechococcusand its importance to the microbial foodweb of the northwestern Indian Ocean[J]. Deep-Sea Research Part Ⅱ: Topical Studies in Oceanography,1993,40(3): 773-782.
[20] Moisan T A,Blattner K L,Makinen C P. Influences of temperature and nutrients onSynechococcusabundance and biomass in the southern Mid-Atlantic Bight[J]. Continental Shelf Research,2010,30(12): 1275-1282.
[21] Capone D G,Zehr J P,Paerl H W,et al.Trichodesmium,a globally significant marine cyanobacterium[J]. Science,1997,276(5316): 1221-1229.
[22] Parsons T R,Maita Y,Lalli C M. A Manual of Chemical and Biological Methods for Sea Water Analysis[M]. New York: Pergamon Press,1984.
[23] Utermöhl H. Zur vervollkommnung der quantitativen phytoplankton-methodik[J]. Mitt int Ver Theor Angew Limnol,1958,9: 1-38.
[24] Wu Jingfeng,Chung S W,Wen L S,et al. Dissolved inorganic phosphorus,dissolved iron,andTrichodesmiumin the oligotrophic South China Sea[J]. Global Biogeochemical Cycles,2003,17(1): 8-1-8-10.
[25] 胡俊,柳欣,张钒,等. 台湾海峡浮游植物生长的营养盐限制研究[J]. 台湾海峡,2008,27(4): 452-458.
Hu Jun,Liu Xin,Zhang Fan,et al. Study on nutrient limitation of phytoplankton in southern Taiwan Strait during the summer[J]. Journal of Oceanography in Taiwan Strait,2008,27(4): 452-458.
[26] 袁梁英. 南海北部营养盐结构特征[D]. 厦门: 厦门大学,2005.
Yuan Liangying. Distribution and characteristics of nutrients in the northern South China Sea[D]. Xiamen: Xiamen University,2005.
[27] Saito M A,Goepfert T J,Ritt J T. Some thoughts on the concept of colimitation: three definitions and the importance of bioavailability[J]. Limnol Oceanogr,2008,53(1): 276-290.
[28] Kuenzler E J,Ketchum B H. Rate of phosphorus uptake by Phaeodactylum tricornutum[J]. Biol Bull,1962,123(1): 134-145.
[29] Kustka A B,Saudo-Wilhelmy S A,Carpenter E J,et al. Iron requirements for dinitrogen-and ammonium-supported growth in cultures of Trichodesmium (IMS 101): comparison with nitrogen fixation rates and iron: carbon ratios of field populations[J]. Limnol Oceanogr,2003,48(5): 1869-1884.
[30] Xu Jie,Yin Kedong,He Lei,et al. Phosphorus limitation in the northern South China Sea during late summer: influence of the Pearl River[J]. Deep-Sea Research Part Ⅰ: Oceanographic Research Papers,2008,55(10): 1330-1342.
[31] Lugomela C,Lyimo T J,Bryceson I,et al.Trichodesmiumin coastal waters of Tanzania: diversity,seasonality,nitrogen and carbon fixation[J]. Hydrobiologia,2002,477(1/3): 1-13.
[32] 李涛,刘胜,黄良民,等. 大亚湾红海束毛藻赤潮生消过程研究[J]. 海洋环境科学,2008,27(3): 224-227.
Li Tao,Liu Sheng,Huang Liangmin,et al. Studies on a Trichodesmium erythraeum red tide in Daya Bay[J]. Marine Environmental Science,2008,27(3): 224-227.
[33] 王雨,林茂,杨清良,等. 台湾岛以东海域束毛藻种群的组成与分布[J]. 海洋通报,2012,31(4): 426-432.
Wang Yu,Lin Mao,Yang Qingliang,et al. Composition and distribution of theTrichodesmiumpopulation in the sea area east to Taiwan[J]. Marine Science Bulletin,2012,31(4): 426-432.
[34] Chang J,Chiang K P,Gong G C. Seasonal variation and cross-shelf distribution of the nitrogen-fixing cyanobacterium,Trichodesmium,in southern East China Sea[J]. Continental Shelf Research,2000,20(4/5): 479-492.
[35] Zehr J P. Nitrogen fixation by marine cyanobacteria[J]. Trends Microbiol,2011,19(4): 162-173.
[36] Veldhuis M J W,Timmermans K R,Croot P,et al. Picophytoplankton; a comparative study of their biochemical composition and photosynthetic properties[J]. Journal of Sea Research,2005,53(1/2): 7-24.
Phytoplankton responses to nitrogen and phosphorus enrichment in relation to different water masses
Li Jiajun1,2,3,Shen Pingping1,3,Tan Yehui1,3,Jiang Xin1,2,3,Zhou Linbin1,3
(1.KeyLaboratoryofTropicalMarineBio-resourcesandEcology,SouthChinaSeaInstituteofOceanology,ChineseAcademyofSciences,Guangzhou510301,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China;3.GuangdongProvincialKeyLaboratoryofAppliedMarineBiology,SouthChinaSeaInstituteofOceanology,ChineseAcademyofSciences,Guangzhou510301,China)
Insitusurvey of northeastern South China Sea (20°~24°N,114°~121°E),combined with nutrient (Nitrogen and Phosphorus) enrichment experiments were conducted during a cruise ofShiyanⅢ in May 2014. Based on the analysis of environmental variables and water masses,the northeastern South China Sea were divided into three areas: near shore regions,continental shelf regions and deep sea basins. The incubation results showed that phytoplankton did not response significantly to enrichment during incubation in near shore and sea basin stations,whereas increased after 48 h in the area of continental shelf,especially in the group which added both nitrite and phosphate.Trichodesmiumwere abundant in all experiment stations,while died away quickly during incubation. The phytoplankton species composition and proportion of size fractioned Chlaalso changed notably with nutrient enrichment,and the variation was more significant in shelf regions. The results of shelf regions showed that the dominant species shifted from dinoflagellates such asAmphidiniumcarterae,Dinophysisargus,Prorocentrumsp. to diatoms such asChaetoceroscinctus,C.curvisetus,C.radicansandLeptocylindrusdanicusafter incubation. Besides,the results also revealed that phosphate stimulated the growth of picophytoplankton synechococcus in the area of continental shelf significantly.
northeastern South China Sea; phytoplankton; nutrient enrichment;water masses
2015-01-21;
2015-07-20。
国家基金(41276162);广东省科技计划项目(2014B030301064);中国科学院海洋专项(XDA11020200);农业行业专项(201403008);科技基础性工作专项项目(2012FY112400, 2013FY111200)。
李佳俊(1990—),男,宁夏石嘴山市人,博士,主要从事海洋生态研究。 E-mail:00lijiajun00@163.com
*通信作者:谭烨辉,研究员,主要从事海洋生态学研究。E-mail:tanyh@scsio.ac.cn
10.3969/j.issn.0253-4193.2015.10.009
Q948.8
A
0253-4193(2015)10-0088-12
李佳俊,沈萍萍,谭烨辉,等. 南海东北部浮游植物对氮、磷加富的响应及与不同水团的关系[J].海洋学报,2015,37(10):88—99,
Li Jiajun,Shen Pingping,Tan Yehui,et al. Phytoplankton responses to nitrogen and phosphorus enrichment in relation to different water masses[J]. Haiyang Xuebao,2015,37(10):88—99,doi:10.3969/j.issn.0253-4193.2015.10.009
