加拿大海盆北部营养盐限制作用研究
2015-01-05李宏亮陈建芳高生泉卢勇金海燕白有成庄燕培张海生
李宏亮,陈建芳,2*,高生泉,卢勇,金海燕,2,白有成,庄燕培,张海生
(1. 国家海洋局 第二海洋研究所 海洋生态系统与生物地球化学重点实验室,浙江 杭州310012;2. 国家海洋局 第二海洋研究所 卫星海洋环境动力学国家重点实验室,浙江 杭州310012)
加拿大海盆北部营养盐限制作用研究
李宏亮1,陈建芳1,2*,高生泉1,卢勇1,金海燕1,2,白有成1,庄燕培1,张海生1
(1. 国家海洋局 第二海洋研究所 海洋生态系统与生物地球化学重点实验室,浙江 杭州310012;2. 国家海洋局 第二海洋研究所 卫星海洋环境动力学国家重点实验室,浙江 杭州310012)
利用2008年夏季中国第三次北极科学考察获得的营养盐、叶绿素a、温度和盐度等数据资料,结合现场营养盐添加实验的结果讨论西北冰洋加拿大海盆北部营养盐对浮游植物生长的限制作用。结果表明:由于融冰水稀释作用,加拿大海盆B80站约20 m深度存在较强的盐跃层,阻碍了水体上下混合。较低浓度的溶解无机氮(DIN)和硅酸盐(分别为0.31 μmol/L和0.94 μmol/L)以及严重偏离Redfield比值的N/P、N/Si比值(分别为0.42和0.32)表明加拿大海盆表层水体存在N和Si限制。根据现场营养盐加富实验各培养组叶绿素a浓度变化、营养盐吸收总量差异和浮游植物种群结构,进一步表明氮是北冰洋海盆首要限制营养盐,而Si则抑制了硅质生物的生长。同时,较小的硝酸盐半饱和常数(Ks)证明即使在营养盐充足的情况下北冰洋海盆浮游植物生长速率也处于较低水平。计算得到各培养组营养盐吸收比例(N/P比值)均大于Redfield比值,可能是培养实验过程中以微型、微微型浮游植物为主,硅藻等小型浮游植物为辅造成的。
营养盐限制;Redfield比值;种群结构;营养盐加富实验;北冰洋;加拿大海盆
1 引言
氮、磷和硅等营养盐作为海洋生态系统的起点与物质基础,是全球大部分海区浮游植物生长繁殖的主要限制因子之一,在浮游植物旺发的季节尤为明显[1]。根据Liebig最小因子定律,营养盐的绝对浓度可作为浮游植物细胞生长限制与否和生物总量上限的判断依据[2]。与此同时,营养盐之间的比例(如N/P比值)对浮游植物的生化组成、粒级结构和种群更替等起着重要的调控作用[3],且其与Redfield比值的偏离程度是判断潜在限制因子的重要依据[4—5]。另外,许多海区往往存在多种营养盐共同限制的现象[5—6]。在全球变化的背景下,诸如温度升高、海冰消退以及大尺度海洋环流变异等物理环境变化使得海洋上层水体变暖、变淡和层化现象逐渐加强,导致海洋营养盐限制问题日益显著[7]。
近年来,北冰洋夏季海冰覆盖面积和多年冰比例持续锐减,最新预测结果显示最快将在2020年左右夏季基本无冰[8]。随着北极物理环境的剧变,海洋生态系统亦随之改变[9]。卫星遥感数据表明,自1979年以来第二低的夏季海冰覆盖率导致2007年北冰洋陆架初级生产力比1998-2002年平均值高出27%[10],同时在拉普捷夫海观测到2007年颗粒有机碳输出通量是往年的两倍[11]。然而,海冰消退能够强化加拿大海盆南部海区水体的层化作用,导致深层高浓度营养盐难以穿透盐度跃层到达混合层,从而抑制并减弱了浮游植物初级生产力,这与上述陆架海区生物泵作用加强截然不同[12]。尽管如此,在任何海区以无机营养盐为基础的浮游植物光合作用都是海洋生态系统对北冰洋海冰快速变化响应的关键环节,亦是热点科学问题。近年来已有较多的研究进展,如Popova等[13]通过比较5个不同的物理-生态耦合模式表明,水体垂直混合输入表层的营养盐是控制北冰洋海盆区初级生产过程的关键因素。Codispoti等[14]指出加拿大海盆表层水体中浓度极低的硝酸盐(约0 μmol/L)将群落净生产力限制在较低水平。然而,鲜有利用现场加富实验探讨北冰洋营养盐与浮游植物初级生产过程相互作用的研究报道。基于以上认识,本文拟通过加拿大海盆区营养盐浓度及其结构并结合现场添加实验揭示海盆区营养盐对浮游植物生长和种群更替的调控作用。
2 材料与方法
2.1 样品采集及现场培养
2008年7-9月依托“雪龙”号进行中国第三次北极科学考察,考察区域主要覆盖白令海、楚克奇海、波弗特海和加拿大海盆。8月16日在加拿大海盆B80站(80.008°N,147.489°W)进行了营养盐加富现场培养实验,站位如图1所示。具体步骤如下:利用CTD梅花采水器(Seabird-911)采集表层海水(5 m以
浅),用200 μm筛绢过滤后分装至12个4.0 L聚丙烯可折叠透明培养袋中,分成对照组、添加N、N+P、N+Si、P+Si和N+P+Si共6组进行培养实验。培养液成分为KNO3溶液、KH2PO4溶液和Na2SiF6溶液,浓度分别为10 000 μmol/L、1 000 μmol/L和10 000 μmol/L,添加体积与浓度如表1所示。营养盐培养液添加完毕后,混合均匀,从每个培养袋中采集300 mL用于营养盐和叶绿素a分析,作为培养实验各参数的起始值。采集完毕后,将培养袋盖紧置于甲板上的水槽中,并利用循环海水使培养槽中海水温度与表层海水温度相一致。每隔2 d采集一次样品,培养周期为16 d。最后一次采集的样品除了分析营养盐和叶绿素a外,还利用显微镜鉴定了小型浮游植物(大于20 μm)种群结构。
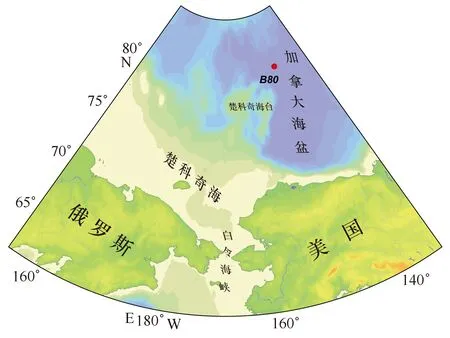
图1 站位图Fig.1 Sampling station
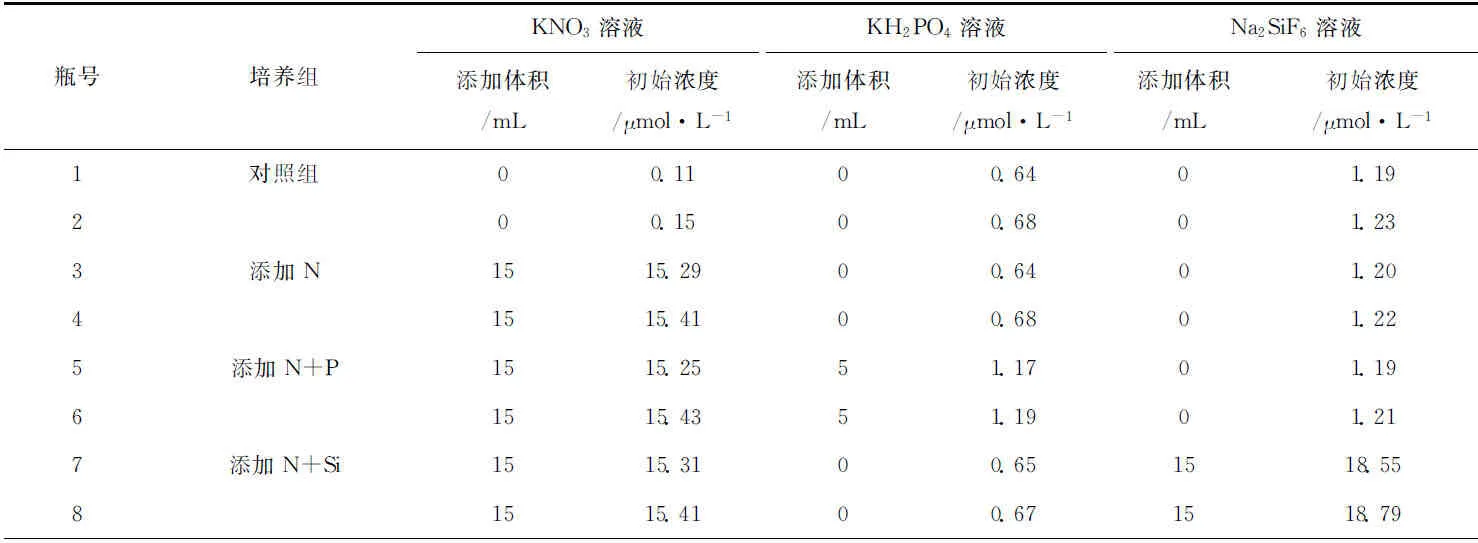
表1 培养液添加体积和起始浓度Tab.1 Added culture medium volume and initial concentration of nutrients

续表1
2.2 样品分析
营养盐分析方法参考Grasshoff等主编的《Methods of Seawater Analysis》[15]和《海洋调查规范——海水化学要素观测》[16],硝酸盐、磷酸盐和硅酸盐采用营养盐自动分析仪(Skalar San++)测定,铵盐和亚硝酸盐采用手动分光光度计法测定。亚硝酸盐和铵盐分别采用重氮-偶氮法和靛酚蓝法测定,硅酸盐、磷酸盐和硝酸盐则分别采用硅钼蓝法、磷钼蓝法和镉铜柱还原法测定。其中,磷酸盐、硝酸盐和硅酸盐的相对标准偏差小于3.5%,亚硝酸盐和铵盐的相对标准偏差小于5.0%。至于叶绿素a分析,将250 mL海水样品用玻璃纤维滤膜(GF/F,直径25 mm)过滤,截留在滤膜上的光合浮游生物细胞用90%丙酮萃取,萃取液用唐纳荧光仪测定(Turner10-AU),并计算其浓度。
2.3 计算方法
若浮游植物符合指数增长规律,则其生长速率可按下式计算:
μ=ln[(Chl a)e/(Chl a)s]/t,
(1)
式中,μ代表浮游植物生长速率,单位是d-1;(Chla)s和(Chla)e分别代表培养实验起始与结束时的叶绿素a浓度;t则代表培养时间。
另外,根据Michaelis-Menton方程(2)引入营养盐吸收半饱和常数(Ks)讨论北冰洋浮游植物吸收营养盐的能力。
V=(Vm×S)/(Ks+S),
(2)
式中,V和Vm代表瞬时营养盐吸收速率和最大营养盐吸收速率,S则表示某一吸收速率时营养盐浓度。基于营养盐吸收速率和双倒数作图法,得到各培养组Ks值。
3 结果与讨论
3.1 B80站水文及水化学参数特征
2008年8月16日采集B80站表层海水进行培养实验时所在海区海冰覆盖率为80%左右[17]。根据美国国家海冰中心的卫星遥感资料显示,北冰洋一般在9月下旬达到海冰最小覆盖面积。因此,B80站此时正处于海冰快速融化阶段。如图2a所示,B80站200 m以浅温度、盐度和密度分别分布在-1.5~-1.0℃、28.38~34.15和22.80~27.94 kg/m3之间。受光照和融冰的影响20 m以浅水柱混合均匀,且与下层水体有明显的分层现象。加拿大海盆营养盐具有全球海洋独一无二的分布特征,即在深度150 m左右硝酸盐、磷酸盐和硅酸盐等达到整个水柱的最高值,被称作营养盐极大现象[18]。但是,由于层化作用阻碍了高浓度营养盐从深层输送至表层,使得真光层中营养盐得不到及时补充而处于较低的水平。如图2b所示,20 m以浅水中硅酸盐浓度分布在0.50~1.55 μmol/L,平均为0.93 μmol/L,磷酸盐浓度分布在0.67~0.78 μmol/L,平均为0.73 μmol/L,DIN浓度分布在0.15~0.53 μmol/L,平均为0.31 μmol/L。研究表明,浮游植物生长所需DIN、硅酸盐和磷酸盐最低阀值分别为1.0 μmol/L、2.0 μmol/L和0.1 μmol/L[19]。根据Liebig最小因子定律,B80站表层海水中DIN和硅酸盐浓度限制了浮游植物的生长。从营养盐结构来看,B80站200 m以浅水体DIN/P比值分布在0.22~9.25之间,平均为4.19;DIN/Si比值在0.32~0.75之间,平均为0.45。因此,无论是DIN/P比值或DIN/Si比值都小于Redfield比值(16∶1和1∶1),尤其是20 m以浅水柱中两者偏离Redfield比值更加明显。同一航次的叶绿素a分析结果证实了上述结论[20]。20 m以浅水柱中叶绿素a浓度均匀分布仅为0.05 μg/L左右,随着水深和营养盐浓度的增加叶绿素a浓度也随之增加,在40 m层形成叶绿素a浓度极大值。上层水体层化作用显著,使得次表层营养盐无法输送至表层,限制了表层浮游植物的生长。而在次表层,营养盐和光照充足,形成叶绿素极大层。同时,海冰融化之后将进一步增加海水层化,也是次表层叶绿素极大的成因之一[21]。此外,根据Klunder等[21]发表的结果显示,在北冰洋海盆溶解态铁主要来自于河流输入和海冰融化,其浓度在0.5~2.0 nmol/L之间。一般认为水体中溶解态铁浓度小于0.02 nmol/L时,Fe将会限制浮游植物的生长。所以,目前在北冰洋海盆不存在Fe限制的情况。浮游植物吸收利用,特别是白令海陆架和楚科奇海硅藻的旺发以及太平洋海水在进入北冰洋过程中发生的脱氮作用是造成加拿大海盆上层水体N和Si限制的主要原因[22-24]。

图2 加拿大海盆B80站200 m以浅各参数垂直剖面图Fig.2 Vertical profiles of upper 200 m at station B80 in the Canada Basina. 温度、盐度和密度;b. 溶解态无机氮、磷酸盐和硅酸盐浓度;c. 叶绿素a浓度、DIN/P比值和DIN/Si比值a. Temperature,salinity and density; b. DIN,phosphate and silicate concentration; c. Chl a concentration,N/P and N/Si ratios
3.2 浮游植物的营养盐限制
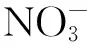
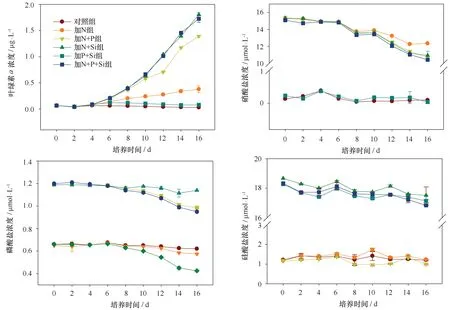
图3 培养过程叶绿素a、硝酸盐、磷酸盐和硅酸盐浓度随时间的变化趋势Fig.3 Trends of Chl a,nitrate,phosphate and silicate concentration during the experiment
然而,营养盐组成结构对浮游植物生长的刺激作用是不尽相同的。各培养组在实验过程中的各项营养盐的吸收总量如表2所示。其中,对照组营养盐在培养过程中几乎没有被消耗,而与对照组相比添加N+P+Si组浮游植物对各项营养盐的吸收最为明显,这与浮游植物平均指数生长速率是一致的。添加N、N+P和N+Si三组中浮游植物都大量吸收硝酸盐,但是添加混合营养盐显然比单独添加N更易刺激浮游植物的生长,消耗更多的N和P。与此同时,添加P+Si组对营养盐的消耗并不显著。因此,依据营养盐消耗量不仅可以证明N元素是北冰洋海盆区首要的限制营养盐,而且在N元素充足的条件下加入Si和P营养盐将进一步刺激浮游植物的生长。从2.1节可知,B80站混合层内硅酸盐将会限制硅质生物的生长,而磷酸盐并非潜在限制因子。然而,营养盐添加实验结果却表明该水体添加P将会进一步刺激浮游植物对N元素的吸收。
在Michaelis-Menton方程中,半饱和常数(Ks)代表着某一种群的浮游植物吸收营养盐的能力。根据双倒数作图法计算了添加N、N+P、N+Si和N+P+Si四组硝酸盐的Ks值,其值分别为0.03、0.13、0.01和0.08 μmol/L。MacIsaac和Dugdale[25]指出18℃时,海洋浮游植物群落在营养盐充足的情况下硝酸盐Ks值大于1 μmol/L。研究表明,Ks值随着温度的降低而减小,却不受光照条件等其他影响浮游植物生长速率的外部因素的影响[26]。
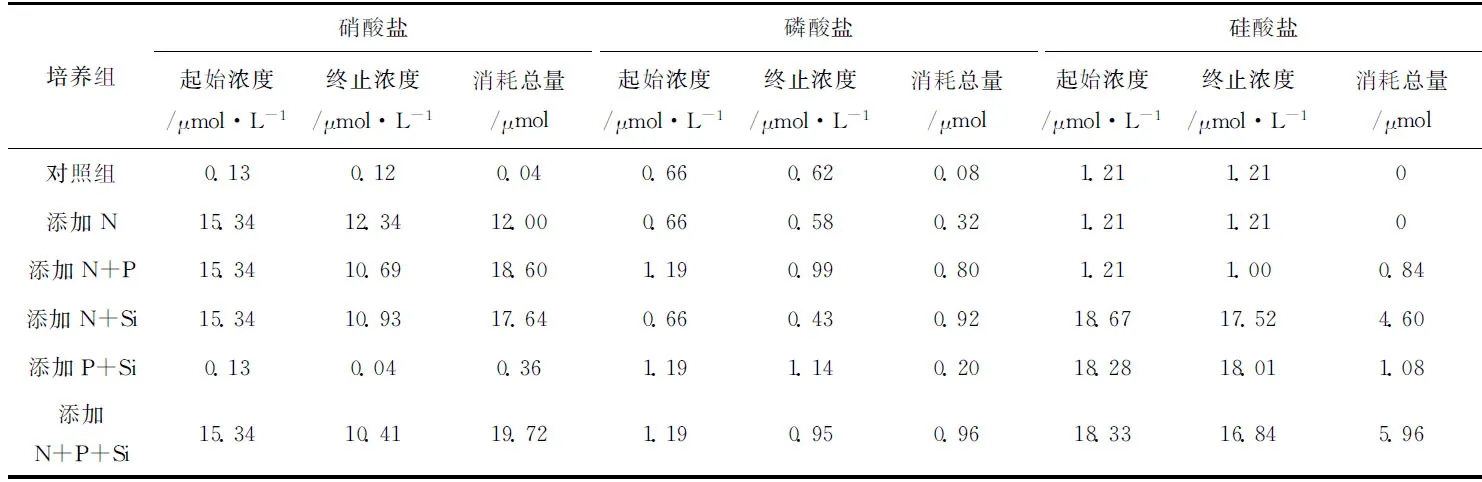
表2 各培养组营养盐起、止浓度与消耗量Tab.2 The initial and terminated concentration of nitrate,phosphate,silicate and thus calculated their final consumption
注:各培养组营养盐浓度为两个平行样品的平均值。
3.3 营养盐吸收比例与浮游植物种群结构
不同种群的浮游植物具有不同的营养盐需求,而pH、温度和光照等环境因子以及生长速率也会影响营养盐的吸收比例[27]。将添加N、N+P、N+Si和N+P+Si 4组起始营养盐比例和培养结束时最终的吸收比例进行作图。结果如图4所示,添加N+Si组的N/P吸收比值小于其起始比值,表明该组实验过程中优先吸收磷酸盐。而其他3组的N/P吸收比值大于其起始比值,预示着该组浮游植物优先吸收硝酸盐。
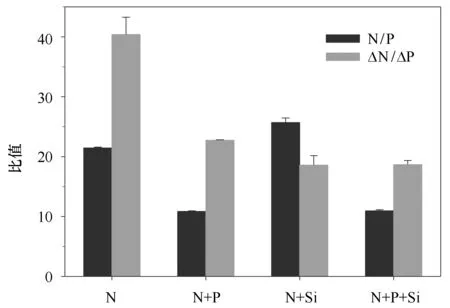
图4 培养实验起始营养盐比值(N/P)和实验过程营养盐吸收比值(ΔN/ΔP)Fig.4 The N/P ratio of seawater at the initial time and the nutrient uptake ΔN/ΔP ratio during the experiment
显微镜鉴定结果显示,各培养组中小型浮游植物较少或者缺失,多数为未能鉴定的微型、微微型生物。根据浮游植物种群结构的特征可分为以下3类:首先,添加N+P+Si组和N+Si组的小型浮游植物丰度相对较高,硅藻门中的角毛藻(Chaetocerossp.)是其优势种。其次,添加N组含极少量硅藻门中的舟形藻(Naviculasp.),多数为未鉴定的微型、微微型浮游植物。最后,添加N+P组则只含微型和微微型浮游植物,未发现小型浮游植物。
Klausmeier等[28]认为在P相对限制的环境中浮游植物的N/P比值分布在36~45之间,本研究添加N组营养盐吸收比值(N/P=37.5)分布在该范围内。这预示着,若加拿大海盆具有充足的N,磷酸盐的含量(约0.6 μmol/L)可能会是限制浮游植物生长的因子之一。当然,北冰洋营养盐循环和补充机制的变化趋势表明出现这种情况的可能性较小[12]。单一种培养实验结果表明硅藻和甲藻具有较小的N/P比值(分别为11和15左右),而其他微型、微微型浮游植物的N/P比值大于20,特别是绿藻门可达到25~40[29—30]。因此,添加N+P组营养盐吸收比值(N/P=23.3)大于Redfield比值可能是甲藻与其他微微型浮游植物的混合值。而添加N+Si组和N+P+Si组吸收比值(N/P=19.2和20.5)则可能是硅藻与其他微微型浮游植物的混合值。Arrigo等[31]在罗斯海观测到硅藻和定鞭金藻混合N/P比值趋向于Redfield比值。近期,Weber和Deutsch[32]在南大洋35°~70°S范围内发现浮游植物吸收营养盐的N/P比值分布在12~20之间,由于大洋环流及其他混合作用使得输出颗粒物的N/P比值也接近于16。
根据浮游植物种群鉴定结果和营养盐吸收情况可得到以下推论:第一,若加拿大海盆补充硝酸盐将会刺激浮游植物的生长,但是并不会改变其原本以微型、微微型浮游植物为主[33]的粒级结构特征。第二,若同时补充磷酸盐则会进一步刺激生物量的增加,然而同样不能改变其原有的粒级结构。第三,若同时补充N和Si将会刺激硅质浮游植物的生长,促使加拿大海盆区小型浮游植物比重逐渐增加。
4 结论
本文基于加拿大海盆B80站200 m以浅水体的物理结构、常量营养盐浓度及其比值,结合现场营养盐添加实验探讨了北冰洋海盆区营养盐对浮游植物生长的限制问题。主要得到以下结论:(1)由于表层存在较强的层化作用,加拿大海盆20 m以浅的水体中硝酸盐、硅酸盐浓度均低于浮游植物生长的最低要求,且其N/P比值小于Redfield比值16,表明表层水体存在N和Si元素限制。(2)通过现场营养盐添加实验结果验证了N是北冰洋海盆区首要限制营养元素,而Si则抑制了硅质生物的生长。(3)培养实验过程中以微型、微微型浮游植物为主,硅藻等小型浮游植物为辅的种群结构使得各培养组营养盐吸收比例(N/P比值)均大于Redfield比值。若加拿大海盆增加硝酸盐和硅酸盐的含量将改变其原本以微型、微微型浮游植物为主的粒级结构,硅藻等小型浮游植物比重将会增加。
致谢:感谢中国第三次北极科学考察队全体船员和考察队员的支持。特别是赵进平教授课题组以及陈红霞副研究员课题组提供的温度、盐度数据。培养实验过程中,感谢刘子琳研究员测定叶绿素a和韩国科学家Hyoungmin Joo鉴定浮游植物样品。
[1] Tyrrell T. The relative influences of nitrogen and phosphorus on oceanic primary production[J]. Nature,1999,400: 525-531.
[2] Moore C M,Mills M M,Arrigo K R,et al. Processes and patterns of oceanic nutrient limitation[J]. Nature Geoscience,2013,6: 701-710.
[3] Deutsch C,Weber T. Nutrient ratios as a tracer and driver of ocean biogeochemistry[J]. Annual Review of Marine Science,2012,4(1): 113-141.
[4] Redfield A C. The biological control of chemical factors in the environment[J]. American Scientist,1958,46(3): 205-221.
[5] Arrigo K R. Marine microorganisms and global nutrient cycles[J]. Nature,2005,437: 349-355.
[6] Saito M A,Goepfert T J,Ritt J T. Some thoughts on the concept of colimitation: Three definitions and the importance of bioavailability[J]. Limnology and Oceanography,2008,53(1): 276-290.
[7] Finkel Z V,Beardall J,Flynn K J,et al. Phytoplankton in a changing world: cell size and elemental stoichiometry[J]. Journal of Plankton Research,2010,32(1): 119-137.
[8] Overland J E,Wang M Y. When will the summer Arctic be nearly sea ice free?[J]. Geophysical Research Letters,2013,40(10): 2097-2101.
[9] Popova E E,Yool A,Coward A C,et al. Control of primary production in the Arctic by nutrients and light: insights from a high resolution ocean general circulation model[J]. Biogeosciences,2010,7: 3569-3591.
[10] Arrigo K R,Dijken G V,Pabi S. Impact of a shrinking Arctic ice cover on marine primary production[J]. Geophysical Research Letters,2008,35: L19603.
[11] Lalande C,Be'langer S,Fortier L. Impact of a decreasing sea ice cover on the vertical export of particulate organic carbon in the northern Laptev Sea,Siberian Arctic Ocean[J]. Geophysical Research Letters,2009,36: L21604.
[12] Cai W J,Chen L Q,Chen B S,et al. Decrease in the CO2uptake capacity in an ice-free Arctic Ocean Basin[J]. Science,2010,329: 556-559.
[13] Popova E E,Yool A,Coward A C,et al. What controls primary production in the Arctic Ocean? Results from an intercomparison of five general circulation models with biogeochemistry[J]. Journal of Geophysical Research,2012,117: C00D12.
[14] Codispoti L A,Kelly V,Thessen A,et al. Synthesis of primary production in the Arctic Ocean: Ⅲ. Nitrate and phosphate based estimates of net community production[J]. Progress in Oceanography,2013,110(3): 126-150.
[15] Grasshoff K,Kremling K,Ehrhardt M. Methods of Seawater Analysis [M]. Wiley-VCH,Weinheim,1999: 193-198.
[16] 国家技术监督局. GB17378.4——中华人民共和国国家标准海洋调查规范:第4部分. 海水化学要素观测[S]. 北京: 中国标准出版社,2007.
State Bureau of Quality Technical Supervision.GB17378.4—2007,The specification for marine monitoring Part 4: Seawater analysis[S]. Beijing: China Standards Press,2007.
[17] 张海生. 中国第三次北极科学考察报告[R]. 北京: 海洋出版社,2009:34-82.
Zhang Haisheng. The report of 2008 Chinese Arctic research expedition[R]. Beijing: China Ocean Press,2009:34-82.
[18] 金明明,林以安,卢勇,等. 1999年7月白令海海盆营养盐和溶解氧的垂直特征[J]. 极地研究,2001,13(4): 264-272.
Jin Mingning,Lin Yian,Lu Yong,et al. Vertical features of nutrient and dissolved oxygen of the Bering Basin in july 1999[J]. Advances in Polar Science,2001,13(4): 264-272.
[19] Justic D,Rabalais N N,Turner R E. Stoichiometry nutrient balance and origin of coastal eutrophication[J]. Marine Pollution Bulletin,1995,30: 41-46.
[20] 刘子琳,陈建芳,陈忠元,等. 2008年夏季白令海叶绿素a和初级生产力粒级结构[J]. 海洋学报,2011,33(2): 125-134.
[21] Klunder M B,Bauch D,Laan P,et al. Dissolved iron in the Arctic shelf seas and surface waters of the central Arctic Ocean: Impact of Arctic river water and ice-melt[J]. Journal of Geophysical Research,2012,117: C01027.
[22] Coupel P,Ruiz-pino D,Sicre M A,et al. The impact of freshening on phytoplankton production in the Pacific Arctic Ocean[J]. Progress in Oceanography,2015,121: 113-125.
[23] Chang B X,Devol A H. Seasonal and spatial patterns of sedimentary denitrification rates in the Chukchi Sea[J]. Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography,2009,56(17): 1339-1350.
[24] Codispoti L A,Flagg C,Kelly V,et al. Hydrographic conditions during the 2002 SBI process experiments[J]. Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography,2005,52(24/26): 3199-3226.
[25] Macisaac J J,Dugdale R C. The kinetics of nitrate and ammonia uptake by natural populations of marine phytoplankton[J]. Deep-Sea Research,1969,16: 415-422.
[26] Eppley R W,Rogers J N,Mccarthy J J. Half-saturation constants for uptake of nitrate and ammonium by marine phytoplankton[J]. Limnology and Oceanography,1969,14: 912-920.
[27] Sterner R W,Hessen D O. Algal nutrient limitation and the nutrition of aquatic herbivores[J]. Annual Review of Ecology and Systematics,1994,25: 1-29.
[28] Klausmeier C A,Litchman E,Daufresne T,et al. Phytoplankton stoichiometry [J]. Ecological Research,2008,23: 479-485.
[29] Ho T Y,Quigg A,Finkel Z V,et al. The elemental composition of some marine phytoplankton[J]. Journal of Phycology,2003,39: 1145-1159.
[30] Quigg A,Finkel Z V,Irwin A J,et al. The evolutionary inheritance of elemental stoichiometry in marine phytoplankton[J].Nature,2003,425: 291-294.
[31] Arrigo K R,Robinson D H,Worthen D L,et al. Phytoplankton community structure and the drawdown of nutrients and CO2in the Southern Ocean[J]. Science,1999,283: 365-367.
[32] Weber T S,Deutsch C. Ocean nutrient ratios governed by plankton biogeography[J]. Nature,2010,467: 550-554.
[33] Booth B C,Horner R A. Microalgae on the Arctic Ocean Section,1994: species abundance and biomass[J]. Deep-Sea Research Part Ⅱ:Topical Studies in Oceanography,1997,44(8): 1607-1622.
Nutrient limitation in the northern Canada Basin
Li Hongliang1,Chen Jianfang1,2,Gao Shengquan1,Lu Yong1,Jin Haiyan1,2,Bai Youcheng1,Zhuang Yanpei1,Zhang Haisheng1
(1.KeyLaboratoryofStateOceanicAdministrationforMarineEcosystemandBiogeochemistry,SecondInstituteofOceanography,StateOceanicAdministration,Hangzhou310012,China; 2.StateKeyLaboratoryofSatelliteOceanEnvironmentDynamics,SecondInstituteofOceanography,StateOceanicAdministration,Hangzhou310012,China.)
The concentrations of nitrate,phosphate,silicate,Chlawere analyzed andinsitunutrients enrichment experiment was conducted in the summer of 2008 to discuss the impact of macronutrient limitation on phytoplankton biomass and community structure in the western Arctic Canada Basin. The results showed that there was a strong stratification in the upper 20 m at B80 station. Lower concentrations of dissolved inorganic nitrogen (DIN) and silicate (0.31 and 0.94 μmol/L,respectively) and serious deviation from the Redfield ratio of the N/P,N/Si (0.42 and 0.32,respectively) indicated N and Si limited in the upper layer of the Canada Basin. According to the trend of Chla,nutrients uptake and phytoplankton community structure during the experiment deduced that nitrogen was the primary limited nutrient,while silicate inhibited the growth of siliceous phytoplankton in the upper layer of the Canada Basin. Meanwhile,the smaller half saturation constant (Ks) of nitrate can also prove that the phytoplankton growth rates were at a low level even the absence of nutrient limitation in the Arctic Basin. The phytoplankton species were dominated by nano-or pico-phytoplankton rather than diatom,which would be responsible for the higher nutrient assimilation ratios of N/P compared to the Redfield ratio.
nutrient limitation; Redfield ratio; phytoplankton community structure; enrichment experiment; Arctic Ocean; Canada Basin
2015-04-20;
2015-07-15。
国家自然科学基金项目(41003036,41076135);中国极地战略研究基金(20120305)。
李宏亮(1981—),男,浙江省金华市人,副研究员,主要从事海洋生物地球化学研究。E-mail:lihongliang@sio.org.cn
*通信作者:陈建芳(1968—),男,研究员。E-mail:jfchen@sio.org.cn
10.3969/j.issn.0253-4193.2015.11.014
P722;P734.4+4
A
0253-4193(2015)11-0147-08
李宏亮,陈建芳,高生泉,等. 加拿大海盆北部营养盐限制作用研究[J]. 海洋学报,2015,37(11): 147-154,
Li Hongliang,Chen Jianfang,Gao Shengquan,et al. Nutrient limitation in the northern Canada Basin[J]. Haiyang Xuebao,2015,37(11): 147-154,doi:10.3969/j.issn.0253-4193.2015.11.014
