膜技术制备山茱萸皂苷的研究
2015-01-05时国庆马甜甜刘延奇
时国庆,马甜甜,刘 珂 , 刘延奇
(1.郑州轻工业学院 食品与生物工程学院,河南 郑州 450002;2.河南省食品生产与安全协同创新中心,河南 郑州 450002)
膜技术制备山茱萸皂苷的研究
时国庆1,2,马甜甜1,刘 珂1, 刘延奇1,2
(1.郑州轻工业学院 食品与生物工程学院,河南 郑州 450002;2.河南省食品生产与安全协同创新中心,河南 郑州 450002)
以山茱萸皂苷转移率和除杂率为评价指标,进行微滤和超滤实验,对操作压差、温度和膜的孔径进行优选。结果表明:使用60%乙醇为溶剂,选择孔径0.45μm的陶瓷膜,在溶液温度50 ℃、过滤压差0.15~0.2MPa条件下,能达到较好去除提取液中的大分子胶体或细小固体微粒悬浮物的效果;选择截留相对分子质量为10KD的超滤膜,在溶液温度40 ℃、操作压力0.4~0.6MPa条件下,脱除蛋白,部分色素等杂质的效果较好。膜分离技术能有效分离、纯化山茱萸皂苷,工艺简单、效率高。
山茱萸;皂苷;微滤;超滤
山茱萸(Cornus officinalis Sieb. et Zucc.),别称山萸肉,为山茱萸科山茱萸属落叶灌木或小乔木山茱萸的成熟果实[1]。传统医学认为山茱萸能温肝补肾,除一切风,可用于月经过多、老人尿频、虚汗不止、妇女崩漏、内热消渴等症[2]。现代研究表明,总皂苷为其主要活性成分之一[3]。山茱萸皂苷具有良好的α-葡萄糖苷酶抑制功能[4],能降低链脲佐菌素致糖尿病模型大鼠的血糖浓度,改善糖尿病致睾丸病变的影响,同时具有免疫调节和抑菌等作用[5-8]。是相关药品或保健食品的潜在优质天然原料。
目前,致力于山茱萸皂苷生产工艺的应用基础研究还不多见,且大多采用乙醇为提取溶剂,使用大孔吸附树脂或正丁醇萃取为纯化手段[9-12]。膜分离是20世纪初出现,20世纪60年代后迅速崛起的一门分离新技术。膜分离技术由于兼有分离、浓缩、
纯化和精制的功能,又有高效、节能、环保、分子级过滤及过滤过程简单、易于控制等特征,因此,已广泛应用于食品、医药、环境等多个领域,产生了巨大的经济效益和社会效益,已成为当今分离科学中最重要的手段之一[13]。本文拟采用膜技术对山茱萸皂苷纯化工艺进行研究,为山茱萸皂苷的生产提供选择。
1 材料与方法
1.1 材料、仪器与试剂
山茱萸,购于郑州国药大药房,并经河南中医学院杨怀霞教授鉴定,符合相关标准。R-1002-VN及R-1010旋转蒸发仪,郑州长城科工贸有限公司;SP-756PC紫外—可见分光光度计,上海光谱仪器有限公司;BT224S分析天平,德国赛多利斯公司;SHZ-2000型循环水式真空泵,巩义市予华仪器有限责任公司;实验室陶瓷膜及超滤膜分离设备,上海朗极膜分离设备工程有限公司。人参皂苷Re对照品(≥98%),中国药品生物制品检定所;甲醇、高氯酸、冰醋酸、香草醛等试剂,均为国产分析纯。
1.2 试验方法
1.2.1 标准曲线的绘制
准确称取人参皂苷Re对照品20 mg,甲醇溶解,10 mL容量瓶定容,配制成浓度为2 g/L的溶液。准确移取此溶液30、45、60、75、90 μL于10 mL具塞试管中,热风吹干溶剂,加入5%香草醛—冰醋酸溶液0.2 mL、高氯酸0.8 mL,摇匀后,置于60 ℃水浴中,15 min后取出冰水浴冷却3 min,再加入5 mL冰醋酸,摇匀,转入比色皿中,545 nm处测吸光值,以不加对照品溶液的试剂做空白,绘制标准曲线[11]。
1.2.2 山茱萸提取液的制备
将山茱萸粉碎成380 μm(40目)左右的粗粉,以体积比为60%的乙醇作为提取溶剂,提取温度70 ℃,料液比1∶20,提取时间1 h,提取一次,过滤,取一部分提取液直接进行膜分离实验,另一部分减压浓缩蒸去乙醇后,加水稀释至浓缩前体积进行膜分离实验。
1.2.3 微滤
分别使用以水和60%为溶剂的提取液,选用孔径分别为0.14、0.45、0.8和1.4 μm的陶瓷膜以全回流方式循环运行,操作压差0.2 MPa,温度50 ℃,考察膜通量随运行时间的变化,每10 min测定一次,当膜通量基本稳定以后,停泵,测定透过液皂苷浓度、提取液皂苷浓度和固形物含量,计算除杂率和皂苷转移率,以确定合适的膜孔径和溶剂。确定合适的膜孔径和溶剂后,在料液温度为30、50、70和80 ℃条件下进行实验,计算除杂率和皂苷转移率,以确定较优温度。在较优条件下改变压差,测定膜通量,以确定合适的运行压力。实验采用管式陶瓷膜,膜面积0.04 m2,以单管道、错流循环方式进行,流速和压差由阀门和进口压力控制。除杂率和皂苷转移率按下面公式计算:
除杂率=[(原液固形物含量-透过液固形物含量)/ 原液固形物含量]×100%
(1)
皂苷转移率=(透过液皂苷含量 / 原液皂苷含量)×100%
(2)
1.2.4 超滤
使用较优条件下的微滤透过液,分别选用截留相对分子质量为50、30、10、5和2.5KD的卷式聚醚砜膜,以全回流方式循环运行,操作压差为0.6 MPa,温度40 ℃,考察膜通量随运行时间的变化,每10 min测定一次,当膜通量基本稳定以后,停泵,测定超滤透过液皂苷浓度、微滤透过液皂苷浓度和固形物含量,计算除杂率和皂苷转移率,以确定合适的膜孔径和溶剂。在料液温度为20、30、40 ℃条件下进行实验,计算除杂率和皂苷转移率,以确定较优温度。在较优条件下改变压差,测定膜通量,以确定合适的运行压力。在较优条件下计算除杂率和皂苷转移率和产品纯度。实验采用卷式聚醚砜膜,膜面积0.24 m2,以错流循环方式进行,流速和压差由阀门和进口压力控制。
1.2.5 固形物得率的测定
量取100 mL的超滤液,置于已恒重的圆底烧瓶中,减压浓缩至干,干燥箱恒重,减量法得固形物质量,计算固形物得率。
1.2.6 山茱萸皂苷的测定
准确移取不同条件下过陶瓷膜前和超滤膜前后的提取液样品各100 mL,分别使用水饱和的正丁醇萃取,正丁醇相真空浓缩除去溶剂,固形物甲醇溶解并转移至10 mL容量瓶中,定容,取一定量按1.2.1项方法处理,545 nm处测吸光值,计算样品皂苷浓度。根据固形物得率计算产品纯度。
2 结果与讨论
2.1 标准曲线的绘制
以人参皂苷Re浓度为横坐标,吸光值为纵坐标绘制标准曲线,如图1所示。

图1 皂苷标准曲线
根据结果作线性回归,得到吸光值和浓度关系的方程为:
A=4.372C-0.017
(3)
R2=0.999,说明在试验浓度范围内两者具有良好的线性关系。
2.2 微滤过程
微滤主要用于对提取液进行预处理,以去除大分子胶体或细小固体微粒,影响微滤效果的主要有溶剂、膜孔径、温度、流速和压差等因素。
2.2.1 膜孔径的选择
分别以60%乙醇和水为溶剂,不同膜孔径下其膜通量随时间变化的情况如图2所示,不同膜孔径下皂苷转移率和除杂率情况如表1所示(实验结果用均值±标准差表示,n=3,下同)。

图2 不同膜孔径下膜通量与时间的关系

表1 不同膜孔径下的除杂率和皂苷转移率
由图2和表1可知,用水作溶剂,与60%乙醇相比,在膜孔径相同情况下,其除杂率和皂苷转移率均较低,这可能和皂苷在水中的溶解度不如在60%乙醇有关,也可能是用水提取得到一些低极性成分,这些低极性成分和皂苷形成不溶于水的复合物被陶瓷膜截留下来,从而造成这种现象。用水作溶剂较大孔径的膜除杂率更高而皂苷转移率更低应与膜污染速度较快有关,图2中不同膜孔径下膜通量随时间变化的情况也证明了这一点。与60%乙醇为溶剂相比,相同孔径的膜运行相同时间,以水为溶剂的膜通量较低,因此,不对提取液处理,直接采用60%乙醇提取液进行微滤除杂比较适宜。在以60%乙醇为溶剂的情况下,不同孔径的膜膜通量相差不大,而皂苷转移率随着膜孔径增大而增大,考虑到除杂率,选取0.45 μm的膜作为进一步实验的材料。
2.2.2 温度对微滤效果的影响
以60%乙醇为溶剂,使用孔径为0.45 μm的膜,研究不同温度下膜通量随时间变化的情况,结果如图3所示,不同温度下皂苷转移率和除杂率情况如表2所示。

图3 不同温度下膜通量与时间的关系

表2 不同温度下的除杂率和皂苷转移率
由图3和表2可知,温度对微滤效果的影响较大,在30~70 ℃,随着温度的升高,膜通量、皂苷转移率逐渐升高,除杂率逐渐下降,这可能和升高温度能降低料液黏度和提高皂苷溶解度有关。80 ℃时,膜通量和皂苷转移率反而较低,原因可能是较高的温度使得提取液中的一些物质性质发生改变,溶解度下降,膜对这些物质的吸附量增加而导致膜通量降低。50 ℃和70 ℃条件下,两者的膜通量、皂苷转移率和除杂率相差不是很大,考虑到能耗问题,选择50 ℃比较适宜。
2.2.3 操作压差对微滤效果的影响
对于采用压力驱动的微滤过程,存在一个临界压力,在临界压力之下,压差越大膜通量也就越大,但当压力高于临界压力时,由于膜面形成了凝胶层,压差对膜通量影响不大,微滤过程一般选在低于临界压力的中压区,可以在保持较高膜通量的情况下,降低能耗减少膜污染。不同操作压差条件下,膜通量变化的情况如图4所示。

图4 膜通量与压差的关系
由图4可知,当微滤膜两端的压力差超过0.2 MPa时,膜通量和压差的关系不大,考虑到能耗和膜污染的问题,微滤操作运行时,膜压力应维持在0.15~0.20 MPa。
2.3 超滤过程
超滤主要用于脱除蛋白、部分色素等杂质,以进一步纯化山茱萸皂苷。
2.3.1 膜孔径的选择
不同孔径超滤膜膜通量随时间变化的情况如图5所示,皂苷转移率及除杂率测定结果见表3。
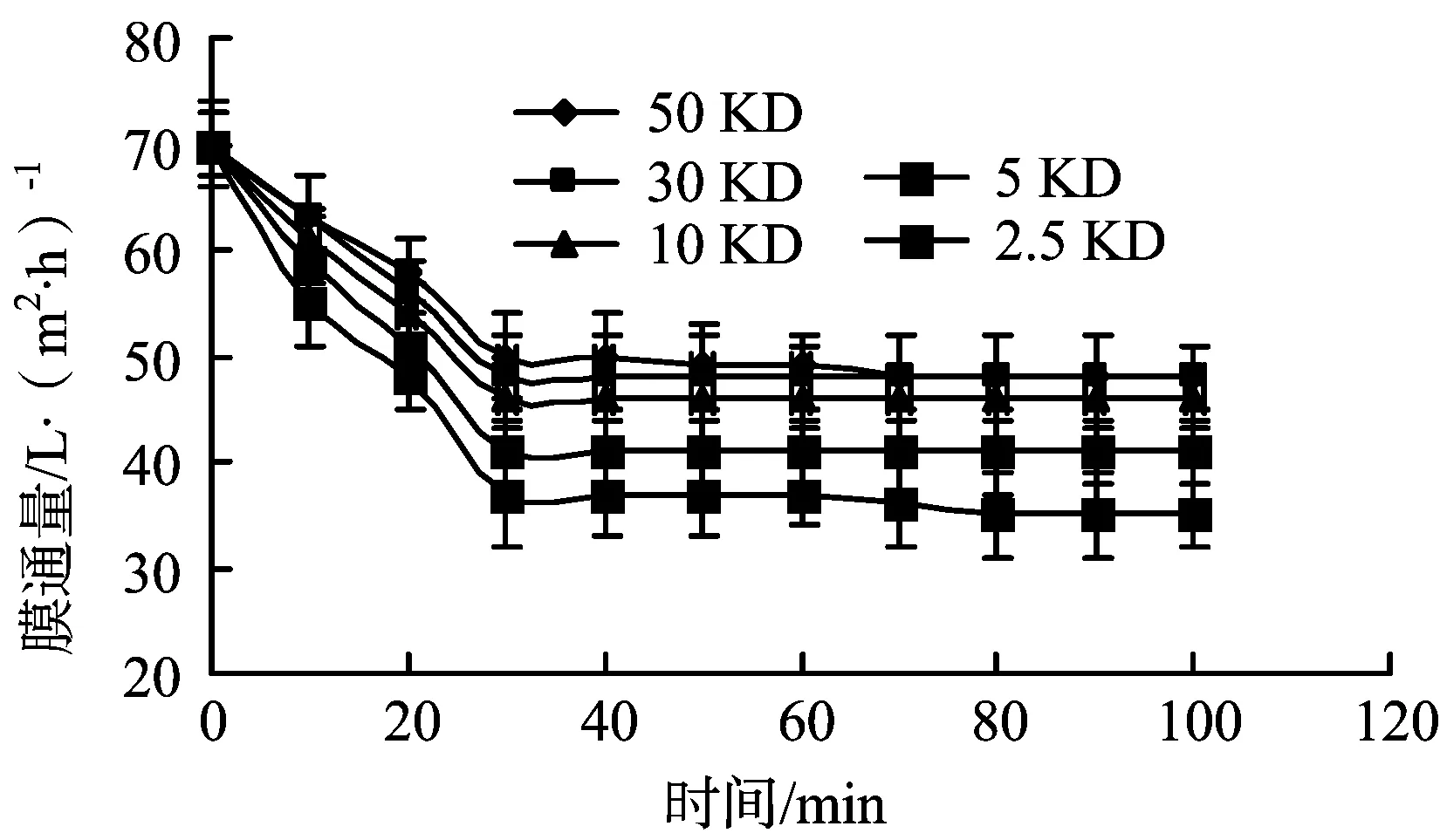
图5 不同膜孔径下膜通量与时间的关系
由图5和表3可知,不同孔径的超滤膜,膜通量差别不是很大。使用50、30、10 KD的超滤膜,其皂苷转移率相差不大,其除杂率随着膜孔径的减小而逐渐增大。5、2.5 KD的超滤膜皂苷转移率较小,选择10 KD的超滤膜较为适宜。

表3 不同膜孔径下的除杂率和皂苷转移率
2.3.2 温度对微滤效果的影响
由于膜材料最佳运行温度在45 ℃以下,使用10 KD的聚醚砜卷式膜,选择20、30和40 ℃考察温度对膜通量的影响,结果如图6所示,不同温度下皂苷转移率除杂率关系如表4所示。

图6 不同温度下膜通量与时间的关系

表4 不同温度下的除杂率和皂苷转移率
虽然随着温度的升高,整个体系的黏度会下降,但由图6和表4结果可知,温度对超滤效果影响不大,这可能是经过微滤,一些影响超滤效果的物质已经被除去,皂苷在实验浓度条件下,其在溶剂中的溶解情况受温度影响不大,但提高温度,对增加膜通量有一定的好处,考虑到前面微滤在50 ℃条件下运行,超滤操作选择40 ℃作为操作温度。
2.3.3 操作压差对超滤效果的影响
不同操作压差条件下,膜通量变化的情况如图7所示。

图7 膜通量与压差的关系
由图7可以看出,当微滤膜两端的压力差超过0.6 MPa时,膜通量和压差的关系不大,考虑到能耗和膜污染的问题,微滤操作运行时,膜压力应维持在0.4~0.6 MPa。
以60乙醇为溶剂,使用微滤结合超滤对山茱萸皂苷进行存化,去除大分子杂质(微滤条件:0.45 μm陶瓷膜,操作温度 50 ℃、过滤压差0.2 MPa;超滤条件:10 KD聚醚砜卷式膜,操作温度 40 ℃、过滤压差0.6 MPa),透过液浓缩干燥后产品纯度可达66.80% ,皂苷总转移率为87.10%。
3 结论
使用微滤结合超滤处理山茱萸提取液,能有效去除大分子杂质,过滤过程简单、易于控制,产品纯度高。
[1] 赵惠茹,龙 静,杨黎彬,等. HPD -300 大孔吸附树脂对山茱萸总皂苷分离工艺的优化[J].中成药,2014,36(2):416-419.
[2] 窦迎春.山茱萸临床应用探析[J].山东中医药大学学报,2010,34(4):313-314.
[3] 盖晓华,王 青,李炳超,等.山茱萸连续超声逆流提取工艺研究[J].中医药学报,2014,12(6):38-40.
[4] 马庆一,陈丽华,杨海延,等.山茱萸中α-葡萄糖苷酶抑制活性因子的筛选(Ⅰ)[J]. 食品科学,2007,28(1):167-170.
[5] Hsua J H,WU Y C,Liu I M,et al.Release of acetylcholine to raise insulin secretion in Wistar rats by oleanolic acid,one of the active principles contained in Cornus officinalis[J].Neuroscience Letters,2006,404:112-116.
[6] 刘英姿,刘浩然,周 源,等.山茱萸总皂苷对糖尿病大鼠睾丸病变的改善作用[J].中国现代医学杂志,2012,22(22):10-13.
[7] 于 淼,王晓先.山茱萸的药理作用研究进展[J].东南国防医药,2010,12(3):240-243,260.
[8] 张小慧,李 丽,董银卯,等.山茱萸的生物活性及其在化妆品中的应用[C].第十届中国化妆品学术研讨会论文集,2014:343-350.
[9] 李欣孺,赵 峰,龙 伟,等.山茱萸总皂苷的大孔吸附树脂分离与纯化研究[J].医药导报,2009,28(6):767-770.
[10] 吴 红,梁 恒,吴道澄,等.大孔吸附树脂法分离纯化山茱萸总皂苷[J].第四军医大学学报,2003,24(8):689-692.
[11] 韩志慧,张景伟, 赵玉丛,等.7种山茱萸总皂苷提取分离方法效果比较[J].郑州大学学报:医学版,2005,40(3):466-468.
[12] 徐建国,胡青平,田呈瑞,等.大孔吸附树脂纯化山茱萸总皂苷的动态吸附条件研究[J].西北植物学报,2005,25(11):2330-2334.
[13] 陈萍虹,杨晓林,徐 迪.膜分离技术及其应用现状[J].化工中间体,2014(7):8-11.
Purification of Total Saponins of Cornus officinalis by Membrane Separations Technology
SHI Guoqing1,2, MA Tiantian1, LIU Ke1, LIU Yanqi1,2
(1.School of Food and Bioengineering , Zhengzhou University of Light Industry , Zhengzhou 450002 , China ; 2.Henan Collaborative Innovation Center for Food Production and Safety , Zhengzhou 450002 , China)
The optimized pores,temperature and differential pressure were presented according to the membrane flux,metastasis rate of saponin and elimination rate of impurity by microfiltration and ultrafiltration experiments.The results showed that the effect of removing suspended solids and the macromolecular impurities from the extract was better using ceramic membrane with pore size of 0.45μm under the filtration pressure of 0.15~0.20 MPa and at 50 ℃ in 60 % alcohol.The effect of removing proteins and part of the pigments was better using ultrafiltration membrane with withheld molecularweight of 10KD under the operating pressure of 0.4-0.6MPa and at 40℃. Membrane separation technique is a simple and reliable technique, and can be used to separate and purify the saponins extracted from the Cornus officinalis effectively.
cornus officinalis sieb. et zucc. ; saponin ; microfiltration ; ultrafiltration
2015-06-02
郑州轻工业学院校内科研基金项目
时国庆 (1973-) ,男,博士,讲师,从事天然产物研究与开发工作,电话:13937145306;联系人:刘延奇(1964-),男,博士,教授,从事功能性多糖研究与开发工作,E-mail: liuyanqi@zzuli.edu.cn。
TQ
A
