盐、碱胁迫与温度对黄花苜蓿种子发芽的影响
2015-01-05张红香吴志红
武 祎,田 雨,张红香,杨 健,吴志红
(1.吉林省教育学院,吉林 长春 130022; 2.吉林农业大学动物科学技术学院,吉林 长春 130118;3.中国科学院东北地理与农业生态研究所,吉林 长春 130102; 4.内蒙古农业大学动物科学技术学院,内蒙古 呼和浩特 010018)
盐、碱胁迫与温度对黄花苜蓿种子发芽的影响
武 祎1,田 雨2,张红香3,杨 健2,吴志红4
(1.吉林省教育学院,吉林 长春 130022; 2.吉林农业大学动物科学技术学院,吉林 长春 130118;3.中国科学院东北地理与农业生态研究所,吉林 长春 130102; 4.内蒙古农业大学动物科学技术学院,内蒙古 呼和浩特 010018)
为了探讨盐、碱胁迫与温度交互作用对黄花苜蓿(Medicagofalcata)种子萌发的影响,选用两种中性盐(NaCl、Na2SO4)和两种碱性盐(Na2CO3、NaHCO3),3个温度(10/20 ℃、15/25 ℃和25/35 ℃)处理,测定各因子对种子最终发芽率及发芽速度的影响。结果表明,盐、碱胁迫与温度及其交互作用对黄花苜蓿种子发芽均有显著影响(P<0.05)。黄花苜蓿种子发芽率和发芽速度在10/20 ℃或15/25 ℃处理下最高,并且两者之间差异不显著(P>0.05)。随着盐、碱胁迫浓度的增加,种子发芽率和发芽速度降低,且碱性盐的胁迫作用大于中性盐。25/35 ℃高温显著抑制了各个处理下黄花苜蓿种子发芽,并且加剧了盐、碱胁迫对种子萌发的抑制作用。黄花苜蓿对碱性盐和高pH有一定的耐受性,在25 mmol·L-1的Na2CO3和30 mmol·L-1的NaHCO3处理下均能良好发芽。
盐胁迫;碱胁迫;温度;黄花苜蓿;种子发芽
土壤盐渍化是限制世界农业生产发展的主要非生物胁迫因子之一[1-2]。我国盐碱化土壤的面积约为9 913万 hm2[3],并且由于环境的恶化和人类活动的干扰,盐碱地的面积还在不断扩大,对我国农牧业生产和生态环境建设构成了严重威胁[4]。利用和培育耐盐、抗盐植物进行盐碱地改良被认为是经济而有效的途径[5]。
植物在不同生长阶段对环境因子的耐受范围及适应性存在差异。种子萌发期是植物生活史中最初和最关键的时期[6],发芽的质量将直接决定种群能否成功建植[4]。种子萌发受温度、光照、盐和碱等多种非生物因素的影响[7]。盐碱土中含有很多不同的盐分,这些盐分含有不同的阳离子和阴离子,对种子发芽和植物生长都有不同的影响[8]。NaCl、Na2SO4、NaHCO3和Na2CO3是中国东北盐碱化土地的主要致害盐分,通常将NaCl、Na2SO4等中性盐胁迫称为盐胁迫,而NaHCO3、Na2CO3等碱性盐胁迫称为碱胁迫[9]。有研究指出,土壤中的盐分会通过渗透胁迫和离子毒害作用阻止或者延迟种子发芽,甚至造成种子死亡[10-11]。也有研究表明,土壤中的碱性盐由于其较高的pH,对种子发芽的不利影响往往大于中性盐[4,9]。与此同时,温度往往会与土壤中盐碱成分交互作用来影响种子的萌发[4,7]。
黄花苜蓿(Medicagofalcata)是豆科苜蓿属多年生优质牧草,茎叶营养丰富,粗蛋白含量高,具有抗寒、抗旱、耐盐碱等特性[12-13],以往对盐胁迫下黄花苜蓿种子发芽的研究都集中在中性盐NaCl上[14-16],而有关不同温度以及盐碱土中常见的其他致害盐分对黄花苜蓿种子的萌发的影响尚未见报道。本研究在不同温度下探讨盐、碱胁迫对黄花苜蓿种子萌发的影响,以期为黄花苜蓿在盐碱地的种植应用和抗逆品种选育等提供理论依据。
1 材料和方法
1.1 试验材料
供试种子选用我国黄花苜蓿品种“呼伦贝尔黄花苜蓿”,种子质量为(1.434±0.033) mg,2013年采自呼伦贝尔市鄂温克旗。黄花苜蓿种子在试验前用98%浓硫酸处理15 min,流水冲洗1 h,滤纸吸干表面水分后自然风干[16],选取饱满均匀一致的种子进行试验。
1.2 试验处理
试验设置两种中性盐(50、100、150、200、250 mmol·L-1NaCl,25、50、75、100、125 mmol·L-1Na2SO4)和两种碱性盐(5、10、15、20、25 mmol·L-1Na2CO3;10、20、30、40、50 mmol·L-1NaHCO3)各5个浓度处理,蒸馏水为对照。分别置于10/20 ℃、15/25 ℃和25/35 ℃变温条件下,光照周期为16 h光照(光照强度为7 200 lx),8 h黑暗,人工气候箱的相对湿度为(50%±5%)。
1.3 发芽试验方法
采用纸上发芽法,将种子放置在铺有双层滤纸的9 mm培养皿中,每皿50粒种子,4次重复。每皿加10 mL测试溶液,用透气不透水的封口膜封住,避免水分蒸发引起的溶液浓度改变。试验开始后,每天记数发芽数(以胚根伸出种皮作为发芽标准),连续3 d没有种子发芽时结束试验。
1.4 数据统计
试验结束后,计算发芽率[16]和发芽速度。计算方法如下:
发芽率=最终发芽种子数/(种子总数-硬实种子数)×100%。
发芽速度表示每天发芽率的增长快慢,用修改后的Timson 指数评价发芽速度,发芽速度=∑G/t(其中,G为每天发芽率,t为总天数;此值越大表明发芽速度越快)。数据用SPSS 19.0软件统计分析,Excel软件作图,温度和盐浓度的双因素方差分析和处理间的单因素方差分析使用SPSS进行检验。
2 结果与分析
2.1 盐、碱与温度对黄花苜蓿发芽率的影响
盐、碱与温度及其交互作用均显著影响黄花苜蓿种子的发芽率(P<0.001,表1)。黄花苜蓿发芽
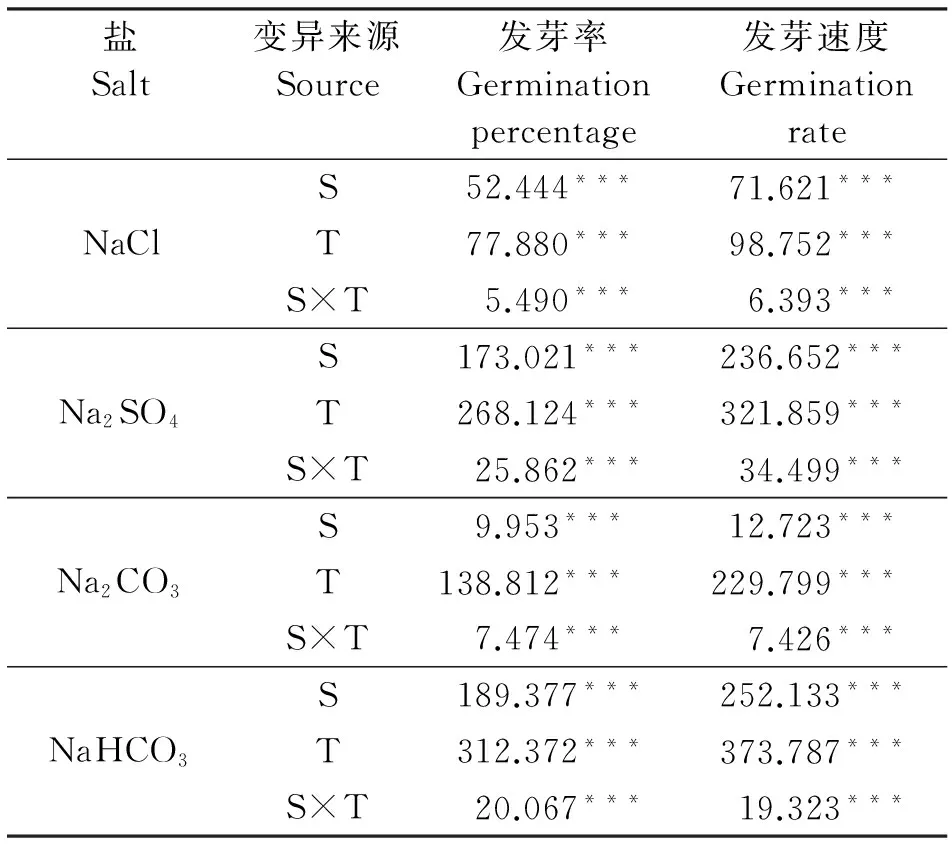
表1 盐、碱及温度对黄花苜蓿种子发芽率和发芽速度影响的双因素方差分析
注:表中数据为双因素方差分析的F值,***代表差异显著性水平为P<0.001。
Note: Data in the
Table areFvalues by two-way ANOVA, *** means significance at 0.001 level .
率在蒸馏水中随温度升高明显降低,10/20 ℃处理的发芽率最高,其次为15/25 ℃,25/35 ℃下发芽率最低,为69%,但3个温度间差异不显著(P>0.05)(图1)。NaCl处理下,黄花苜蓿发芽率随温度升高的变化趋势与对照相似,即在不同温度处理下,黄花苜蓿种子发芽率表现出随NaCl浓度升高而降低的趋势。但是不同温度下黄花苜蓿种子对NaCl的耐
受性显著不同,如在温度为10/20 ℃时,150 mmol·L-1的NaCl胁迫下黄花苜蓿种子发芽率与对照差异很小(P>0.05);温度为15/25 ℃时,150 mmol·L-1的NaCl胁迫下种子发芽率与对照相比降低了23.3%(P>0.05);而温度为25/35 ℃时,150 mmol·L-1的NaCl胁迫下黄花苜蓿种子发芽率与对照相比降低幅度达到82.6%(P<0.05)。并且随着胁迫浓度进一步的升高,高温对黄花苜蓿种子发芽的抑制程度加重。
Na2SO4胁迫条件下,黄花苜蓿在15/25 ℃处理下发芽率最高,但是与10/20 ℃处理下的差异不显著(P>0.05),而25/35 ℃处理下的发芽率最低(图2)。Na2SO4浓度为0~50 mmol·L-1时,10/20 ℃和15/25 ℃处理下的黄花苜蓿种子均能良好发芽,发芽率均在80%以上,并且与对照之间差异不显著(P>0.05)。此后,随盐浓度升高发芽率明显降低。而25/35 ℃处理下,Na2SO4浓度为25 mmol·L-1时发芽率与对照相比显著降低了82.6%(P<0.05)(图2)。
Na2CO3胁迫条件下,黄花苜蓿在10/20 ℃和15/25 ℃处理下发芽率最高,两者之间差异不显著(P>0.05),而25/35 ℃温度下发芽率最低(图3)。温度为10/20 ℃和15/25 ℃时,在0~25 mmol·L-1的Na2CO3溶液中,黄花苜蓿均能良好发芽,并且与对照之间差异不显著(P>0.05)(图3)。而在25/35 ℃下,黄花苜蓿发芽率随Na2CO3浓度升高明显降低,15~25 mmol·L-1下,与对照差异显著(P<0.05,图3)。
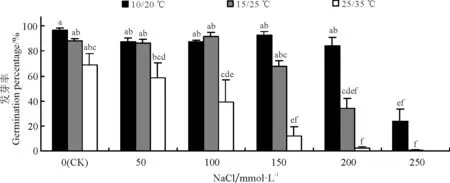
图1 NaCl胁迫与温度对黄花苜蓿发芽率的影响
注:不同字母表示不同处理间差异显著(P<0.05)。下同。
Note: Different letters indicate significant difference between treatments at 0.05 level. The same below.
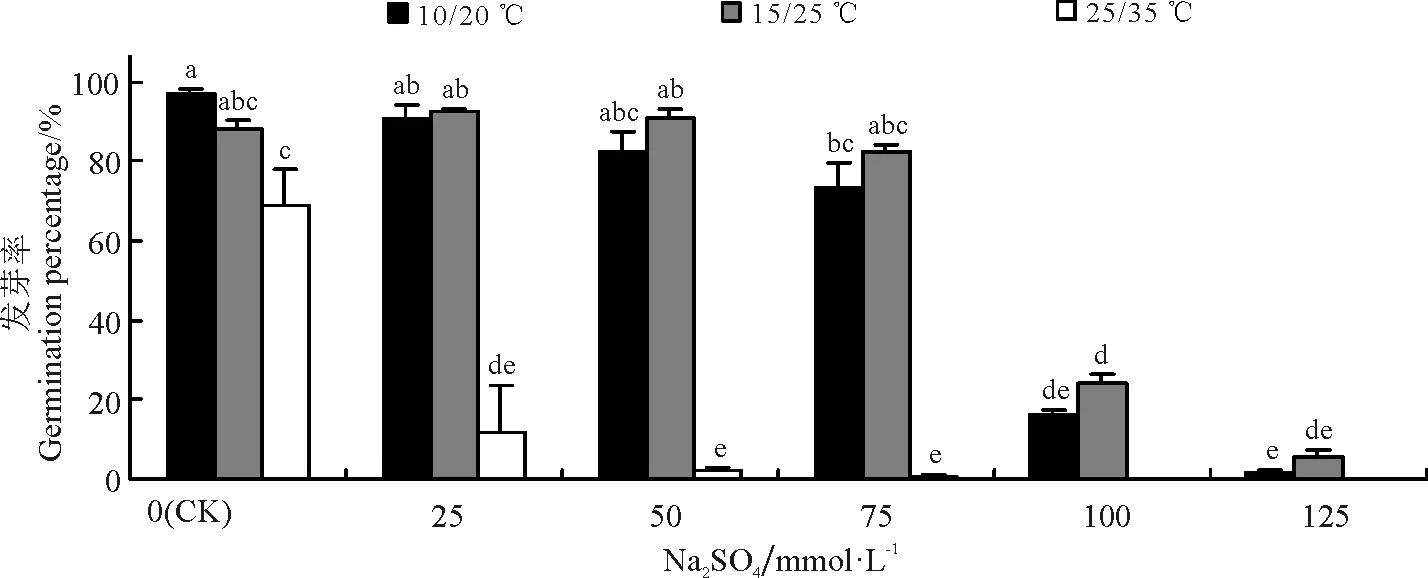
图2 Na2SO4胁迫与温度对黄花苜蓿发芽率的影响
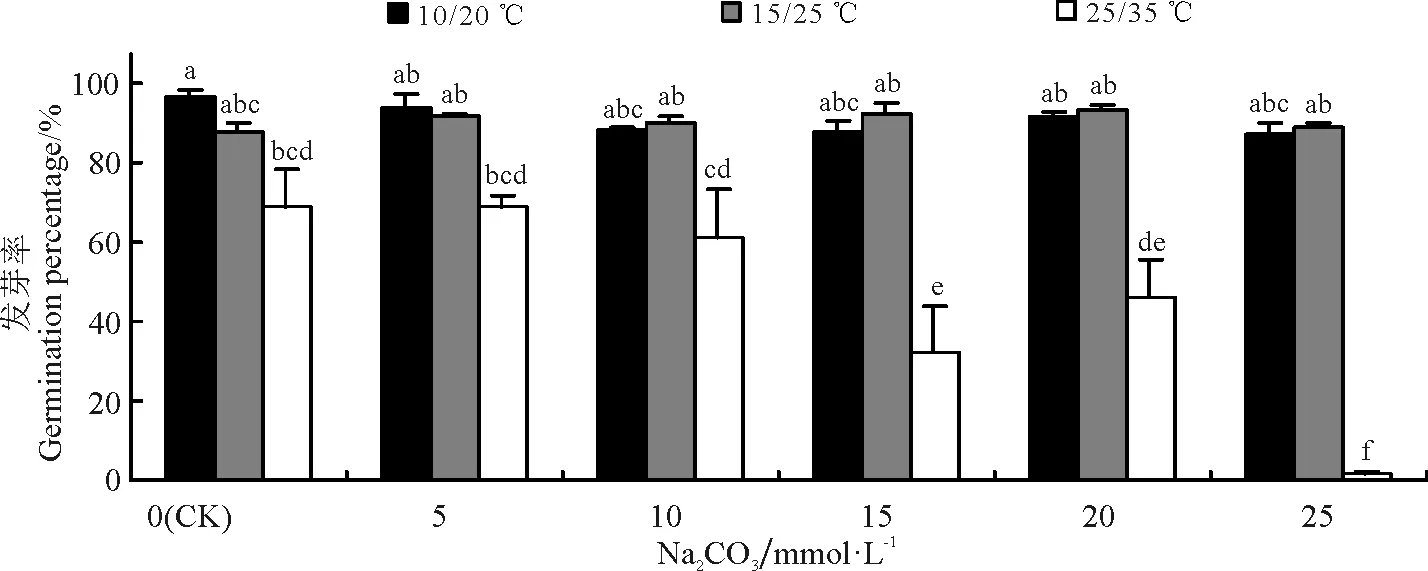
图3 Na2CO3胁迫与温度对黄花苜蓿发芽率的影响
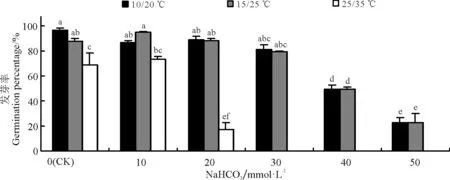
图4 NaHCO3胁迫与温度对黄花苜蓿发芽率的影响
所有的NaHCO3浓度处理下,10/20 ℃和15/25 ℃温度下发芽率均较高,同一浓度处理下两者之间没有显著差异(P>0.05),在胁迫浓度达到40 mmol·L-1时,发芽率较0~30 mmol·L-1开始显著降低(P<0.05)。而25/35 ℃温度下发芽率最低,胁迫浓度为20 mmol·L-1时,发芽率即降至17.5%(图4)。
2.2 盐、碱与温度对黄花苜蓿发芽速度的影响
盐、碱与温度及其交互作用均显著影响黄花苜蓿种子的发芽速度(P<0.001,表1)。与发芽率的趋势相似,整体上两种中性盐NaCl和Na2SO4的处理下,种子发芽速度随着盐浓度的增加而下降,盐浓度的升高与发芽速度呈显著负相关关系(P<0.05,图5)。相同浓度NaCl处理下,10/20 ℃温度下发芽速度最大,其次是15/25 ℃处理的;而Na2SO4处理下,15/25 ℃温度下整体的发芽速度要大于10/20 ℃的处理(图5)。
两种碱性盐处理下,10/20 ℃温度下种子的发芽速度整体要大于15/25 ℃温度下的处理(图6)。Na2CO3在0~25 mmol·L-1的各个浓度处理下,发芽速度都很快;而 NaHCO3处理下,种子发芽速度呈现随盐浓度升高而降低的趋势。除15/25 ℃的
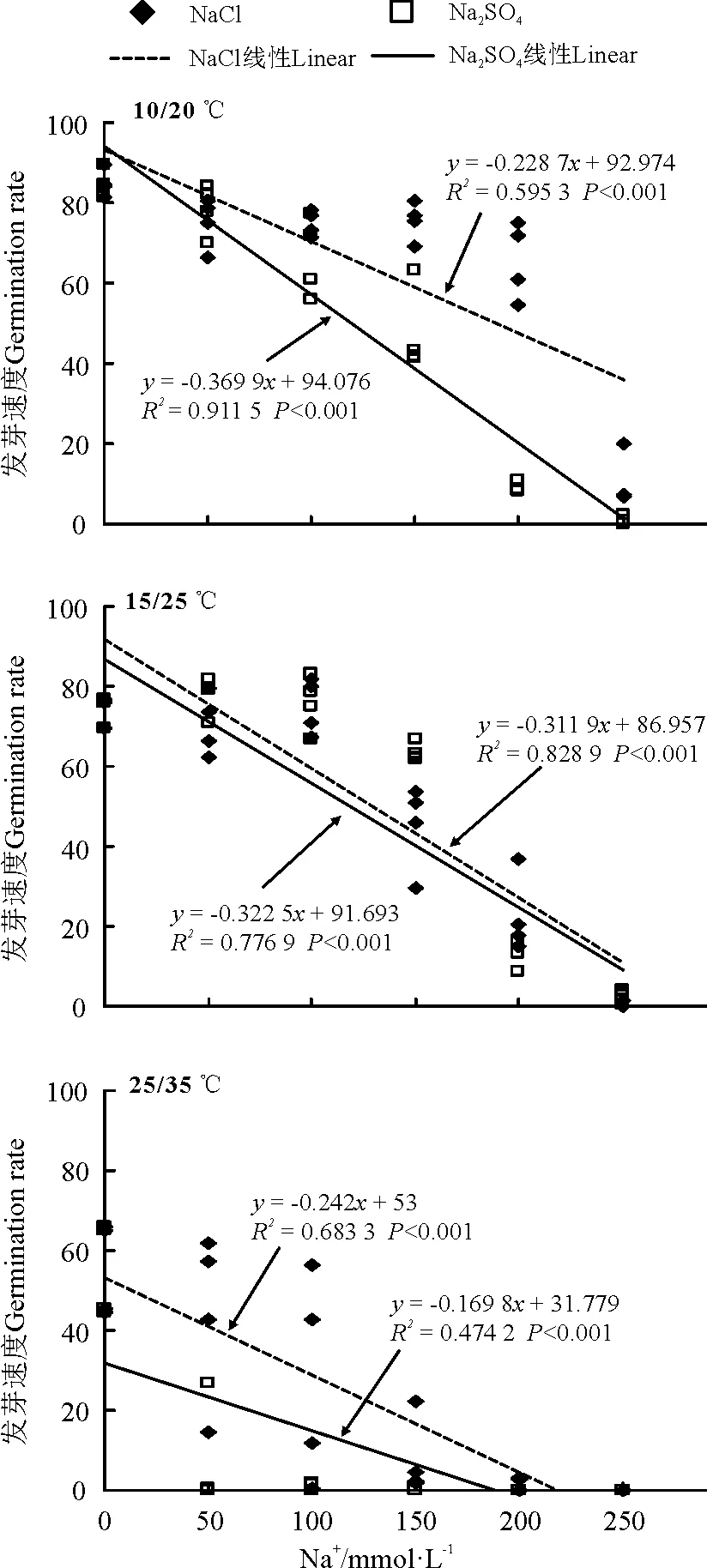
图5 中性盐与温度对黄花苜蓿发芽速度的影响
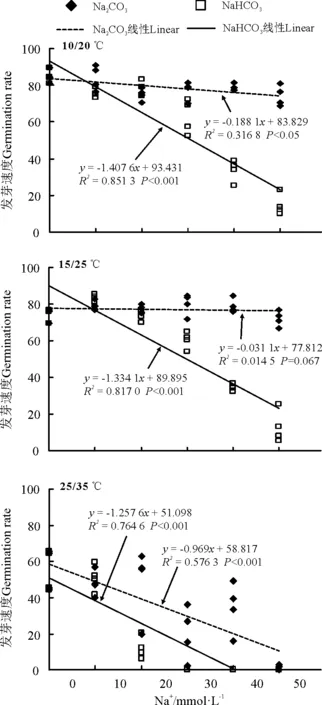
图6 碱性盐与温度对黄花苜蓿发芽速度的影响
Na2CO3的温盐组合外,两种碱性盐浓度的升高与发芽速度均呈显著的负相关关系(P<0.05)。而25/35 ℃显著抑制了各处理下黄花苜蓿种子的发芽速度(图5,图6)。
3 讨论与结论
温度是调控种子发芽的主要生态因子之一,王俊杰等[17]在呼伦贝尔野生黄花苜蓿种子生物学特性的研究中指出,黄花苜蓿种子萌发的适宜温度为15~25 ℃。本研究也表明,蒸馏水中黄花苜蓿种子的发芽率和发芽速度在10/20 ℃下达到最大值,盐、碱胁迫下发芽率和发芽速度在10/20 ℃或15/25 ℃处理下最高,并且两者之间差异不显著。25/35 ℃高温显著抑制了各个处理下黄花苜蓿种子发芽(P<0.05)。
有研究指出,盐、碱和温度的交互作用对种子发芽率和发芽速度均存在显著影响[7,18],也有研究结果表明,温度与中性盐的交互作用对小麦(Triticumaestvum)发芽率和发芽速度影响不显著,而温度与碱性盐的交互作用则对小麦种子的发芽率和发芽速度有显著影响[4]。本研究的结果也显示,盐、碱与温度及其交互作用对黄花苜蓿种子发芽率和发芽速度都有显著的影响(P<0.001)。不同盐碱处理下,种子最适温度区间不同,而且同样的胁迫浓度下,不同温度之间种子发芽情况显著不同,这说明高温与盐、碱交互作用对种子萌发产生了双重胁迫,加剧了对种子萌发的抑制作用。
适宜温度下,黄花苜蓿种子发芽率和发芽速度在蒸馏水中最大,但是在低浓度的盐胁迫下也具有很高的发芽率和发芽速度,与对照相比差异不显著,随着盐浓度的逐渐升高,发芽率和发芽速度开始显著降低,这与前人对其他植物的研究结果相似[7,19]。本研究结果显示,较低的相同Na+离子浓度下(50 mmol·L-1),10/20 ℃和15/25 ℃处理下的种子发芽率和发芽速度表现为Na2SO4>NaCl>Na2CO3>NaHCO3,但是除了NaHCO3溶液中种子发芽率和发芽速度显著低于其他3种盐溶液中的(P<0.001),其他三者之间差异并不显著(P>0.05)。而较高盐浓度下(>100 mmol·L-1),NaCl处理下黄花苜蓿整体的发芽率和发芽速度都要显著高于Na2SO4(P<0.05),同时,高温(25/35 ℃)对Na2SO4处理下种子发芽率和发芽速度的抑制程度也要明显高于对NaCl的(P<0.05)。植物对不同的盐分的响应具有种间的特异性,如Zhang等[20]的研究指出,大部分盐生植物在NaCl溶液中的发芽率要高于在Na2SO4和NaHCO3的,但是盐爪爪(Kalidiumfoliatum)和红叶藜(Chenopodiumrubrum)在NaHCO3中的发芽率和发芽速度最大,而与Na2SO4相比,异子蓬(Borszozowiaaralocaspica)的发芽受到NaCl和NaHCO3的抑制程度更严重。而马亚丽等[21]对苜蓿(Medicagofalcata)的研究结果表明,同等盐浓度下,NaCl盐胁迫下苜蓿的发芽势和发芽率下降的速度较Na2SO4快。
中性盐通过渗透胁迫和离子效应对种子的萌发进行抑制,而碱性盐胁迫除了与中性盐胁迫相同的抑制效应外,还会产生较高的 pH 并造成离子的失衡[4,22]。本研究结果也表明,与中性盐NaCl和Na2SO4相比,碱性盐NaHCO3对黄花苜蓿种子发芽的抑制更强,在40 mmol·L-1的浓度下,发芽率就降为50%以下。管博[23]的研究表明,在25 mmol·L-1Na2CO3处理下,花苜蓿(M.ruthenica)的发芽率不到20%,并认为这主要是由于CO32-离子或者是高pH的胁迫导致的。而本研究发现,适宜温度下,黄花苜蓿在25 mmol·L-1的Na2CO3(pH约为11.4)处理下发芽率仍可超过85%,在30 mmol·L-1的NaHCO3(pH约为10.3)处理下发芽率仍可达到80%,并且发芽速度也较快,这说明黄花苜蓿可能对高pH的碱性胁迫有较好的耐受性。
本研究表明,中性盐和碱性盐对黄花苜蓿种子发芽均产生抑制效应,而碱性盐的危害更大。温度与中性盐和碱性盐的互作同样对黄花苜蓿种子发芽特性产生显著影响。黄花苜蓿在10/20 ℃和15/25 ℃下均能良好发芽,而25/35 ℃的高温显著抑制了各个处理下黄花苜蓿的种子萌发(P<0.05),并且加剧了盐、碱胁迫对种子萌发的抑制作用。黄花苜蓿对碱性盐和高pH有一定的耐受性,在25 mmol·L-1的 Na2CO3和30 mmol·L-1的NaHCO3处理下均能发芽。本研究为黄花苜蓿种子发芽阶段的抗逆生理学和生产实践中黄花苜蓿在盐碱地改良中的应用提供了一定的理论依据。
[1] Wei W,Bilsborrow P E,Hooley P,Fincham D A,Lombi E,Forster B P.Salinity induced differences in growth,ion distribution and partitioning in barley between the cultivar Maythorpe and its derived mutant Golden Promise[J].Plant and Soil,2003,250(2):183-191.
[2] 高战武,蔺吉祥,邵帅,盛后财,范春燕,屈吉宁.复合盐碱胁迫对燕麦种子发芽的影响[J].草业科学,2014,31(3):451-456.
[3] 祝廷成.羊草生物生态学[M].长春:吉林科学技术出版社,2004:539-542.
[4] 蔺吉祥,李晓宇,唐佳红,王俊锋,李卓琳,张兆军,穆春生.温度与盐、碱胁迫交互作用对小麦种子萌发的影响[J].作物杂志,2011(6):113-116.
[5] 谢振宇,杨光穗.牧草耐盐性研究进展[J].草业科学,2003,20(8):11-17.
[6] Grime J P,Campbell B D.Growth rate,habitat productivity,and plant strategy as predictors of stress response[A].Mooney H A,Winner W E,Pell E J,Chu E.Response of Plants to Multiple Stresses[M].San Diego,London:Academic Press,1991:143-159.
[7] Guan B,Zhou D W,Zhang H X,Tian Y,Japhet W,Wang P.Germination responses ofMedicagoruthenicaseeds to salinity,alkalinity,and temperature[J].Journal of Arid Enviroments,2009,73:135-138.
[8] Tobe K,Li X,Omasa K.Effects of sodium,magnesium and calcium salts on seed germination and radical survival of a halophyte,Kalidiumcapsicum(Chenopodiaceae)[J].Australian Journal of Botany,2002,50:163-169.
[9] 杨春武,李长有,张美丽,刘杰,鞠淼,石德成.盐、碱胁迫下小冰麦体内的pH及离子平衡[J].应用生态学报,2008,19(5):1000-1005.
[10] Huang J,Reddman R E.Salt tolerance ofHordeumandBrassicaspecies during germination and early seedling growth [J].Canadian Journal of Plant Science,1995,75:815-819.
[11] Welbaum G E,Tissaoui T,Bradford K J.Water relations of seed development and germination in muskmelon (CucumismeloL.) Ⅲ.Sensitivity of germination to water potential and abscisic acid during development[J].Plant Physiology,1990,92(4):1029-1037.
[12] 岳秀泉,周道玮.黄花苜蓿的优良特性与开发利用[J].吉林畜牧兽医,2004(8):26-28.
[13] 赵淑芬,王宗礼,孙启忠,闫志坚,李志勇.内蒙古农牧交错带饲草资源饲用价值评价[J].中国草地,2005,27(3):49-52.
[14] 王俊杰.中国黄花苜蓿野生种质资源研究[D].呼和浩特:内蒙古农业大学博士学位论文,2008:107-116.
[15] 田雨,武祎,郑伟,张红香,周道玮.黄花苜蓿种质发芽及早期生长对NaCl胁迫的响应[J].中国草地学报,2009,31(6):25-29.
[16] 秦峰梅,张红香,武祎,周道玮.盐胁迫对黄花苜蓿发芽及幼苗生长的影响[J].草业学报,2010,19(4):71-78.
[17] 王俊杰,孙伯丽,金雄,吴建民,晓红.呼伦贝尔野生黄花苜蓿种子生物学特性研究[J].内蒙古农业大学学报,2005,26(2):5-7.
[18] 蔺吉祥,李晓宇,张兆军,王俊锋,李卓琳,张兆军,穆春生.温度与盐碱胁迫交互作用对羊草种子萌发与幼苗生长的影响[J].草地学报,2011,19(6):1005-1009.
[19] Khan M A,Rizvi Y.Effect of salinity,temperature,and growth regulators on the germination and early seedling growth ofAtriplexgriffithiivar.stocksii[J].Canadian Journal of Botany,1994,72:475-479.
[20] Zhang H X,Zhang G M,Lü X T,Zhou D W,Han X G.Salt tolerance during seed germination and early seedling stages of 12 halophytes[J].Plant and Soil,2015,388(1-2):229-241.
[21] 马亚丽,阿不来提·阿不都依木,孙宗玖,赵清,李培英.NaCl,Na2SO4胁迫对苜蓿种子发芽及幼苗生长的影响[J].新疆农业大学学报,2005,28(4):20-23.
[22] Campbell S A,Nishio J N.Iron deficiency studies of sugar beet using an improved sodium bicarbonate-buffered hydroponics growth system[J].Journal of Plant Nutrition,2000,23:741-757.
[23] 管博.花苜蓿发芽及早期幼苗阶段的抗逆性研究[D].长春:东北师范大学硕士学位论文,2008:17-18.
(责任编辑 武艳培)
Effects of salinity, alkalinity, temperature and their interactions on seed germination ofMedicagofalcata
WU Yi1, TIAN Yu2, ZHANG Hong-xiang3, YANG Jian2, WU Zhi-hong4
(1.Jilin Provincial Institute of Education, Changchun 130022, China; 2.Animal Science and Technology College, Jilin Agricultural University, Changchun 130118, China; 3.Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130012, China; 4.College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
In the present study, the effects of salinity, alkalinity, temperature and their interactions on seed germination ofMedicagofalcatawere evaluated by treated with two neutral salts (NaCl, Na2SO4), two alkaline salts(Na2CO3, NaHCO3), and three alternating temperature(10/20 ℃, 15/25 ℃ and 25/35 ℃). The results showed that seed germination percentage and germination rate were significantly affected (P<0.05) by salinity, alkalinity, temperature and their interactions. The seed germination percentage and germination rate were the highest under treatments at 10/20 ℃ or 15/25 ℃, and there was no significant difference between them. The seed germination percentage and germination rate decreased with the increasing of salinity and alkalinity concentrations and the deleterious effect of alkali stress was more severe than salt stress. Seed germination was significantly inhibited by treatment at 25/35 ℃ which also aggravated the inhibition of alkali and salt stress on seed germination.M.falcatahad some tolerance to alkaline salts and high pH which germinated well under 25 mmol·L-1Na2CO3and 30 mmol·L-1NaHCO3treatments.
salt stress; alkali stress; temperature;Medicagofalcata; seed germination
TIAN Yu E-mail:tiany0115@163.com
10.11829j.issn.1001-0629.2015-0317
武祎,田雨,张红香,杨健,吴志红.盐、碱胁迫与温度对黄花苜蓿种子发芽的影响[J].草业科学,2015,32(11):1847-1853.
WU Yi,TIAN Yu,ZHANG Hong-xiang,YANG Jian,WU Zhi-hong.Effects of salinity,alkalinity,temperature and their interactions on seed germination ofMedicagofalcata[J].Pratacultural Science,2015,32(11):1847-1853.
2015-06-08 接受日期:2015-07-24
吉林省高校科研春苗人才培育计划项目——盐碱及温度对黄花苜蓿种子发芽、幼苗生长和离子调节的影响(2013408)
武祎(1982-),女(满族),吉林长春人,讲师,博士,主要从事豆科牧草生理生态研究。E-mail:wy1610@163.com
田雨(1983-),女,吉林长春人,讲师,博士,主要从事种子逆境生理生态研究。E-mail:tiany0115@163.com
S551+.703.3;Q945.78
A
1001-0629(2015)11-1847-07
