基于聚集诱导荧光性质的免标记DNA四链体检测以及凝血酶的传感研究
2015-01-05张关心张德清
汪 铭,张关心,张德清
(中国科学院 化学研究所 有机固体实验室,北京100190)
DNA作为遗传物质,一个很重要的性质就是DNA具有结构多样性,双螺旋为DNA最常见的结构形式,它的稳定性为遗传信息的可靠性提供了保证。但是,在某些情况下,DNA也存在一些较为特殊的结构,如三螺旋、四螺旋、分支结构等,它们的存在使DNA体现出独特的功能特性,并使遗传进化成为可能。四链体DNA是一类更为特殊的二级结构,主要包括由富含鸟嘌呤(G)的序列形成的 G-四联体(G-quadruplex)和富含胞嘧啶(C)的序列形成的i-motif四聚体两种。G-四联体的基本单元是被称为G-四联体的四个G的平面环状配对,多个G-四联体通过平面堆积形成层状的G-四联体。形成G-四联体必须具有重复G序列的DNA链,并需要K+、Na+等正离子与G配位以稳定整体结构。研究表明,G-四联体的形成可以抑制端粒酶的活性,而端粒酶与很多肿瘤细胞内端粒的延伸有密切关系。因此发展能诱导G-四联体的形成从而实现抑制端粒酶生长的药物被认为在治疗癌症、HIV和其他疾病方面具有重要的应用前景。也就是说,发展简单、快捷的G-四联体结构的高效检测方法具有十分突出的重要意义[1-3]。
目前,研究人员已经发展了多种方法用于检测DNA由单链向G-四联体发生的结构变化,如:X-射线衍射、NMR、圆二色谱和荧光光谱等。其中以利用荧光光谱检测G-四联体结构最为方便,而且灵敏度高。大多数已发展的荧光方法都需要用化学方法对DNA进行荧光标记[4]。但是荧光标记DNA的合成和纯化往往成本高、耗时长,同时,有修饰的DNA的结合力减弱等缺点。因此构建免标记荧光分析方法用于检测G-四联体构型变化以及G-四联体稳定剂的筛选,显得更具有应用前景。
最近,一类特殊的荧光分子受到关注,这类分子在溶液状态下的荧光强度很弱,但是在聚集状态下却呈现很强的荧光。这一现象被称之为聚集诱 导 荧 光 性 质 (Aggregation-induced Emission AIE)[5,6]。AIE 性质为高效化学/生物传感体系的构建提供了一个崭新的途径。利用AIE荧光特性,研究人员已经发展了一系列高效的荧光传感器[6-9]。例如,唐本忠等报道了系列聚集诱导荧光性质在DNA分析检测中的应用。他们利用正电性的四苯乙烯分子与小牛胸腺DNA(ctDNA)之间的静电作用形成了聚集体产生增强的荧光信号检测ctDNA[10]。进一步利用富含G序列的DNA在单链和四链结构时与四苯乙烯分子不同的作用方式,实现了DNA结构的检测[11]。
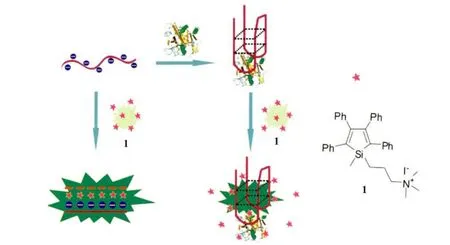
图1 化合物1的结构式和检测原理示意图
本课题组在构筑基于AIE性质的化学/生物传感器方面也开展了一系列的工作[7]。例如,我们利用具有聚集诱导荧光性质的带正电荷硅杂环戊二烯衍生物(1-甲基-1-(3-三甲氨基)丙基-2,3,4,5-四苯基硅杂环戊二烯碘盐,化合物1)与DNA分子通过静电作用,形成聚集体,从而荧光增强这一现象,发展了高效的无标记DNA荧光传感和核酸酶活性分析方法[12]。基于这一研究结果,我们进一步将化合物1应用于免标记DNA四链体的检测和凝血酶的荧光分析,其检测原理如图1所示:(1)单 链 DNA-Thrombin binding aptamer(TBA)是凝血酶的适配体,富含鸟嘌呤。在钾离子和凝血酶的作用下,其能形成G-四联体构型。形成G-四联体前,TBA能与化合物1通过静电和疏水作用形成聚集体,溶液荧光显著增强;(2)而当TBA形成G-四联体后,化合物1与G-四联体构型同样作用形成聚集。但是其聚集程度相对减弱,因为化合物1和G-四链体作用能力降低,部分1不能和DNA作用而重新成为分散状态,因此体系荧光增强较少。基于这一荧光的差异,我们可以实现对G-四联体结构的检测和凝血酶荧光分析。
1 实验部分
1.1 试剂和仪器
化合物1参考前期工作制备[12]。凝血酶(Humanα-Thrombin)购自 Haematologic Technologies Inc,溶菌酶(Lysozyme)购自拜尔迪公司,单链 DNA [Thrombin Binding Aptamer(TBA):5′-GGTTGGTGTGGTTGG-3′;N-Thrombin Binding Aptamer(N-TBA):5′-GGTG GTGGTTGTGGT-3′]由英骏公司(Invitrogen,China)合成并用PAGE方法纯化。
紫外可见(UV-Vis)光谱在(Hitachi U-3010型)紫外可见光谱仪在测试,荧光光谱测试在(Hitachi F-4500型)光谱仪上进行,CD光谱在JASCO J-815型圆二色谱仪上测试。所有光谱测试均在Tris(三羟甲基氨基甲烷)缓冲溶液(10mmol/L,pH=7.4)中进行,未经说明均在25℃下测试。
1.2 基于分子1的G-四链体荧光检测
TBA和 N-TBA的储备液(2×10-5mol/L)分别与100mmol/L的钾离子溶液混合后室温放置15min。然后分别取不同的量的该混合液向加入到1mL的化合物1(4.0×10-5mol/L)的 Tris缓冲溶液(10mmol/L,pH=7.4)中,混匀后测试荧光光谱。对于其它的金属离子的选择性,用100mmol/L的钠离子、锂离子分别代替前述的钾离子与TBA溶液进行同样的操作。
1.3 基于核酸适配体的凝血酶荧光传感研究
向600μLTris缓冲溶液(20mmol/L,pH =7.4)中加入0.6nmol TBA,然后分别加入不同浓度的thrombin溶液(0.0~0.48nmol),混合溶液于25℃下孵育15min后,加入400μL化合物1的储存溶液(10-4mol/L),摇匀后测试荧光光谱。
在凝血酶选择性检测实验中,0.6nmol NTBA 与凝血酶(0.48nmol)或者0.6nmol TBA与溶菌酶(0.48nmol),在600μLTris缓冲溶液中孵育15min后,分别加入400μL化合物1的储存溶液(10-4mol/L),摇匀后测试荧光光谱。
2 结果与讨论
如图2所示,当不同量的钾离子稳定的DNA四链体溶液加入化合物1的溶液(4.0×10-5mol/L)中时,溶液的荧光逐渐增强。当加入的DNA浓度达到720nmol/L时,荧光强度(467nm)约增加了32倍,这表明钾离子稳定的DNA四链体与分子1通过静电作用形成了聚集体,从而产生增强的荧光信号。但是,进一步发现没有经过钾离子处理的TBA加入后具有更明显的荧光增强。如图3所示,单链结构的荧光比四链体的荧光约高35%。造成这一荧光差异的可能原因如下:未加入钾离子的TBA是无规卷曲的,其磷酸根阴离子与化合物1的阳离子充分作用,使得化合物1可以充分地聚集,从而荧光增强。反之,当TBA在钾离子的作用下形成刚性的四链体结构时,分子1和G-四链体作用力降低,使得部分分子1不能和DNA作用而重新成为分散状态,因而具有弱的聚集态荧光。
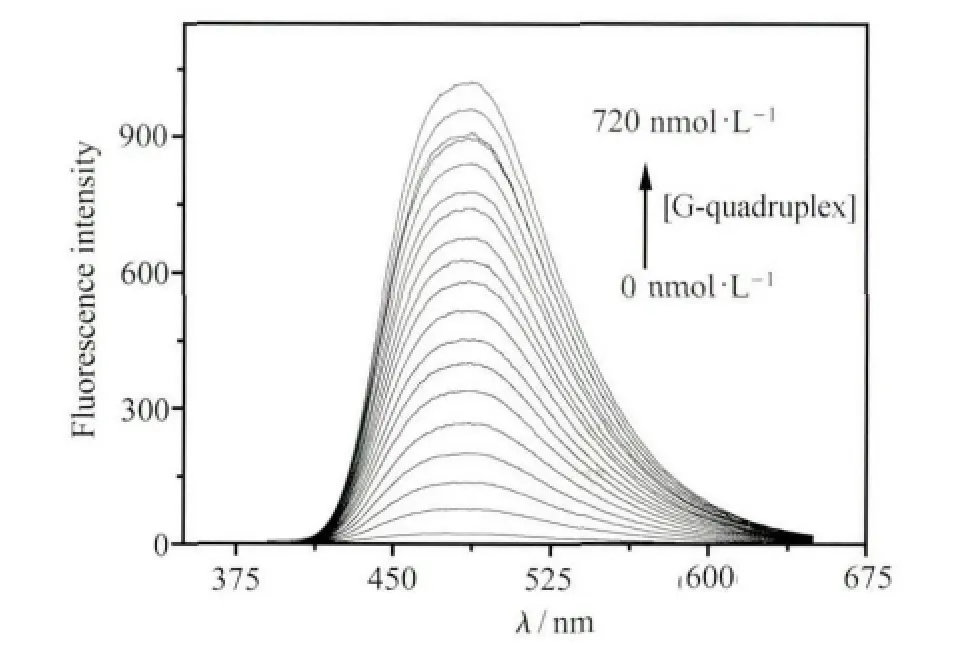
图2 化合物1溶液(4.0×10-5 mol/L,10mmol/L tris缓冲溶液中,pH=7.4))荧光光谱与不同浓度G-四链体作用后的荧光光谱
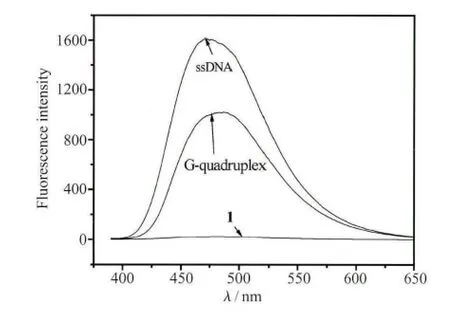
图3 化合物1溶液(4.0×10-5 mol/L,10mmol/L Tris缓冲溶液中,pH=7.4)在加入相同浓度(720nmol/L)单链DNA和四链DNA后的荧光比较
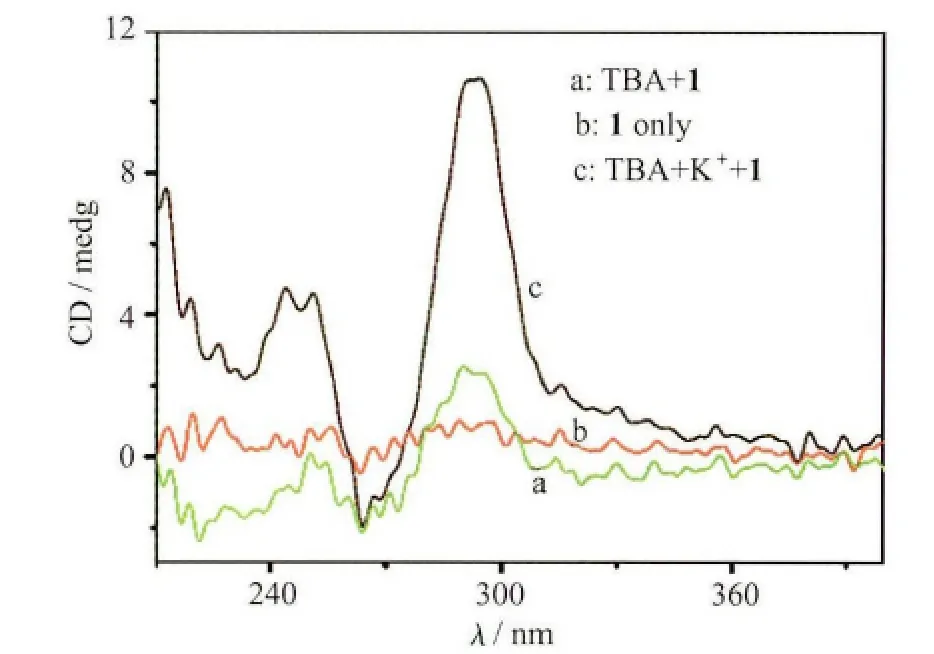
图4 单链TBA(10μmol/L)经过钾离子(10mmol/L)作用前后加入到化合物1溶液(4.0×10-5 mol/L)中CD光谱变化
CD光谱也证明了,单链TBA和经过钾离子处理前后加入化合物1溶液中产生的荧光信号差别,是由于钾离子诱导单链TBA形成了G-四链体所致。如图4所示,化合物1溶液在200~300nm范围内没有CD信号,单链TBA(10μmol/L)时在这一范围内也仅有较弱的CD信号,而当单链TBA(10μmol/L)经过钾离子(10mmol/L)处理后加入化合物1溶液,则在295nm和264nm处分别出现了较强的 CD 信号峰,根据文献报道[1-3],这种CD光谱的变化是由于TBA由单链形成G-四链体结构所致。而且进一步表明分子1的加入对G-四链体结构的稳定性没有明显影响。
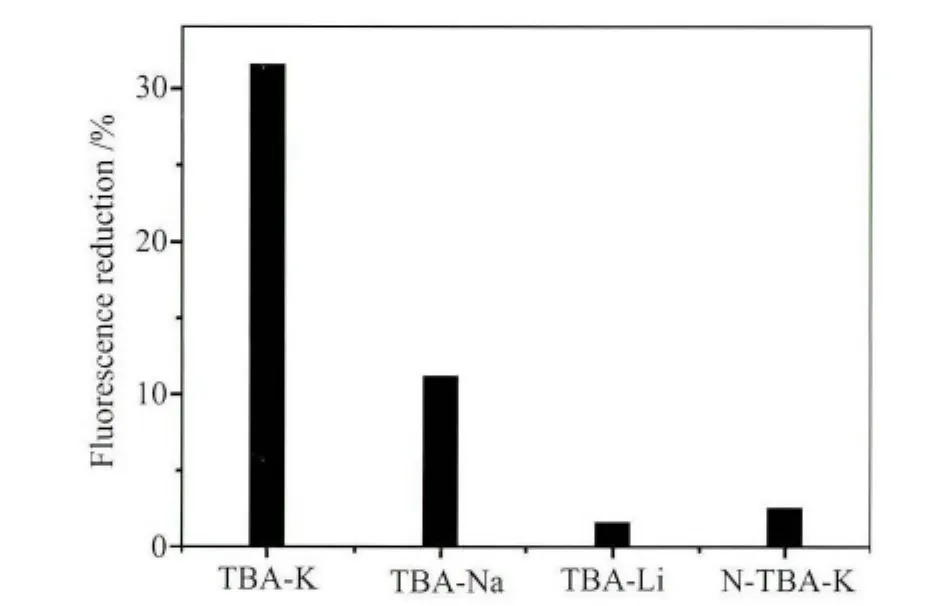
图5 单链TBA(600nmol/L)和不同金属离子(浓度均为100mmol/L)以及 N-TBA(600nmol/L)和钾离子(100mmol/L)作用,加入化合物1溶液(4.0×10-5 mol/L,10mmol/L tris缓冲溶液中,pH =7.4)后荧光强度的变化(荧光在470nm处监测)
随后,我们考察了除钾离子外其它的金属离子(如锂离子和钠离子)的影响,以及与非TBA序列的DNA(N-TBA)的影响。如图5所示,当锂离子、钠离子分别和TBA作用后,加入化合物1溶液(4×10-5mol/L)后溶液荧光则表现出不同的结果。比如当TBA与钠离子作用后加入化合物1溶液中,与未经钠离子作用的TBA加入化合物1溶液相比,荧光强度降低了19%。而锂离子的加入则对荧光强度基本没有影响。这表明TBA和钾离子之间的结合作用具有高度选择性,而锂离子和钠离子与TBA之间的结合作用非常弱,不能形成稳定的G-四链体结构,因此溶液的荧光没有变化不大[3,11]。同时,我们考察了非 TBA序列DNA的影响。N-TBA具有与TBA相同的链长的单链DNA,与TBA不同的是碱基序列的区别。如图5所示,当N-TBA代替TBA,和钾离子作用后加到化合物1溶液中,体系的荧光强度没有明显的变化,表明钾离子不能诱导N-TBA形成G-四链体,因此与化合物1作用后无明显的荧光变化。以上的研究表明我们所设计的无标记荧光分析方法可以有效地应用于G-四链体的检测。
基于上述结果,我们进一步将该检测体系拓展到基于核酸适配体(aptamer)的蛋白质传感器研究。由于核酸适配体在其特异性靶标的作用下可以发生DNA构型的转变,例如单链TBA和凝血酶作用后DNA结构即转变为四链体结构[13,14]。因此,利用分子1与单链和四链结构不同的荧光强度就可以实现凝血酶的检测。
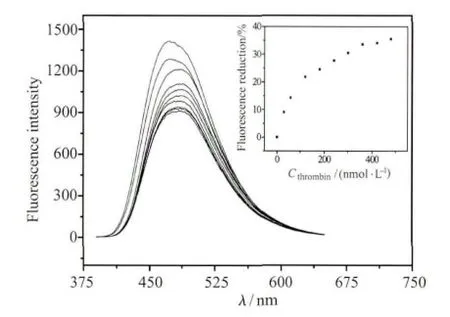
图6 化合物1溶液(4.0×10-5 mol/L,10mmol/L Tris缓冲溶液中,pH=7.4)在加入与不同浓度凝血酶(0~0.48μmol/L)作用后的TBA溶液的荧光光谱内插图显示的是不同凝血酶浓度所对应的荧光降低程度
如图6所示,TBA(600nmol/L)和凝血酶作用之后加入到化合物1溶液(4.0×10-5mol/L)后,体系的荧光强度较不含凝血酶的TBA体系明显降低,并且荧光强度的降低程度与加入的凝血酶的量有直接关系。当向TBA溶液中加入的凝血酶浓度达到480nmol/L时,TBA/1混合溶液的荧光强度(470nm)比没有加入凝血酶的TBA/1混合溶液降低了35%(见图6插图)。CD光谱也进一步证明了上述荧光降低的过程伴随着凝血酶与TBA作用形成DNA四链体结构。如图7所示,化合物1溶液(4.0×10-5mol/L)和凝血酶(0.8μmol/L)在200~300nm 范围内几乎没有CD信号,向化合物1溶液中加入TBA(10μmol/L)时也仅产生较弱的CD信号,但是当TBA(10 μmol/L)与凝血酶(0.8μmol/L)作用后再加入化合物1溶液,在295nm处的信号明显增强,这种CD光谱的变化表明凝血酶诱导单链TBA形成了G-四链体结构,而且分子1对G-四链体结构的稳定性也没有明显的影响。因此,利用化合物1和TBA可以构筑新型的凝血酶荧光分析方法。
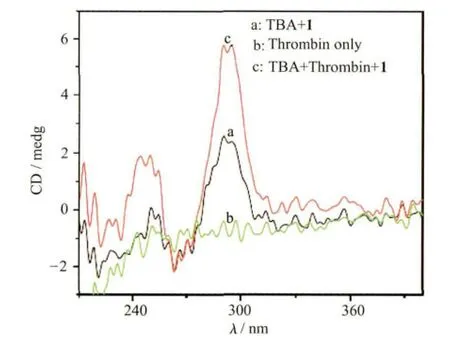
图7 TBA(10μmol/L)与凝血酶(0.8μmol/L)作用前后加入到化合物1溶液(4×10-5 mol/L)中的CD光谱变化
在进一步的研究中,我们分别选用溶菌酶作为蛋白以及其它序列的DNA(如N-TBA)作为参比,考察了该凝血酶检测方法的选择性。TBA(600nmol/L)和凝血酶(480nmol/L)作用15min后加入化合物1溶液(4.0×10-5mol/L),比 TBA(600nmol/L)和化合物1溶液的荧光强度(470nm)降低35%,而当 TBA(600nmol/L)和溶菌酶(480nmol/L)或者 N-TBA(600nmol/L)与凝血酶(480nmol/L)在相同条件下作用后,加入化合物1溶液中,则只能使溶液荧光发生很小的变化。这一实验结果表明所建立的荧光检测方法具有高的选择性,同时也证明了核酸适配体和其靶标之间的特异性作用。
3 结论
具有聚集诱导荧光性质的化合物1与富含G的DNA的单链或四链体结构通过静电作用后都能发生聚集,从而使体系荧光增强,但是二者的荧光强度具有明显的差异。因此,利用二者的荧光差异可以有效地区分单链和四链体结构,即利用化合物1发展了一种免标记的G-四链体检测方法。进一步研究表明该检测方法可以应用于凝血酶的荧光分析。
[1] Williamson J R,Raghuraman M K,Cech T R.Monovalent cation-induced structure of telomeric DNA:The G-quartet model[J].Cell,1989,59(5):871-880.
[2] Panyutin I G,Kovalsky O I,Budowsky E I,Dickerson R E,Rikhirev M E,Lipanov A A.G-DNA:a twice-folded DNA structure adopted by single-stranded oligo(dG)and its implications for telomeres[J].Proceeding of the National Academy of Sciences of the United States of America,1990,87(3):867-870.
[3] Jeffery T D.G-Quartets 40Years Later:From 5prime-GMP to molecular biology and supramolecularchemistry [J].Angewandte Chemie International Edition,2004,43(6):668-698.
[4] Juskowiak,B.Analytical potential of the quadruplex DNA-based FRET probes[J].Analytica Chemica Acta,2006,568(1-2):171-180.
[5] Luo J D,Xie Z L,Lam J W Y,Cheng L,Chen H Y,Qiu C F,Kwok H S,Zhan X W,Liu Y Q,Zhu D B,Tang B Z.Aggregation-induced emission of 1-methyl-1,2,3,4,5pentaphenylsilole[J].Chemical Communications,2001,(18):1740-1741.
[6] Qin A J,Tang B Z.Aggregation-Induced Emission:Applications[M].John Wiley and Sons Ltd.,2014.
[7] Wang M,Zhang G X,Zhang D Q,Zhu D B,Tang B Z.Fluorescentbio/chemosensors based on silole and tetraphenyletheneluminogens with aggregation-induced emission feature[J].Journal of Materials Chemistry,2010,20(10):1858-1867.
[8] 夏 晶,吴燕梅,张亚玲,佟 斌,石建兵,支俊格,董宇平.具有聚集诱导发光特性的四苯基乙烯的研究进展[J].影像科学与光化学,2012,30(1):9-25.Xia J,Wu Y M,Zhang Y L,Tong B,Shi J B,Zhi J G,Dong Y P.Recent progress of tetraphenylethenes with aggregation-induced emission [J].Imaging Science and Photochemistry,2012,30(1):9-25.
[9] 冷鸿飞,吴文辉.具有聚集诱导发光性能的乙烯基衍生物的合成及其对DNT的检测[J].影像科学与光化学,2012,30(3):182-189.Leng H F,Wu W H.Synthesis of the vinyl derivatives with aggregation induced emission effect and their application to the detection of DNT [J].Imaging Science and Photochemistry,2012,30(3):182-189.
[10] Tong H,Hong Y N,Dong Y Q,Haussler M,Lam J W Y,Li Z,Guo Z F,Guo Z H,Tang B Z.Fluorescent“light-up”bioprobes based on tetraphenylethylene derivatives with aggregation-induced emission characteristics[J].Chemical Communications,2006,(35):3705-3707.
[11] Hong Y N,Haussler M,Lam J W Y,Li Z,Sin K K,Dong Y Q,Tong H,Liu J Z,Qin A J,Renneberg R,Tang B Z.Label-free fluorescent probing of G-quadruplex formation and real-time monitoring of DNA folding by a quaternizedtetraphenylethene salt with aggregation-induced emission characteristics [J].Chemisty - A European Journal,2008,14(21):6428-6437.
[12] Wang M,Zhang D Q,Zhang G X,Tang Y L,Wang S,Zhu D B.Fluorescence turn-on detection of DNA and labelfree fluorescence nuclease assay based on the aggregationinduced emission of silole [J].Analytical Chemistry,2008,80(16):6443 6448.
[13] Bock L C,Griffin L C,Latham J A,Vermaas E H,Toole J J.Selection of single-stranded DNA molecules that bind and inhibit human thrombin [J].Nature,1992,355(6360):564-566.
[14] Pavlov V,Shlyahovsky B,Willner I,Fluorescence detection of DNA by the catalytic activation of an aptamer/thrombin complex [J].Journal of the American Chemical Society,2005,127(18):6522-6523.
[15] Joachimi A,Mayer G,Hartig J S.A new anticoagulantantidote pair:Control of thrombin activity by aptamers and porphyrins [J].Journal of the American Chemical Society,2007,129(11):3036-3037.
