过氧化氢与L-半胱氨酸对BSA-Cu体系荧光“开-关”响应及分析应用
2015-01-04廖小晴王会影李在均江南大学化学与材料工程学院食品胶体与生物技术教育部重点实验室无锡4
廖小晴王会影李在均,(江南大学化学与材料工程学院,食品胶体与生物技术教育部重点实验室,无锡4)
过氧化氢与L-半胱氨酸对BSA-Cu体系荧光“开-关”响应及分析应用
廖小晴1王会影1李在均*1,2
(江南大学化学与材料工程学院1,食品胶体与生物技术教育部重点实验室2,无锡214122)
在碱性条件下,牛血清白蛋白(BSA)与铜离子(Cu2+)形成稳定的BSA-Cu配合物,加入H2O2可显著加快铜纳米簇的形成,导致体系荧光强度迅速增加。本研究基于对BSA-Cu体系的荧光“开-关”响应,建立了测定H2O2的荧光动力学分析方法。H2O2浓度在1.0×10-6~1.5×10-3mol/L之间,荧光强度的增加与H2O2浓度呈现良好的线性关系,方法的检出限达到3.1×10-7mol/L(S/N=3);收集检测完H2O2的铜溶液,室温放置,使Cu2+完全转化为铜纳米簇,体系荧光强度逐步增加到最大,加入L-半胱氨酸产生荧光猝灭。基于对BSA-Cu体系的荧光“关”响应,建立了测定L-半胱氨酸的荧光分析方法。当L-半胱氨酸浓度在2.0×10-4~1.0×10-2mol/L范围,荧光强度随 L-半胱氨酸浓度的增加而线性下降,方法检出限为 5.7×10-5mol/L (S/N=3);废液经高温灰化和稀H2SO4溶解,可实现铜簇向Cu2+的转化,然后再按本方法进行H2O2与L-半胱氨酸的测定。利用Cu2+与铜纳米簇之间相互转化,可实现H2O2和L-半胱氨酸连续检测的循环和铜的重复利用。本方法具有灵敏、低成本和环保等优势,可广泛应用于H2O2和L-半胱氨酸的日常分析。
铜离子;铜纳米簇;荧光探针;过氧化氢;L-半胱氨酸
1 引 言
金属纳米簇是由几十到几百个原子组成的新型纳米材料。不同于金属原子、金属纳米粒子和金属单质,金属纳米簇尺寸接近电子的费米波长,可产生不连续的电子能级,表现出独特的光学、电学及化学性质[1,2]。相对于半导体量子点[3]和有机荧光染料[4],金属纳米簇不仅可产生尺寸依赖且可调的荧光,还有许多其它优良性能。例如,斯托克位移较大、荧光量子效率高和生物相容性好。目前,金属纳米簇已广泛应用于荧光检测、细胞成像和生物标记等领域[5~7]。
铜在电导率和成本方面优于贵金属,铜纳米簇的合成与应用近年受到关注。然而,铜化学活性高,对空气和水都不稳定,导致水溶性铜纳米簇的制备比贵金属纳米簇更为困难。研究表明,稳定剂是影响铜纳米簇的形成及光学性能的重要因素。目前,用于水溶性铜纳米簇合成的稳定剂有聚乙烯亚胺[8]、组氨酸[9]、半胱氨酸[10]、青霉胺[11]、谷胱甘肽[12]、DNA[13,14]、牛血清白蛋白(BSA)[15,16]、溶菌酶[17]、胰蛋白酶[18]和转铁蛋白[19]等。其中,以BSA最为常用[20]。BSA含有583个氨基酸残基、由35个半胱氨酸组成的17个二硫键和1个游离巯基。游离巯基的存在使BSA具有一定还原能力,因此BSA在铜纳米簇制备同时起到稳定剂、螯合剂和还原剂的作用。由于铜的标准电极电势低于金和银,BSA还原Cu2+生成Cu0的反应速度慢,使铜纳米簇的制备需要较长的时间。此外,制备的铜纳米簇中存在较高浓度的Cu2+,限制了它在生物、医学等领域的直接应用。最近,研究人员尝试引入水合肼等较强还原剂制备水溶性铜纳米簇,但效果并不理想[21]。
本研究以BSA作为稳定剂制备水溶性铜纳米簇,并对其动力学过程进行研究,发现H2O2对铜纳米簇的形成具有显著催化作用。基于H2O2和L-半胱氨酸对BSA-Cu体系荧光“开-关”响应,建立了定量检测H2O2和L-半胱氨酸的荧光分析方法。本方法具有快速、灵敏、成本低和环保的特征,已成功应用于药物样品中H2O2和L-半胱氨酸的测定。
2 实验部分
2.1 仪器与试剂
Cary Esclipse荧光光度计(美国瓦里安公司);TU-1901双光束紫外-可见分光光计(北京普析通用仪器有限责任公司);JEM-2100(HR)透射电子显微镜(日本JEOL公司);MOS-450圆二色光谱仪(法国Bio-Logic公司);Zeta PALSZeta电位及纳米粒度分析仪(美国布鲁克海文公司);Lab Dancer漩涡振荡器(德国IKA公司);ZF-1型三用紫外分析仪(上海骥辉分析仪器有限公司)。
牛血清白蛋白(BSA)、五水硫酸铜、酒石酸钾钠、H2O2(30%)、酒石酸钾钠和L-半胱氨酸纯度至少为分析纯,均购于国药集团化学试剂公司。BSA溶液:1.5 g BSA溶于100 mL水。Cu2+溶液:将0.22g CuSO4·5H2O和0.42 g酒石酸钾钠溶于100 mL水中,然后用1.0 mol/L NaOH调至pH 12。H2O2溶液:移取1.0 mL 30%H2O2,加水稀释并定容至250 mL,采用高锰酸钾滴定法测定准确浓度。吸取适量此溶液,用水稀释至所需要的浓度。L-半胱氨酸溶液:0.121g L-半胱氨酸溶于100 mL水。0.01 mol/L PBS缓冲溶液(Na2HPO4-KH2PO4-NaCl-KCl,pH 7.4)。实验用水均为二次蒸馏水(一次蒸馏水经石英亚沸蒸馏器蒸馏制得)。
2.2 H2O2的测定
移取1.0 mL BSA溶液于5 mL离心管,加入0.5 mL Cu2+溶液,振荡5 s,加入不同体积的H2O2溶液,用水定容至2.0 mL,振荡5 s,于45℃的恒温水浴中保温5min,然后分别以320和420 nm作为激发波长和发射波长,在荧光分光度计上测定荧光强度或进行光谱扫描。
2.3 L-半胱氨酸的测定
移取0.4mL PBS缓冲溶液于5 mL离心管中,加入0.25 mL铜纳米簇溶液,振荡5s,加入不同体积的L-半胱氨酸溶液,用水定容至1.0 mL,振荡5 s,室温放置30min,然后分别以320和420 nm作为激发波长和发射波长,在荧光分光度计上测定荧光强度或进行光谱扫描。
2.4 Cu0与Cu2+的转化
收集检测L-半胱氨酸后的含铜废液,加热除去水分。将残渣转移至铂钳锅,然后放入马弗炉,以5℃/min速率升温至650℃,保温至样品中黑色的碳完全消失为止。取出钳锅,冷却,最后用2 mol/L H2SO4溶解得到CuSO4溶液。
3 结果与讨论
3.1 BSA-Cu配合物的形成
通常,CuSO4溶液遇强碱即生成Cu(OH)2沉淀,不利于分析过程中的准确移取。本研究准备Cu2+储备液时,预先在CuSO4溶液中加入酒石酸钾钠。Cu2+与酒石酸钾钠反应生成水溶性配合物,再加入NaOH溶液就不会产生Cu(OH)2沉淀,得到的Cu2+储备液为浅蓝色透明溶液。由于Cu2+与BSA中的多个肽键在碱性环境下配位形成更稳定的双缩脲类络合物[22],将Cu2+溶液与BSA溶液混合溶液颜色迅速变为紫色,表明Cu-酒石酸已转化为水溶性的BSA-Cu配合物。
为了研究BSA-Cu配合物的形成过程,分别测定了CuSO4、Cu-酒石酸和BSA-Cu溶液的吸收光谱。从图1可知,上述3种溶液的颜色存在明显差异,它们的最大吸收波长分别位于800、640和540 nm,且吸收峰重叠程度小。因此,通过观察溶液颜色的变化或测定它们的吸收光谱,可了解BSA-Cu配合物的形成过程。图1B是BSA浓度与BSA-Cu溶液最大吸收波长下吸光度的关系曲线。当固定溶液中Cu2+储备液加入量为1 mL时,随着BSA溶液加入体积增加,BSA-Cu体系在540 nm处的吸光度迅速增大,表明有更多的Cu-酒石酸转化为BSA-Cu配合物。当BSA体积增大到2 mL时,吸光度达到最大。继续增加BSA的浓度,吸光度基本保持不变,说明溶液中Cu-酒石酸已完全转化为BSA-Cu配合物。BSA-Cu配合物的形成显著降低了体系中游离Cu2+的浓度,导致Cu2+/Cu0的还原电位降低,有利于加快铜纳米簇形成速率。为进一步提高BSA-Cu配合物的稳定性,铜纳米簇合成中BSA溶液用量选择为3 mL。
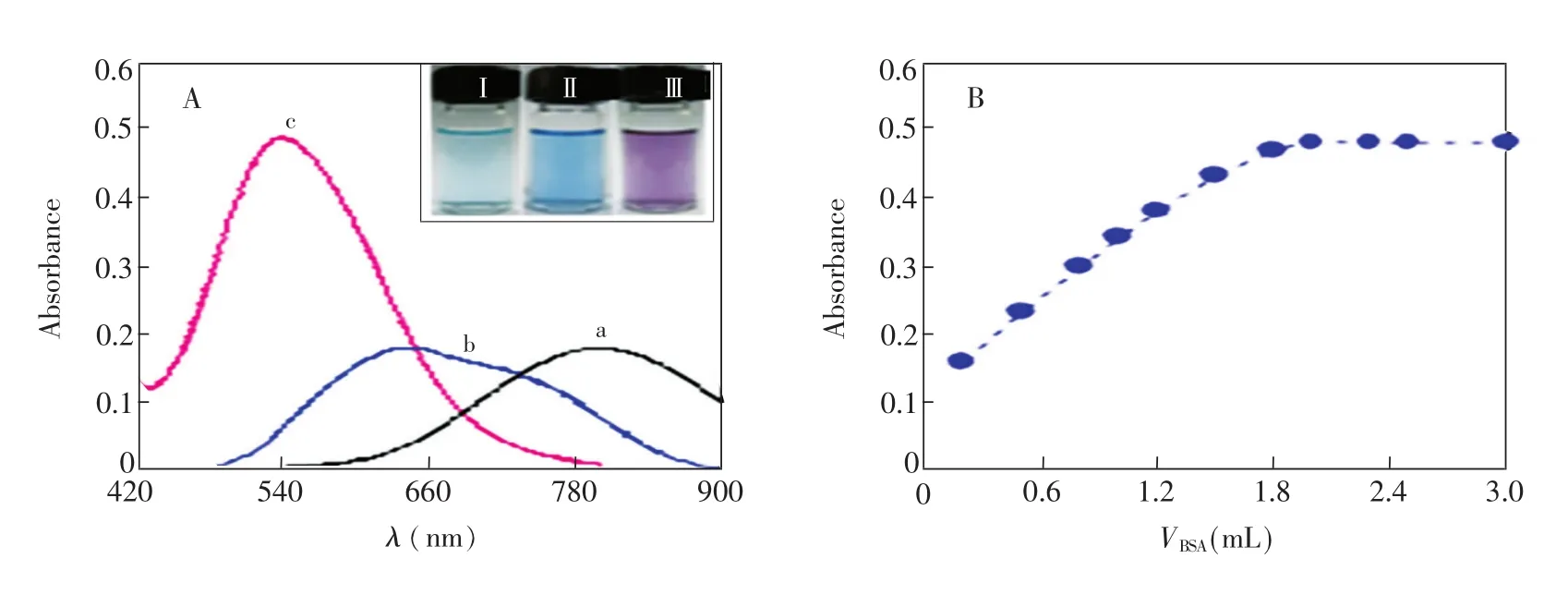
图1 A:CuSO4(a)、Cu-酒石酸(b)和BSA-Cu(c)溶液的吸收光谱;B:BSA的体积与BSA-Cu溶液最大吸收波长下吸光度关系曲线。Fig.1 A:Absorption spectra of CuSO4(a),Cu-tartrate(b)and BSA-Cu solution(c).Inset:Optical photographs of CuSO4(I),Cu-tartrate(II),BSA-Cu solution(III).B:Relationship curve of BSA volume with absorbance atmaximum absorption wavelength of the BSA-Cu solution
3.2 H2O2对铜纳米簇形成的催化行为
BSA在铜纳米簇的制备过程中发挥着多种功能。一方面,BSA中的巯基与Cu+结合形成稳定的CuS键,铜纳米簇表面包裹一层致密的BSA亲水性壳,从而显著提升了纳米簇的稳定性和在水中的溶解度。另一方面,BSA中的游离巯基有一定还原性,可将BSA-Cu中的Cu2+还原为Cu0,形成铜纳米簇。由图2可见,BSA-Cu溶液有一个弱小的荧光发射峰,表明产生了铜纳米簇。然而,荧光强度增加非常缓慢。这是因为BSA还原Cu2+的能力较弱,铜纳米簇的形成需要较长时间才能完成。为了加快铜纳米簇的生成,在体系中引入少量H2O2作为催化剂,此时体系荧光强度显著增长。当反应时间超过10min,荧光强度的增势变缓,随后增加幅度与未加H2O2时相当。实验表明,H2O2对铜纳米簇的形成具有高效催化作用。随着H2O2的消耗殆尽,铜纳米簇的产生速率也趋于平常。
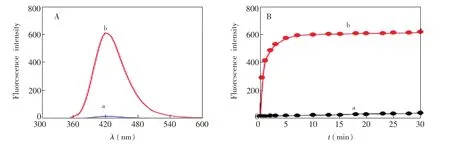
图2 BSA-Cu体系在无H2O2(a)和1.0×10-3mol/LH2O2存在下(b)的荧光光谱(A)及420 nm处的荧光强度随时间的变化曲线(B)。激发波长、反应温度和时间分别为320 nm、45℃和10minFig.2 Fluorescence spectra(A)and change curves(B)of BSA-Cu system in the absence of H2O2(a)and the presence of 1.0×10-3mol/L H2O2(b).The excitation wavelength,reaction temperature and time are 320 nm,45℃ and 10min,respectively
同步荧光和圆二色谱技术被应用于研究H2O2加入前后BSA构型的变化。图3是BSA和BSA-Cu配合物加入H2O2前后的同步荧光光谱。通常,同步荧光光谱能给予一些发色团的分子环境信息,如BSA中的酪氨酸和色氨酸。同步荧光光谱中最大发射峰的移动反映了发色团分子极性环境的变化。当激发波长与发射波长的Δλ为15和60 nm时,同步荧光光谱给予的分别是酪氨酸和色氨酸的环境特征信息[23]。从图3可见,H2O2加入后BSA和BSA-Cu的酪氨酸和色氨酸荧光强度都有增强,这证明H2O2的加入导致BSA和BSA-Cu结构变化,增加了酪氨酸和色氨酸的暴露程度,导致同步荧光强度有所增加。
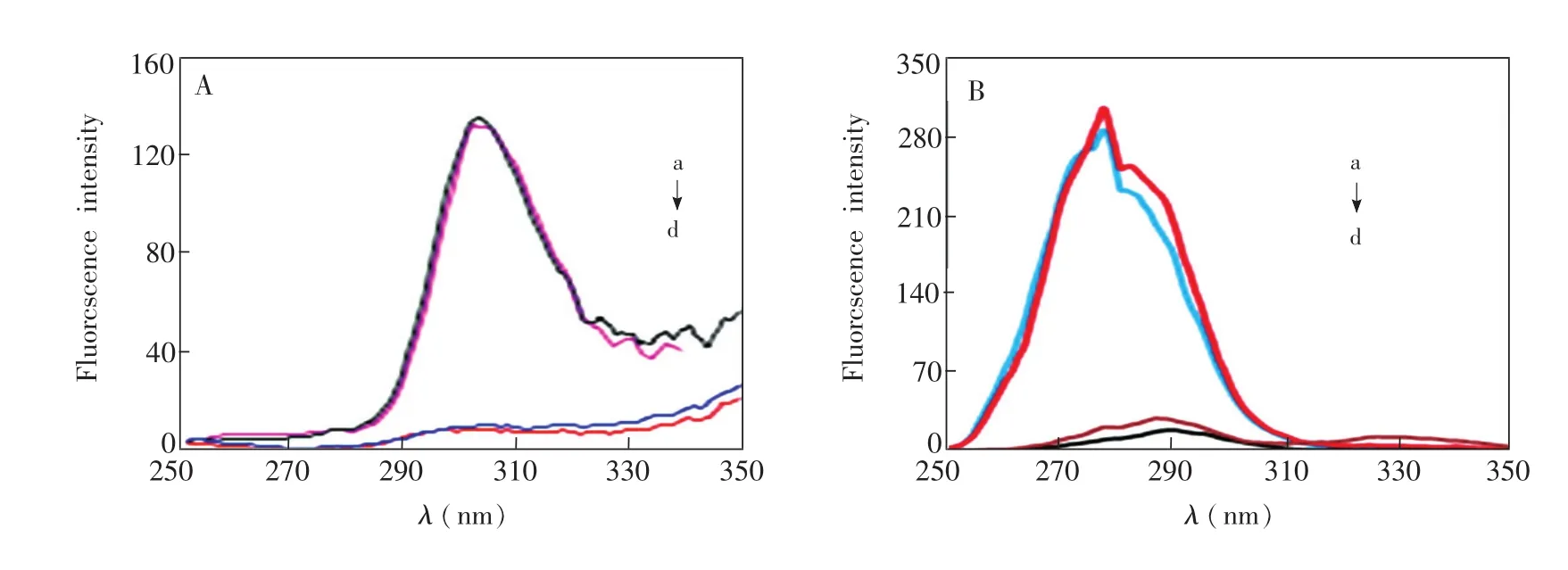
图3 H2O2加入前(b)后(a)BSA的同步荧光光谱,H2O2加入前(d)后(c)BSA-Cu同步荧光光谱Fig.3 SynchronousfluorescencespectraofBSAbefore(b)andafter(a)addedH2O2,synchronous fluorescencespectraofBSA-Cubefore(d)andafter(c)addedH2O2(b)Δλ:15nm(A)and60nm(B),pH:12,BSA:15mg/mL,H2O2:1.0×10-3mol/L
圆二色谱分析结果可以反映蛋白中二级结构的变化。表1是BSA、BSA-H2O2、BSA-Cu和BSA-Cu-H2O2体系中BSA的二级结构。表1表明,H2O2的加入降低了BSA的α-螺旋结构,增加了β-转角和无序结构,这说明H2O2破坏了BSA中部分有序结构。相对于BSA的二级结构,BSA-Cu体系中α-螺旋结构比例明显减少。因为Cu2+破坏了蛋白质中氨基酸残基亚氨基 (NH)上的氢原子和羰基上的氧原子之间形成的氢键,继而与肽链形成配合物。表1还显示,在BSA-Cu溶液中加入H2O2后,α-螺旋结构的比例进一步降低,证明Cu2+催化存在下H2O2对BSA具有更强的破坏作用,基团暴露程度更大,导致α-螺旋等有序结构进一步下降。
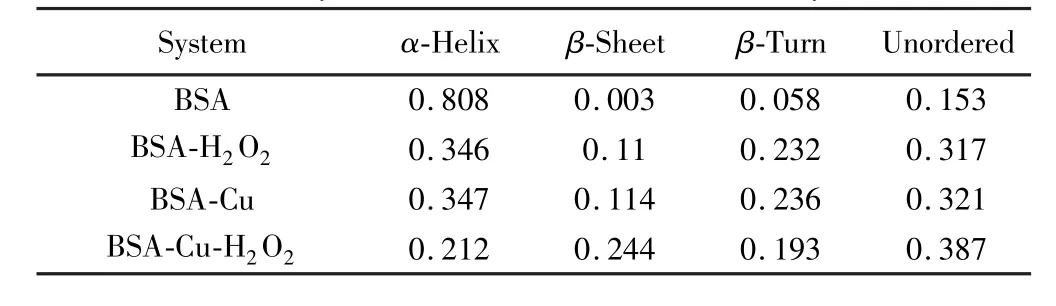
表1 不同体系中BSA的二级结构Table1 SecondarystructuresofBSAindifferentsystem
同步荧光和圆二色谱分析结果表明,H2O2在铜纳米簇形成过程中发挥了两种作用,一方面,在碱性条件下,Cu2+催化H2O2产生·OH自由基。与H2O2相比,·OH自由基有更强的氧化性,它破坏了BSA分子的部分二硫键,巯基和氨基更充分暴露[20]。所产生的游离氨基与Cu2+充分结合成稳定的配合物,降低Cu2+/Cu0的还原电势,加快铜纳米簇形成。同时,裸露出来的巯基能与Cu+形成稳定的CuS进一步提高了铜纳米簇的稳定性。另一方面,H2O2作为配体可与BSA-Cu结合形成饱和的BSA-Cu-H2O2配合物。由于BSA配位环境空间位阻大,Cu2+不可能同时与4个氨基形成四配体饱和配合物[21,22]。然而,H2O2分子小,配位能力强,可深入到BSA-Cu内部与Cu2+杂化轨道中未成键的轨道成键,形成更为稳定的BSA-Cu2+-H2O2配合物。配合物稳定性的提高可减少体系中游离Cu2+浓度,进一步降低了Cu2+/Cu0的还原电势。总之,H2O2的加入降低了Cu2+/Cu0的还原电势,增加了铜纳米簇的稳定性,从而加快了铜纳米簇形成。
3.3 L-半胱氨酸对铜纳米簇荧光的猝灭作用
为了研究L-半胱氨酸与铜纳米簇之间的相互作用,分别测定了加入L-半胱氨酸前后铜纳米簇溶液的荧光光谱。由图4可见,L-半胱氨酸的加入使铜纳米簇的荧光强度明显下降,实现了对BSA-Cu体系荧光“关”响应,这表明L-半胱氨酸对体系的荧光具有显著的猝灭效应。
为探究导致荧光猝灭的原因,采用透射电镜研究了铜纳米簇在加入L-半胱氨酸前后的粒子形貌及聚集形式。由图5可见,以H2O2作为添加剂制备的铜纳米簇的形状为规整的球形,粒径均匀,平均粒径在0.5~1.5nm之间。然而,加入L-半胱氨酸后,铜纳米簇发生明显的团聚现象,且形状变得不规整,说明L-半胱氨酸与铜纳米簇相互作用导致了铜纳米簇的聚集和破坏。L-半胱氨酸属于生物巯基类小分子氨基酸,游离巯基中的硫能在铜表面提供电子对,协调电子的不饱和状态,同时这也存在一个空置的轨道,由此更容易吸附在铜表面,对铜具有强的螯合能力[23,24]。尽管BSA稳定的铜纳米簇表面被一层BSA壳层包裹,但表面仍存在空隙,亲水性L-半胱氨酸可穿透BSA壳而深入到铜纳米簇表面,并与Cu结合。这种结合将破坏已经形成的CuS键,使BSA壳层与铜纳米簇表面脱离,失去对铜纳米簇的保护作用,最终导致铜纳米簇团聚。同时,铜纳米簇从外壳脱离程度愈大,愈容易被溶解氧氧化腐蚀,造成荧光猝灭[25]。
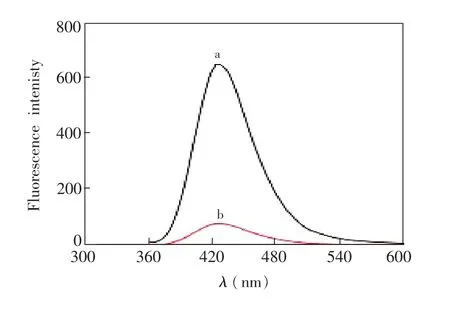
图4 加入1.0×10-2mol/L L-半胱氨酸前(a)后(b)铜纳米簇的荧光光谱。激发波长、反应温度和时间分别为320 nm、25℃和30minFig.4 Fluorescence spectra of copper nanoclustars (CuNCs)before(a)and after(b)the addition of1.0× 10-2mol/L of L-cysteine with an excitation wavelength of 320 nm.The reaction temperature and time are 25℃ and 30min,respectivelty
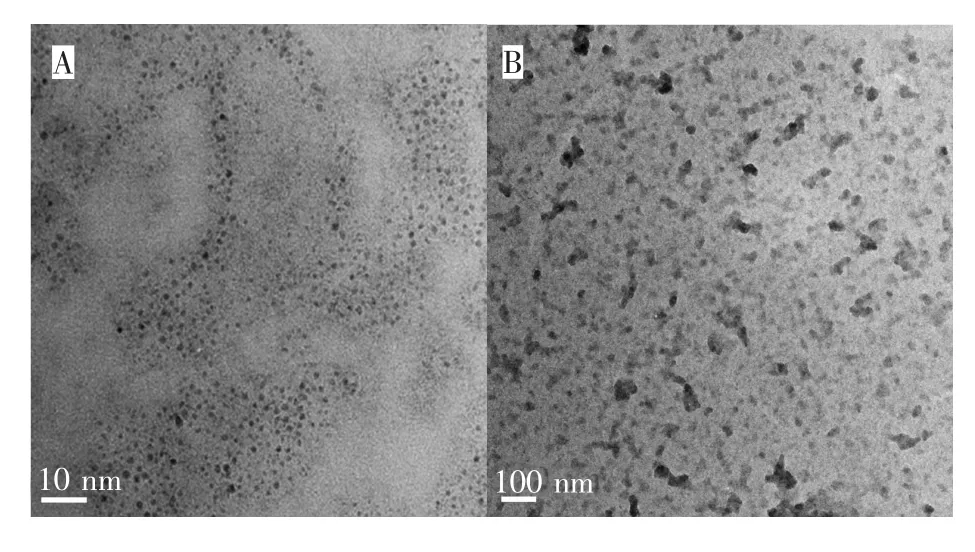
图5 加入L-半胱氨酸前(A)后(B)铜纳米簇的TEM图Fig.5 TEM images of copper nanoclusters before(A)and after(B)the addition of L-cysteine
3.4 H2O2对BSA-Cu荧光“开”响应动力学特征
为进一步研究H2O2对BSA-Cu体系荧光“开”响应的动力学特征,考察了H2O2加入量对荧光强度的影响。由图6可见,H2O2浓度不影响荧光发射峰形状,它们的最大发射波长均在420 nm。然而,体系荧光强度随 H2O2加入量的增加而迅速增大。当H2O2浓度在1.0×10-6~1.5×10-3mol/L之间,荧光强度(F)与H2O2浓度(C,mmol/L)呈现良好的线性关系,线性方程为F=471.65C+22.087,相关系数R2为0.9983,方法检出限达到 3.1×10-7mol/L (S/N=3)。基于BSA-Cu体系对H2O2荧光“开”响应,建立了测定H2O2含量的荧光分析方法。采用此方法测定20份H2O2溶液(0.5mmol/L),检测结果标准偏差为2.2%,表明方法具有良好的重现性。将BSA溶液和Cu2+储备液在4℃储藏一定时间,然后用于检测0.5×10-3mol/L H2O2。结果表明,储备液储藏3个月后测定结果相对偏差小于1.8%,表明储备液有较好的稳定性。
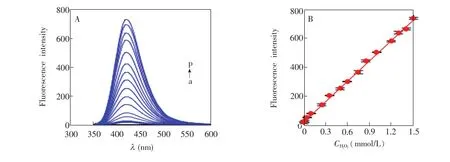
图6 A:不同H2O2浓度下BSA-Cu体系的荧光光谱;B:荧光峰强度与H2O2浓度关系曲线。Fig.6 A:Fluorescence spectra of BSA-Cu system in the presence of 0.001,0.005,0.01,0.05,0.1,0.25, 0.35,0.50,0.60,0.75,0.85,1.00,1.20,1.30,1.40 and 1.50mmol/L H2O2respectively(from a to p).B:Relationship curve of fluorescence peak intensity with H2O2concentration
不同外来成分被分别加入到BSA-Cu溶液,然后在荧光光度计上测定体系荧光强度变化(ΔF),结果见图7。在所有测试对象中,仅有H2O2能显著提高体系的荧光强度,再次证明H2O2的存在对铜纳米簇的形成具有较大的催化作用;CI-,F-,K+,Ca2+,Al3+,Na+,Mg2+和Zn2+本身还原能力差,它们对Cu2+转化为Cu0的反应没有促进作用,因此相当于5倍于H2O2浓度(1.0mmol/L)的上述离子仅产生一个极小的荧光增加;Hg2+和Pb2+的存在将导致体系荧光强度下降。一方面,Hg2+和Pb2+能与BSA中的游离巯基结合形成稳定的硫化物,使BSA丧失还原Cu2+的能力,从而抑制了铜纳米簇的形成;另一方面,Hg2+和Pb2+可能对已形成的铜纳米簇表面CuS键作用,造成BSA壳层的脱落,使铜纳米簇氧化而分解,从而导致荧光强度下降。研究表明,预先在样品中加入少量EDTA螯合剂可以消除 Hg2+和 Pb2+对测定的干扰;CH3COOH和CH3CONH2的引入BSA-Cu体系对荧光强度略有增加。这是因为它们都有含孤电子对的原子,通过供电子效应使铜纳米簇量子效率提高,从而导致荧光强度略有增加。然而,它们对H2O2测定的影响是容易消除的。研究表明,CH3COOH和CH3CONH2对体系的作用是一个相对慢的动力学过程。CH3COOH 或CH3CONH2加入使体系荧光强度缓慢增长,这一速率明显低于H2O2对体系荧光强度的影响。因此,实际样品测定时可以利用样品加入后一个迅速的荧光增加过程对H2O2进行定量分析,从而有效避免了因CH3COOH或CH3CONH2存在对测定结果的干扰。
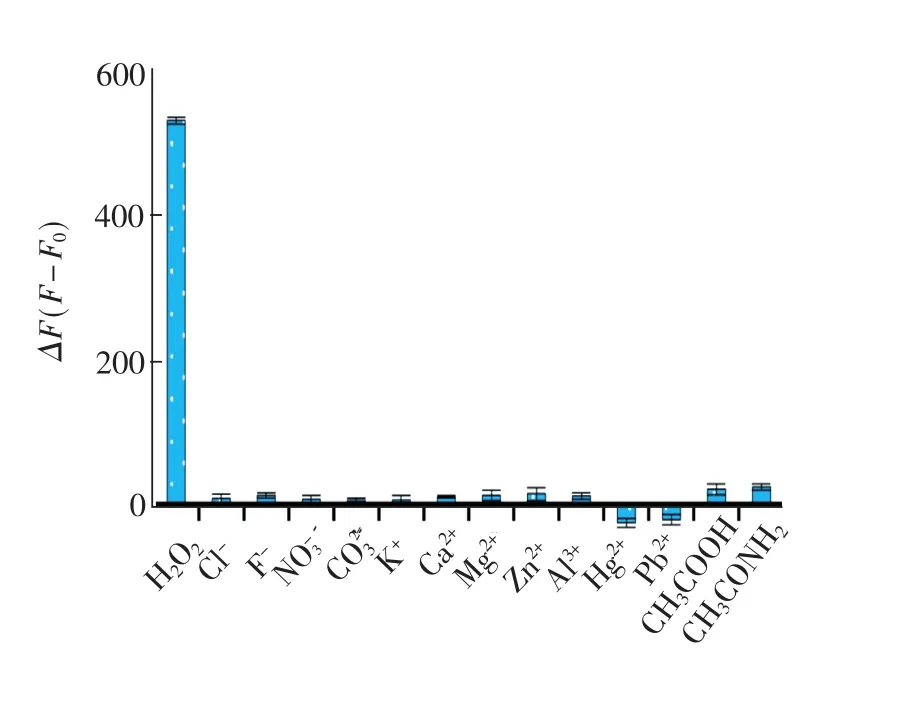
图7 不同干扰物(5mmol/L)对BSA-Cu体系检测H2O2的影响。ΔF=F-F0,为BSA-Cu体系加入不同成分前(F0)后(F)测得的荧光强度变化值。Fig.7 Fluorescence intensity of different substances (5mmol/L)in the presence of BSA-Cu.ΔF=F-F0, were the fluorescence intensity of BSA-Cu in the absence (F0)and presence(F)of various substances
3.5 L-半胱氨酸对铜纳米簇荧光“关”响应的分析性能
在铜纳米簇的溶液中分别加入不同浓度的L-半胱氨酸,然后在荧光光度计测定体系的荧光光谱。由图8A可见,在0.2~10mmol/L之间,铜纳米簇荧光强度与L-半胱氨酸浓度线性相关,回归方程为F=-6946.4C(mmol/L)+768.33,相关系数为R2=0.9997,检出限为5.7×10-5mol/L(S/N=3)。基于BSA-Cu体系对L-半胱氨酸荧光“关”响应,建立测定L-半胱氨酸含量的荧光分析方法。采用此方法测定20份1.0mmol/L L-半胱氨酸,检测结果标准偏差为1.8%,表明本方法具有良好的重现性。将铜纳米簇溶液在4℃条件下储藏一定时间,然后用于检测1.0mmol/L L-半胱氨酸。结果表明,铜纳米簇储藏3个月后测定结果相对偏差小于2.4%,表明以BSA为保护剂的铜纳米簇具有良好的稳定性。
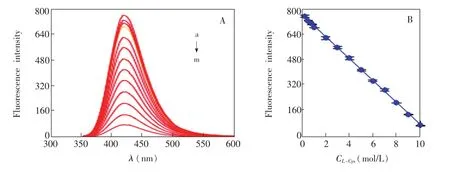
图8 A:不同浓度的L-半胱氨酸存在下铜纳米簇的荧光光谱;B:荧光强度与L-半胱氨酸浓度关系曲线。Fig.8 A:Fluorescence spectra of copper nanoclusters in the presence of 0.2,0.5,0.8,1.0,2.0,3.0, 4.0,5.0,6.0,7.0,8.0,9.0 and 10.0mmol/L of L-cysteine,respectivelty(from a tom).B:Relationship curves of fluorescence intensity with L-cysteine concentration
氨基酸的检测常受到其它氨基酸干扰,本研究考察了12种氨基酸与铜纳米簇的作用。由图9可见,12种氨基酸中,只有L-半胱氨酸(Cys)能显著猝灭荧光,加入其它氨基酸基本不影响铜纳米簇的荧光强度。这应归因于它们分子结构上的不同。只有L-半胱氨酸中含有游离巯基,它可与铜纳米簇表面的铜原子强烈作用,造成铜纳米簇的聚集和破坏,导致荧光强度的显著降低。其它氨基酸中没有游离巯基,只有少量游离氨基和羧基。由于氨基和羧基与铜的结合力较弱,不能破坏BSA稳定的铜纳米簇。铜纳米簇对L-半胱氨酸特异性地产生荧光“关”响应,表明本分析方法具有较高的选择性。
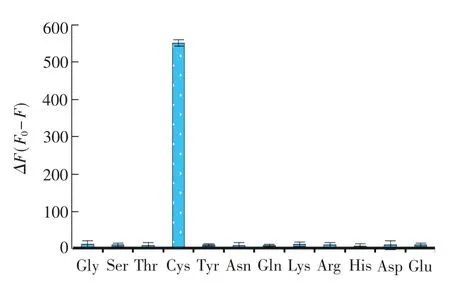
图9 不同氨基酸(0.01 mol/L)对铜纳米簇荧光强度的影响。ΔF=F0-F,为铜纳米簇溶液加入不同氨基酸前(F0)后(F)测得的荧光强度变化值Fig.9 Effect of different amino acid(0.01 mol/L)on fluorescence intensity of copper nanoclusters.ΔF=F0-F, were the fluorescence intensity of the copper nanoclusters in the absence(F0)and presence(F)of the various amino acids
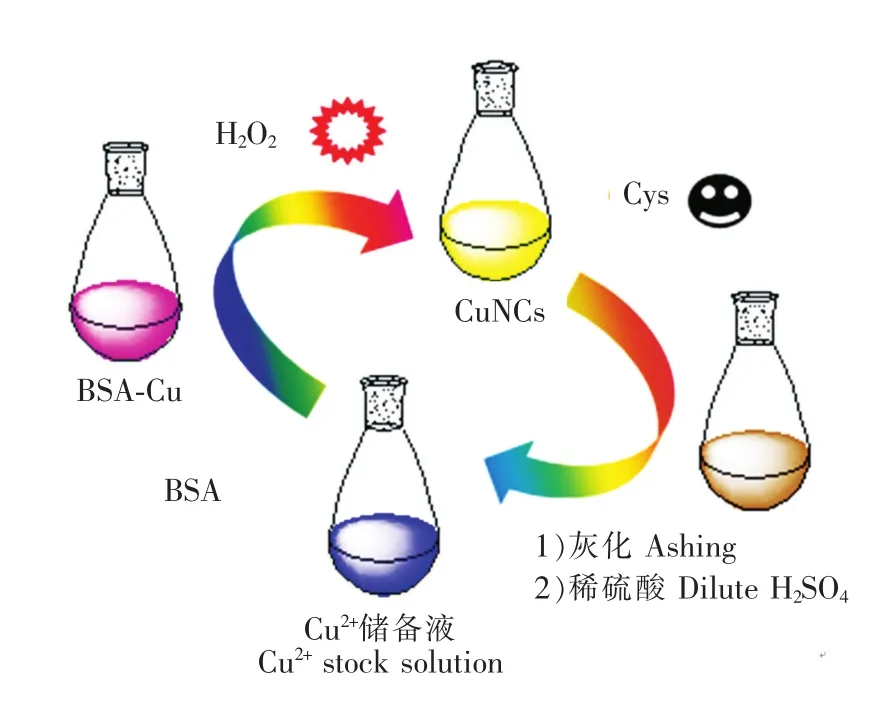
图10 铜的重复利用和检测的循环方案Fig.10 Schematic of circle detection
3.6 铜的重复利用和分析检测的循环
铜是保贵资源又是环境污染物,它的重复利用具有经济和环保价值。基于BSA-Cu体系对H2O2和L-半胱氨酸荧光“开-关”响应的特点,设计了铜的重复利用和分析检测的循环方案(图10)。首先,利用H2O2对铜纳米簇形成的催化作用实现对微量H2O2的荧光检测。收集检测完H2O2后的铜溶液,放置一段时间,其荧光增至最大,完成了Cu2+→Cu0的转化和铜纳米簇的合成;利用L-半胱氨酸对铜纳米簇荧光猝灭效应实现对微量L-半胱氨酸的荧光检测。收集检测完 L-半胱氨酸后的铜溶液,采用灰化和稀H2SO4溶解相结合的方法将所有Cu0转化为Cu2+。所得到的CuSO4溶液应用于下一个循环,如此操作可实现铜的重复利用和分析检测的循环。
为了检验此循环方法的可行性,分别考察了不同循环次数中检测H2O2和L-半胱氨酸分析方法的线性范围和检出限。从表2可知,每次循环相关的分析参数基本相近,这说明循环不影响检测方法的主要性能指标。另外,每次循环铜的重复利用率也被测定和计算。结果表明,每次循环过程中铜的重复利用率在95%以上,表明方案可实现较好的铜重复利用。
3.7 样品分析
所建立的荧光分析方法应用于药物中H2O2和L-半胱氨酸的连续测定。从表3可知,本方法测定结果与相应的参考方法结果一致,其相对标准偏差(RSD)都在0~4%之间,表明本方法具有较好的精密度和准确性。
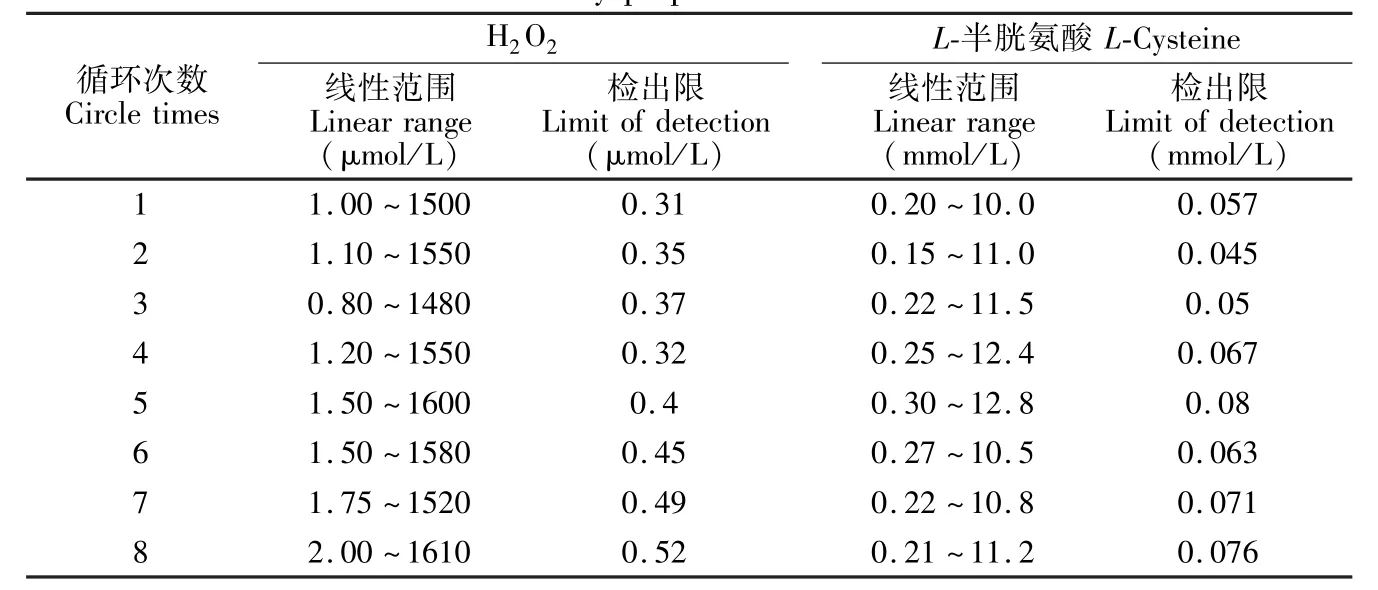
表2 不同循环次数下分析方法的主要技术参数Table 2 Results of circle detection by proposed method
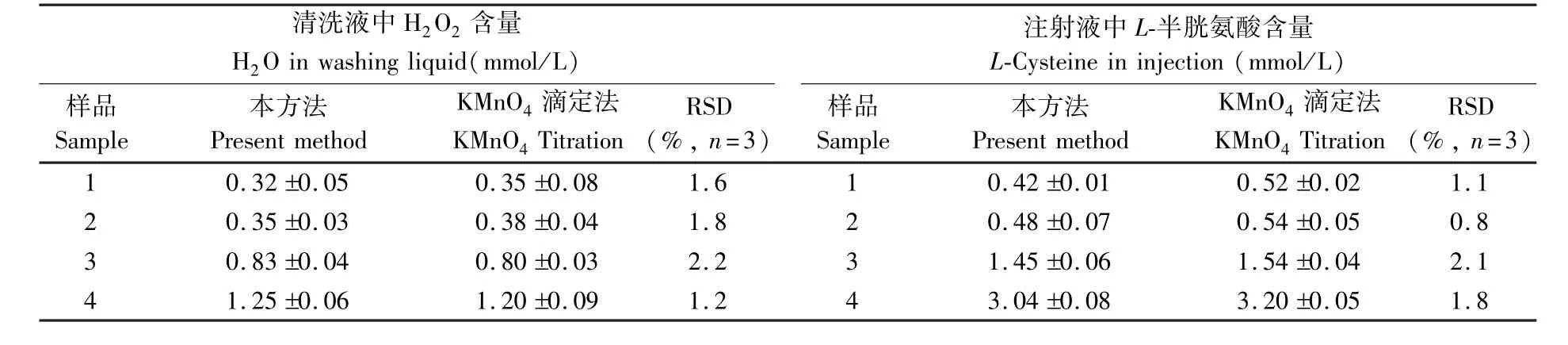
表3 药物中H2O2溶液和L-半胱氨酸测定结果Table 3 Detection results of H2O2and L-cysteine in drug formulations
4 结论
在碱性介质和Cu2+存在下,H2O2具有强的氧化和螯合能力,促进了Cu2+→Cu0转化,导致铜纳米簇的快速形成和荧光强度的显著增加。基于BSA-Cu体系对H2O2荧光“开”响应,成功建立了微量H2O2的荧光测定方法。由于L-半胱氨酸中游离巯基可破坏铜纳米簇表面的CuS键,导致铜纳米簇的分解和荧光强度的下降。基于BSA-Cu体系对L-半胱氨酸荧光“关”响应,建立了微量L-半胱氨酸的荧光测定方法。此外,通过Cu2+与Cu0之间相互转化实现铜的重复利用和分析检测的循环,方法具有灵敏,低成本和环保的显著优势,可广泛应用于H2O2和L-半胱氨酸的日常分析。此外,研究还可应用于铜纳米簇的快速制备。
1 Lin Y H,Ren JS,Qu X G.Acc.Chem.Res.,2014,47(4):1097-1105
2 Díez I,Ras R H A.Springer Ser.Fluoresc.,2010,9:307-332
3 Li SY,Wei S,Gao ZQ.Chem.Soc.Rev.,2015,44(1):362-381
4 Yu J,Zhang X J,Hao X J,Zhang X H,Zhou M J,Lee C S,Chen X F.Biomaterials,2014,35(10):3356-3364
5 Shang L,Dong S J,Nienhaus G U.Nano Today,2011,6(4):401-418
6 Wu X F,Li R Y,Li Z J,Liu JK,Wang G L,Gu Z G.RSC Adv.,2014,4(48):24978-24985
7 Li JJ,Wang W J,Sun D F,Chen J N,Zhang P H,Zhang J R,Min Q H,Zhu J J.Chem.Sci.,2013,4(9):3514-3521
8 Ling Y,Zhang N,Qu F.Spectrochim.Acta,Part A,2014,118:315-320
9 Zhao X J,Huang C Z.New J.Chem.,2014,38(8):3673-3677
10 Yang X M,Feng Y J,Zhu SS,Luo YW,Zhuo Y,Dou Y.Anal.Chim.Acta,2014,847:49-54
11 Jia X F,Yang X,Li J,Li D Y,Wang E K.Chem.Commun.,2014,50(2):237-239
12 Jia X F,Li J,Wang E K.Small,2013,9(22):3873-3879
13 LiW H,LiW,Hu Y F,Xia Y L,Shen Q P,Nie Z,Huang Y,Yao SZ.Biosens.Bioelectron.,2013,47:345-349
14 Jia X F,Li J,Han L,Ren JT,Yang X,Wang E K.ACSNano,2012,6(4):3311-3317
15 Hu L Z,Yuan Y L,Zhang L,Zhao JM,SaadatM,Xu G B.Anal.Chim.Acta,2013,762:83-86
16 Wu X F,Li R Y,Li Z J.RSC Adv.,2014,4(20):9935-9941
17 Rama G,Amaresh K S,Siddhartha S G,Anumita P,Arun C.ACS Applied Materials&Interfaces,2014,6(6):3822-3828
18 WangW,Leng F,Zhan L,Chang Y,Yang X X,Lan J,Huang C Z.Analyst,2014,139(12):2990-2993
19 Zhao T,He XW,LiW Y,Zhang Y K.J.Mater.Chem.B,2015,3(11):2388-2394
20 Xu S J,Chen F N,Deng M,Sui Y Y.RSC Adv.,2014,4(30):15664-15670
21 Wang C,Wang C X,Xu L,Cheng H,Lin Q,Zhang C.Nanoscale,2014,6(3):1775-1781
22 Drochioiu G,Damocb N E,PrzybylskiM.Talanta,2006,69(3):556-564
23 Zhang H,Liu R T,Chi Z X,Gao C Z.Spectrochim.Acta,Part A,2011,78:523-527
24 Zou M M,Li Y,Wang J,Gao JQ,Wang Q,Wang B X,Fan P.Spectrochim.Acta,Part A,2013,112:206-213
25 SUN Tao,GUO Hong-Rui,XU Huan-Lin,ZHOU Bao-Kuan.Chem.J.Chinese Universities,2007,28(5):856-858
孙涛,郭洪瑞,许环麟,周宝宽.高等学校化学学报,2007,28(5):856-858
26 Li Z P,Li K A,Tong SY.Anal.Lett.,1999,32(5):901-913
27 Wu Z Z,LiW Y,Chen J,Yu C.Talanta,2014,119:538-543
28 Chen Z,Lu D T,Cai ZW,Dong C,Shuang SM.Luminescence,2014,29(7):722-727
29 Hu Y H,Wu Y M,Chen T T,Chu X,Yu R Q.Anal.Methods,2013,5(14):3577-3581
(Received 20 May 2015;accepted 3 July 2015)
This work was supported by the National Natural Science Foundation of China(No.21176101)
Fluorescence"on-off"Response of Bovine Serum Album in-Cu System Towards Hydrogen Peroxide and L-Cysteine and Their Analysis Applications
LIAO Xiao-Qing1,WANG Hui-Ying1,LIZai-Jun*1,21(School ofChemical and Materials Engineering,Jiangnan University,Wuxi214122,China)
2(The Key Laboratory of Food Colloids and Biotechnology,Ministry ofEducation,Jiangnan University,Wuxi214122,China)
The synthesis and application of copper nanoclusters(CuNCs)as optical probe have attracted a great attention.The study shows that bovine serum albumin(BSA)CAN reactwith copper ions(Cu2+)in a basemedium to form stable BSA-Cu complex.In the solution,the introduction of hydrogen peroxide can remarkably accelerate the formation of CuNCs.At the same time,the fluorescence intensity rapidly increases.Based on the fluorescence"light-on"response of BSA-Cu system,a kineticsmethod was developed for the fluorescent detection of hydrogen peroxide.The fluorescence intensity of BSA-Cu linearly increased with the increase of hydrogen peroxide in the range from 1.0×10-6mol/L to 1.5×10-3mol/L with the detection limit of 3.1×10-7mol/L(S/N=3).After that,the collected BSA-Cu solution was placed until its fluorescence intensity increases to the maximum value,in which the Cu2+ions were fully changed into CuNCs.The experiment demonstrated that the addition of L-cysteine into the solution led to an obvious fluorescence quenching.Based on the fluorescence"light-off"response of BSA-Cu system towards L-cysteine,an analytical method was established for the fluorescent determination of L-cysteine.The fluorescence intensity linearly reduced with the increase of L-cysteine concentration in the range of 2.0×10-4-1.0×10-2mol/L with the detection limit of 5.7×10-5mol/L(S/N=3).Finally,the resulted BSA-Cu waste was treated by high temperature ashing and then dissolvingwith sulfuric acid,in which the CuNCswere turned into Cu2+ions.The resulting Cu2+solution continued to be used for the detection of H2O2and L-cysteine in the next cycle.In the work,the cycle detection of hydrogen peroxide and L-cysteine and reuse of copper could be achieved using the conversion between Cu2+and copper nanoclusters.Themethod provides the characteristics of high sensitivity, low cost and environment-friendly,and can be widely used for routine analysis of hydrogen peroxide and L-cysteine.
Copper ions;Copper nanoclusters;Fluorescence probe;Hydrogen peroxide;L-Cysteine
10.11895/j.issn.0253-3820.150413
2015-05-20收稿;2015-07-03接受
本文系国家自然科学基金资助项目(No.21176101)
E-mail:zaijunli@jiangnan.edu.cn
