IL-2、IL-6及TNF-α在结外NK/T细胞淋巴瘤鼻型患者血清中的表达及临床意义
2015-01-04
郑州大学第一附属医院淋巴瘤诊疗中心,河南 郑州 450052
IL-2、IL-6及TNF-α在结外NK/T细胞淋巴瘤鼻型患者血清中的表达及临床意义
王媛媛,李兆明,张旭东,张明智
郑州大学第一附属医院淋巴瘤诊疗中心,河南 郑州 450052
背景与目的:结外NK/T细胞淋巴瘤鼻型(extranodal NK/T-cell lymphoma,nasal type,ENKTL)属于非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)的一种少见类型,在亚洲国家发病率较欧美国家强。该病侵袭性强,发病机制至今仍尚未明确,但其与EB病毒(epstein-barr virus,EBV)感染密切相关。到目前为止ENKTL尚无标准治疗指南,其治疗效果不佳,患者预后极差,因此,探索ENKTL的发病机制势在必行。本研究探讨ENKTL患者血清中白细胞介素-2(interleukin,IL-2)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)表达水平及其临床意义。方法:通过Luminex液相芯片技术检测67例ENKTL患者及26名正常人血清中的IL-2、IL-6和TNF-α的表达水平。结果:ENKTL患者血清中IL-2、IL-6和TNF-α的表达水平分别为(564.1±387.6)、(293.3±191.6)和(181.3±91.8)pg/mL;正常人血清中的IL-2、IL-6和TNF-α的表达水平分别为(1 097.0±365.7)、(417.5±289.6)和(291.3±89.4)pg/mL。和正常人相比,ENKTL患者血清中IL-2、IL-6和TNF-α的表达水平明显降低,差异有统计学意义(P<0.05)。进一步研究表明,经化疗达到完全缓解(complete response,CR)的5例ENKTL患者血清中TNF-α水平明显高于初治患者,分别为(162.7±10.3)和(125.2±7.3)pg/mL,差异有统计学意义(P<0.05)。结论:IL-2、IL-6和TNF-α在ENKTL患者血清中的表达水平降低,并且TNF-α的表达水平与化疗疗效密切相关。
结外NK/T细胞淋巴瘤鼻型;白细胞介素-2;白细胞介素-6;肿瘤坏死因子α;炎性反应
结外NK/T细胞淋巴瘤鼻型(extranodal NK/ T-cell lymphoma,nasal type,ENKTL)属于非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)的一种少见类型,占全部恶性淋巴瘤的2%~10%[1],大多起源于结外部位,很少发生于淋巴结内[2]。ENKTL在亚洲,尤其是中国南方和东南亚地区发病率较高,而在欧美地区少见[3]。本病的发生机制尚不清楚,但是越来越多的研究表明,慢性炎性反应的持续存在在肿瘤启动、维持和促进生长中发挥重要作用[4-5]。本研究将探讨细胞因子白细胞介素-2(interleukin-2,IL-2),白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)在ENKTL患者血清中的表达及临床意义。
1 资料和方法
1.1 病例选择
实验组共67例患者,其中女性19例,男性48例,男女比例为2.53∶1,中位年龄是47.5岁。入选条件:①根据世界卫生组织的分类方法病理检查结果确诊为ENKTL;②初治,之前未接受过抗肿瘤治疗;③起病于鼻腔;④后续检查完善;⑤接受治疗前同意采集血清标本。对照组为26名健康的正常人。
1.2 实验方法
1.2.1 采集标本
清晨空腹采集静脉血5 mL,其中2 mL加入EDTA盐抗凝,另外3 mL血静置,200×g离心,提取血清。处理后将样本置于-80 ℃冰箱保存备用。
1.2.2 标本检测
在芯片每个检测孔中缓慢加入25 μL缓冲剂和25 μL待测血清标本,一式两份。之后加入被待测分子抗体所包裹的混合微珠25 μL,将Luminex200芯片(美国Luminex公司产品)放入4 ℃的摇床中过夜。第2天,清洗芯片,以移除多余的血清中未结合的成分,然后加入25 μL生物素化的检测抗体的混合物,放入室温条件下的摇床中。30 min后取出再次清洗,并加入25 μL PE标记链亲和素溶液,继续室温在摇床中反应30 min。最后,清洗芯片两次,加入100 μL鞘液后,微珠颗粒将会重悬,此时就可以用Luminex200系统进行检测。各种细胞因子的浓度会根据平均荧光强度的高低被表示出来。
1.3 统计学处理
采用SPSS 17.0对所得数据进行统计分析。计量资料均用χ±s 来表示,P<0.05为差异有统计学意义。
2 结 果
2.1 实验组患者基本数据
在实验组中,有B症状的患者为37例(55.2%),局部淋巴结肿大的患者为16例(23.9%),EB病毒阳性的患者为32例(47.8%)。52例患者一般状况较好,ECOG评分为0~1分(77.6%),其余(22.4%)评分为2~3分。37例患者疾病分期为1~2期(55.2%),其余分期为3~4期(44.8%)。53例(79.1%)IPI评分为0~2分,14例(20.9%)IPI评分为3~4分(表1)。
2.2 ENKTL患者血清中IL-2、IL-6和TNF-α水平的变化
ENKTL患者共67例,血清中IL-2水平为(564.1±387.6)pg/mL,IL-6水平为(293.3±191.6)pg/mL,TNF-α水平为(181.3±91.8)pg/mL。正常对照共26名,血清中IL-2水平为(1 097.0±365.7)pg/mL,IL-6水平为(417.5±289.6)pg/mL,TNF-α水平为(291.3±89.4)pg/mL (表2)。IL-2在正常人血清中明显高于ENKTL患者(P=0.000),IL-6(P=0.042)与TNF-α(P=0.000)在ENKTL患者血清中水平也明显低于正常人(图1)。
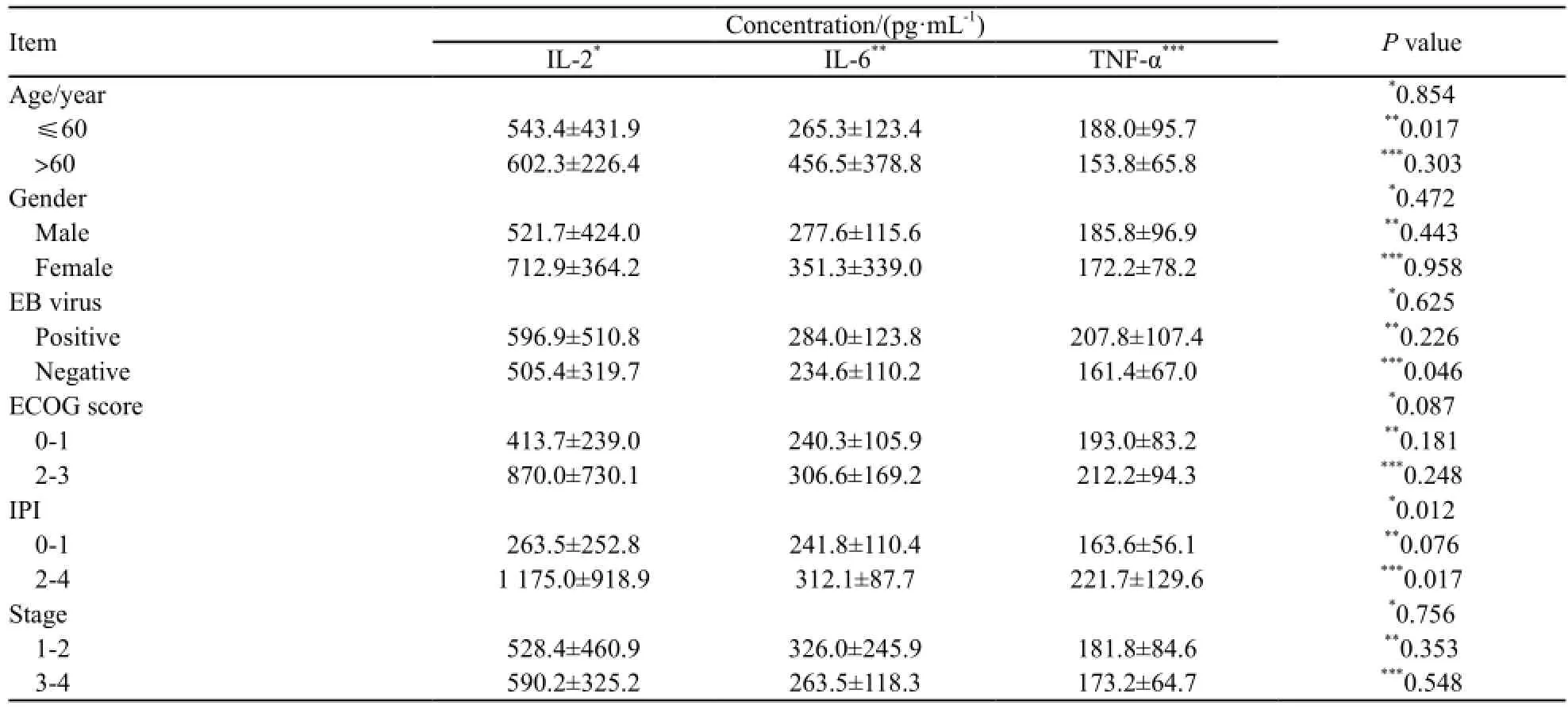
表1 患者血清中IL-2、IL-6和TNF-α水平与临床各项指标的关系Tab . Relationship between the expression level of IL-2, IL-6 and TNF-α in the serum of patients and the clinical indexes
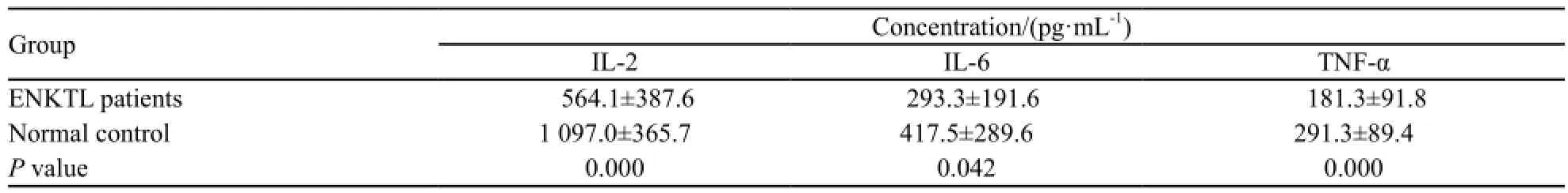
表2 ENKTL患者及正常对照组血清中IL-2、IL-6和TNF-α水平Tab. 2 Expression level of IL-2, IL-6 and TNF-α in ENKTL patients and control group
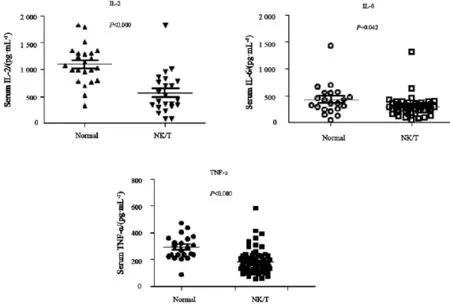
图1 对照组和ENKTL患者血清中IL-2、IL-6和TNF-α水平分布情况Fig. 1 Distribution of IL-2, IL-6 and TNF-α in ENKTL patients and control group
2.3 ENKTL初治患者和化疗6个周期达到完全缓解(complete response,CR)患者血清中TNF-α水平比较
5例初治ENKTL患者经化疗达到CR后血清中TNF-α水平明显高于初治患者,初治和CR患者血清中TNF-α水平分别为(125.2±7.3)和(162.7±10.3)pg/mL(图2)。
3 讨 论
ENKTL属NHL的一种少见类型,其恶性细胞大部分来源于成熟的NK细胞[6]。多数病例原发于鼻腔和咽喉部以上部位,少数病例原发于鼻外,如胃肠道、皮肤和软组织等[7]。其组织学表现为肿瘤细胞的多形性、不同程度的炎性细胞浸润、肿瘤组织的坏死和血管侵犯等[8]。
炎性反应是具有血管系统的活体组织对损伤因子所发生的复杂的防御反应。有研究在肿瘤组织中观察到浸润的白细胞,据此推测肿瘤可能源自慢性的炎性反应[9-10],因此,将肿瘤起源与慢性炎性反应联系起来。很多研究已经证实,炎性反应是一个明确可以导致肿瘤的危险因素,ENKTL的发病与EBV的感染密切相关[11]。例如感染了乳头瘤病毒的患者更容易患宫颈癌[12],胃幽门螺杆菌的感染有增加胃癌风险的趋势[13-14]。
IL-2是由活化T细胞分泌的,参与免疫反应的重要细胞因子。IL-2可以促进T细胞的生长、增殖和分化[15],增强细胞毒性T细胞(CTL)和自然杀伤细胞(NK)活性[16],诱导干扰素(IFN)产生及介导肿瘤免疫等多种功能,有研究表明IL-2在体外能有效破坏肿瘤细胞[17]。IL-6是迄今为止发现的功能最为广泛的细胞因子之一,它主要参与调节机体的免疫应答,并在血细胞的生成及其他多种细胞的增殖和分化过程中发挥重要作用[18-19]。
我们的研究表明,血清中IL-2和IL-6的水平在ENKTL患者中均明显降低,这表明IL-2、IL-6水平的降低可能与ENKTL的发生密切相关。TFN-α通过与肿瘤坏死因子受体结合诱导肿瘤细胞的凋亡,还具有促进免疫细胞增殖分化、影响肿瘤血管生成等功能[20],因此也是一种机体保护因子。实验数据显示,TNF-α在ENKTL患者血清中明显降低,可见TNF-α的降低可能与IL-2、IL-6共同参与ENKTL的发生。此外,我们还发现血清TNF-α水平在经化疗后病情达到CR的患者较初治患者明显升高,这表明TNF-α的表达水平与化疗疗效密切相关,有可能作为ENKTL化疗疗效预测的潜在指标。
而TNF-α对于肿瘤具有双刃剑的作用,在肿瘤中的作用还存在争议。一方面TNF-α能够激活CD8+T细胞或NK细胞等释放IFN-γ和穿孔素,从而抑制肿瘤细胞生长[21-22]。另一方面TNF-α可以通过多种途径促进肿瘤的发生和发展,例如激活NF-κB信号通路从而刺激肿瘤生长。这可能是由于TNF-α在不同的肿瘤类型激活了不同的信号传导途径造成的,但是在ENKTL中的具体作用机制还有待深入研究。
根据本研究结果,ECOG评分0~1分和2~3分两类患者血清中3种细胞因子IL-2、IL-6和TNF-α表达的差异无统计学意义(P值分别为0.087、0.181和0.248);同样1~2期和3~4期患者3种细胞因子表达的差异无统计学意义(P值分别为0.756、0.353和0.548)。但IL-2和TNF-α的表达水平在高IPI评分(2~4分)患者中稍高于低IPI评分(0~1分)患者,其具体机制尚待进一步研究。
[1] CHAN J K. The new World Health Organization classification of lymphomas: the past, the present and the future[J]. Hematol Oncol, 2001, 19(4): 129-150.
[2] HARRIS N L, JAFFE E S, STEIN H, et al. A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group[J]. Blood, 1994, 84(5): 1361-1392.
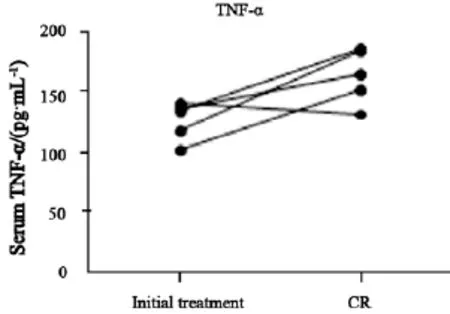
图2 ENKTL初治患者和达到CR患者血清中TNF-α水平比较Fig. 2 Comparision of TNF-α between CR and initial treatment patients
[3] AU W Y, WEISENBURGER D D, INTRAGUMTORNCHAIT, et al. Clinical differences between nasal and extranasal NK/ T-cell lymphoma: a study of 136 cases from the international peripheral T-cell lymphoma project[J]. Blood, 2009, 113(17): 3931-3937.
[4] LIN W W, KARIN M. A cytokine-mediated link between innate immunity, inflammation, and cancer[J]. J Clin Invest, 2007, 117(5): 1175-1183.
[5] OROM U A, NIELSEN F C, LUND A H. MicroRNA-10a binds the 5'UTR of ribosomal protein mRNAs and enhances their translation[J]. Mol Cell, 2008, 30(4): 460-71.
[6] HIROSHI N, AKIYOSHI K, NOBUHIRO K, et al. Characterization of novel natural killer(NK)-cell and γδT-cell lines established from primary lesions of nasal T/NK-cell lymphomas associated with the Epstein-Barr virus[J]. Blood, 2001, 97(3): 708-713.
[7] LI Y X, FANG H, LIU Q F, et al. Clinical features and treatment outcome of nasal type NK/T cell lymphoma of Waldeyer ring[J]. Blood, 2008, 112(8): 3057-3064.
[8] 钟博南, 张晓华, 李敏, 等. NK/T细胞淋巴瘤的病理组织学、免疫表型及基因研究[J]. 中华血液学杂志, 2003, 24(10): 505-509.
[9] CLEVERS H. At the crossroad of inflammation and cancer[J]. Cell, 2004, 118(6): 671-674.
[10] BALKWILL F, MANTOVANI A. Inflammation and cancer, back to Virchow[J]. Lancet, 2001, 357(9255): 539-545.
[11] WU X, LI P, ZHAO J, et al. A clinical study of 115 patients with extranodal natural killer/T-cell lymphoma, nasal type[J]. Clin Oncol, 2008, 20(8): 619-625.
[12] YILDIRIM J G, ARABACI Z. Innovations in HPV vaccination and roles of nurses in cervical cancer prevention[J]. Asian Pac J Cancer Prev, 2014, 15(23): 10053-10056.
[13] MALFERTHEINER P, SELGRAD M. Helicobacter pylori[J]. Curr Opin Gastroenterol, 2014, 30(6): 589-595.
[14] POURHOSEINGHOLI M A,VAHEDI M, BAGHESTANI A R. Burden of gastrointestinal cancer in Asia; an overview[J]. Gastroenterol Hepatol Bed Bench, 2015, 8(1): 19-27.
[15] LAN R Y, SELMI C, GERSHWIN M E. The regulatory, inflammatory, and T cell programming roles of interleukin-2 (IL-2) [J]. Autoimmun, 2008, 31(1): 7-12.
[16] GRUENBACHER G, GANDER H, NUSSBAUMER O, et al. IL-2 costimulation enables statin-mediated activation of human NK cells, preferentially through a mechanism involving CD56+ dendritic cells[J]. Cancer Res, 2010, 70(23): 9611-9620.
[17] BULLOCK T N, VULLINS D W, COLELLA T A, et al. Manipulation of avidity to improve effectiveness of adoptively transferred CD8+ T cells for melanoma immunotherapy in human MHC class I-transgenic mice[J]. J Immunol, 2001, 167(10): 5824-5831.
[18] RAVAGLIA G, FORTI P, MAIOLI F, et al. Associations of the -174 G/C interleukin-6 gene promoter polymorphism with serum interleukin 6 and mortality in the elderly[J]. Biogerontology, 2005, 6(6): 415-423.
[19] 刘徽, 朱波, 林志华. IL-6信号通路与肿瘤[J]. 细胞与分子免疫学杂志, 2011, 27(3): 353-355.
[20] 古翠萍, 张沂平. TNF-α抗肿瘤作用机制新进展[J].中国肿瘤, 2007, 16(2): 102-105.
[21] PRÉVOST-BLONDEL A, ROTH E, ROSENTHAL F M, et al. Crucial role of TNF-alpha in CD8 T cell-mediated elimination of 3LL-A9 Lewis lung carcinoma cells in vivo[J]. J Immunol, 2000, 164(7): 3645-3651.
[22] BAXEVANIS C N,VOUTSAS I F,TSITSILONIS O E, et al. Compromised anti-tumor responses in tumor necrosis factoralpha knockout mice[J]. Eur J Immunol, 2000, 30(7): 1957-1966.
The expressions of IL-2, IL-6 and TNF-α in the serum of extranodal NK/T-cell lymphoma (ENKTL) patients and their clinical significances
WANG Yuanyuan, LI Zhaoming, ZHANG Xudong, ZHANG Mingzhi (Lymphoma Diagnosis and Treatment Center, First Affiliated Hospital, Zhengzhou University, Zhengzhou Henan 450052, China)
ZHANG Mingzhi E-mail: mingzhi-zhang1@163.com
Background and purpose:Extranodal NK/T-cell lymphoma, nasal type (ENKTL) belongs to a rare type of non-Hodgkin's lymphoma (NHL). Its incidence rate in Asian country is higher than that in Western country. This disease is highly invasive, the pathogenesis of it is still unclear. Resent research shows that epstein-barr virus (EBV) is closely related to the occurrence of it. There is still no standard treatment guidelines of ENKTL, and the prognosis is very bad. Therefore, it is imperative to explore the pathogenesis of ENKTL. This study aimed to investigate the expressions of interleukin-2 (IL-2), interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in the serum of ENKTL patients and their clinical significances.Methods:Luminex liquid chip technology was used to detect the expression levels of IL-2, IL-6 and TNF-α in the serum of 67 ENKTL patients and 26 normal persons.Results:The expression levels of IL-2, IL-6 and TNF-α in the serum of 67 ENKTL patients were (564.1±387.6), (293.3±191.6) and (181.3±91.8)pg/mL, while in the normal persons were (1 097.0±365.7), (417.5±289.6) and (291.3±89.4)pg/mL, respectively. Compared with normal persons, the expression levels of IL-2, IL-6 and TNF-α in ENKTL patients were significantly lower (P<0.05). Further study showed that the expression level of TNF-α in 5 complete remission ENKTL patients [(162.7±10.3)pg/mL] was significantly higher than that in initial treatment patients [(125.2±7.3)pg/mL, P<0.05].Conclusion:The expressions of IL-2, IL-6 and TNF-α are reduced in the serum of ENKTL patients, and the serum expression level of TNF-α is closely related to the effect of chemotherapy.
Extranodal NK/T-cell lymphoma, nasal type; Interleukin-2; Interleukin-6; Tumor necrosis factor-α; Inflammation
10.3969/j.issn.1007-3969.2015.05.010
R733.4
A
1007-3639(2015)05-0377-05
2015-01-12
2015-03-18)
国家自然科学基金(81402380)。
张明智 E-mail:mingzhi-zhang1@163.com
