洛铂联合固定剂量多西紫杉醇二线及以上治疗晚期实体肿瘤的剂量递增研究
2015-01-04
河北医科大学附属华北石油管理局总医院肿瘤科,河北 任丘 062552
洛铂联合固定剂量多西紫杉醇二线及以上治疗晚期实体肿瘤的剂量递增研究
刘月娥,任小沧,陈雪霁,马延,李静,彭羽,郭志军,曹斌,蔺强
河北医科大学附属华北石油管理局总医院肿瘤科,河北 任丘 062552
背景与目的:恶性肿瘤一线化疗后多出现复发或转移,需要二线及以上治疗。本研究旨在确定洛铂联合固定剂量多西紫杉醇治疗化疗后进展的实体肿瘤时洛铂的最大耐受剂量(maximum-tolerated dose,MTD),并评价其不良反应。方法:应用改良的Fibonacci法进行洛铂剂量递增,固定多西紫杉醇剂量为60 mg/m2,洛铂初始剂量为30 mg/m2,组间递增剂量为5 mg/m2,每21天重复。每组至少3例,如1个剂量组中3例均无剂量限制性毒性(dose-limiting toxicity,DLT)出现,则进入下1个剂量组,直至出现DLT,DLT的低一剂量水平即为MTD。结果:17例患者共完成58个周期化疗,进行3个剂量组的研究(洛铂分别为30、35、40 mg/m2),完全缓解(complete response,CR)0例,部分缓解(partial response,PR)1例,疾病稳定(stable disease,SD)10例,疾病进展(progression disease,PD)3例;有效率(response rate,RR,CR+PR)为7.1%(1/14),疾病控制率(disease control rate,DCR,CR+PR+SD)为78.6%(11/14)。主要不良反应为白细胞下降,3例出现DLT,其中2例发生在洛铂40 mg/m2组。确定洛铂35 mg/m2组为MTD。结论:本组洛铂联合固定剂量多西紫杉醇的MTD为35 mg/m2,其不良反应可耐受。
剂量递增;洛铂;多西紫杉醇;二线化疗;恶性肿瘤
据统计,我国恶性肿瘤发病率呈逐年上升趋势[1]。很多患者在临床确诊时已是晚期,失去手术根治机会,化疗成为肿瘤治疗的重要手段之一,但大部分患者在一线化疗后会出现疾病进展,需要二线及以上治疗。
以顺铂为基础的化疗方案在癌症治疗中发挥了重要作用。但由于其严重的不良反应限制了应用。洛铂是第3类铂类抗癌药物,具有抗癌活性强、无明显的肾毒性、神经毒性、无需水化、耐药发生率远低于顺铂,且与顺铂无交叉耐药等优点[2-3]。有临床研究显示,洛铂对多种肿瘤有效[4-6]。
多西紫杉醇通过与游离的微管蛋白结合,促进微管蛋白装配成稳定的微管并抑制其解聚,抑制细胞的有丝分裂和增殖。有研究表明,洛铂联合多西紫杉醇对于化疗后进展的肿瘤患者有一定疗效,且二者联合具有协同作用[5]。国外洛铂的单药推荐剂量为50 mg/m2[7-10],而联合方案中洛铂的剂量尚未有Ⅰ期研究报道。有研究表明,东、西方人群对于相同剂量的化疗有不同的耐受性,联合方案中的可耐受剂量相当于西方人群的70%~80%[11-15]。因此,基于西方人群得出的洛铂剂量是否能够用于中国患者尚不明确。为了确定联合方案中洛铂的最大耐受剂量,我们进行了洛铂的剂量递增试验。
1 资料和方法
1.1 入选标准
经病理或细胞学证实的、既往治疗失败的晚期实体肿瘤患者,经临床评估适合应用多西紫杉醇联合洛铂化疗的患者,至少有1处可评价病灶,临床分期Ⅲ~Ⅳ期。入组标准:年龄为18~75岁;KPS评分≥60;预计生存期≥3个月;距离上次治疗时间≥4周;骨髓情况:白细胞计数≥4.0×109/L,粒细胞≥1.5×109/L,血小板≥100×109/L,血红蛋白≥100 g/L;肝肾功能、心肺功能正常,无明显感染、消化道出血及其它严重的内科疾病;未应用过洛铂;既往6个月未应用过多西紫杉醇;患者签署知情同意书。
1.2 患者资料
2012年5月—2013年11月华北石油管理局总医院收治的恶性实体肿瘤患者17例,其中男性9例,女性8例,年龄为45~75岁。其中非小细胞肺癌(non small cell lung cancer,NSCLC)11例,小细胞肺癌(small cell lung cancer,SCLC)2例,乳腺癌2例,胃癌1例,子宫内膜癌1例。ⅢA期患者1例;ⅢB期患者2例;Ⅳ期患者14例(表1)。

表1 患者一般资料Tab. 1 Patient characteristics
1.3 方法
1.3.1 治疗方法
将固定剂量多西紫杉醇(购自扬子江药业集团有限公司,20 mg/支)按60 mg/m2加入到250 mL的5%葡萄糖中稀释后静脉滴注,第1天[13-15],预防性抗过敏治疗;洛铂(购自海南长安国际制药有限公司,10 mg/瓶)首先加入5 mL无菌注射用水溶解,再加入250 mL的5%葡萄糖稀释后静脉滴注2 h,第2天;每21天重复,至少完成2个周期,治疗至疾病进展或出现不可耐受的不良反应,最多应用6个周期化疗。
1.3.2 剂量递增及剂量限制性毒性(dose-limiting toxicity,DLT)的确定
应用改良的Fibonacci法[16],洛铂起始剂量为30 mg/m2,以5 mg/m2进行组间递增,患者按照入组顺序接受治疗,逐渐从低剂量组至高剂量组,每组至少入选3例患者,如1个剂量组的3例均无DLT出现,则开始下1个剂量组,但不得对同一患者进行反复试验。如果某1个剂量组出现1例DLT,则该剂量组需要增加3例患者,增加的3例患者如不再出现DLT,可继续下1个剂量组试验;如果再入组的3例患者又发生1例及以上的DLT,终止试验。认为此剂量即为DLT剂量,低一剂量组即为最大耐受剂量(maximumtolerated dose,MTD)。DLT定义:①血液学毒性,粒细胞减少Ⅳ级,粒细胞减少Ⅲ级伴粒细胞减少性发热,Ⅲ~Ⅳ级血小板减少,Ⅲ~Ⅳ级贫血;②非血液学毒性(除脱发和恶心、呕吐、乏力外)Ⅲ~Ⅳ级;③任何Ⅴ级反应。任何出现DLT的患者如果可以再接受化疗,会接受低一剂量水平即MTD的剂量。
1.3.3 评定标准
不良反应评价依据Common Terminology Criteria for Adverse Events v3.0。应用RECIST1.1进行近期疗效评价[17]。不良反应在DLT观察期(即从化疗第1天开始一直到第3个周期化疗前1周)所有时间段中均评价,每化疗2个周期后进行疗效评价。疗效评价分为:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progression disease,PD)。有效率(response rate,RR)为CR+PR,疾病控制率(disease control rate,DCR)为CR+PR+SD。
1.4 随访
采取门诊复查和电话随访,所有患者均随访直至任何原因出现死亡。截止2014年5月,随访率100%。
1.5 统计学处理
数据分析采用SPSS 18.0软件进行统计分析,采用Kaplan-Meier法计算患者的疾病进展时间(time to progression,TTP)。
2 结 果
2.1 化疗周期完成情况
17例患者共完成58个周期化疗,化疗周期中位数为4(范围1~6),其中,2例患者完成1个周期化疗,6例患者完成2个周期化疗,5例患者完成4个周期化疗,4例患者完成6个周期化疗。在全组中,14例可评价疗效,17例可评价不良反应。
2.2 MTD的确定
从化疗起始剂量洛铂为30 mg/m2开始,分别进行了30 mg/m2、35 mg/m2、40mg/m2共3个剂量组的试验(表2)。以洛铂为30 mg/m2入组3例患者,未出现DLT,遂以洛铂为35 mg/m2入组3例患者,也未出现DLT,为进一步评价洛铂为35 mg/m2的不良反应,以当前剂量水平又入组了7例患者,观察到1例Ⅳ级中性粒细胞减少。即在洛铂为35 mg/m2组中,10例患者出现了1例DLT。此患者为肺癌多发骨转移,既往曾应用多疗程化疗,骨髓功能差,7 d后恢复正常。说明此剂量水平耐受性良好,因此,不把洛铂35 mg/m2作为DLT。当进入洛铂为40 mg/m2(第Ⅲ剂量水平)组时先入组3例患者,第1例化疗1个周期后因合并胰腺炎退出试验,考虑胰腺炎发生与化疗无直接相关性。第2例化疗1个周期后第11天出现了Ⅲ级血小板减少(26×109/L),第12天大咯血死亡。大咯血原因可能是肿瘤退缩过快,引起大血管破损[18],未评价为化疗相关性死亡,患者出组。第3例出现Ⅳ级中性粒细胞减少,被评价为第1个DLT。随即我们开始第Ⅲ剂量水平的第2组试验,拟再入组3例,但是第1例患者,即出现Ⅲ级中性粒细胞减少伴发热,被评价为DLT,因此,立即停止试验。第Ⅲ剂量组共进行了2组观察,共入组4例患者,2例出组,分别是1例合并胰腺炎者和1例肿瘤快速退缩而咯血死亡者。而其他2例均出现DLT,提示此剂量患者不能耐受。因此,确定40 mg/m2剂量水平即为DLT,剂量递增停止。即在洛铂为30 mg/m2、洛铂为35 mg/m2时均未出现DLT,当洛铂为40 mg/m2剂量水平时出现2例DLT,根据试验设计,确定其低一剂量组即为MTD,即洛铂为35 mg/m2组为MTD。
2.3 近期疗效
14例患者可评价疗效,其中CR 0例,PR 1例,SD 10例,PD 3例;RR为7.1%(1/14),DCR为78.6%(11/14)。在11例NSCLC患者中,9例可评价疗效,其中PR 1例,SD 6例,PD 2例;RR为11.1%(1/9),DCR为77.8%(7/9)。
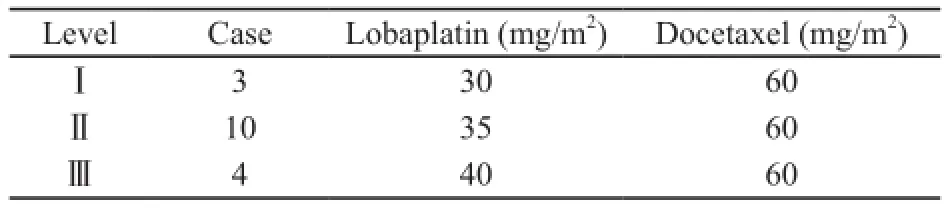
表2 洛铂各剂量组及病例数Tab. 2 Dose escalation level of lobaplatin and cases
2.4 不良反应
2.4.1 血液学毒性
主要不良反应为骨髓抑制。白细胞减少发生率为82.35%;中性粒细胞减少发生率为58.82%,其中Ⅲ、Ⅳ级中性粒细胞减少发生率分别为29.41%、11.76%;贫血发生率为58.82%;血小板减少发生率为46.2%,其中Ⅲ级血小板减少发生率为5.88%(表3)。
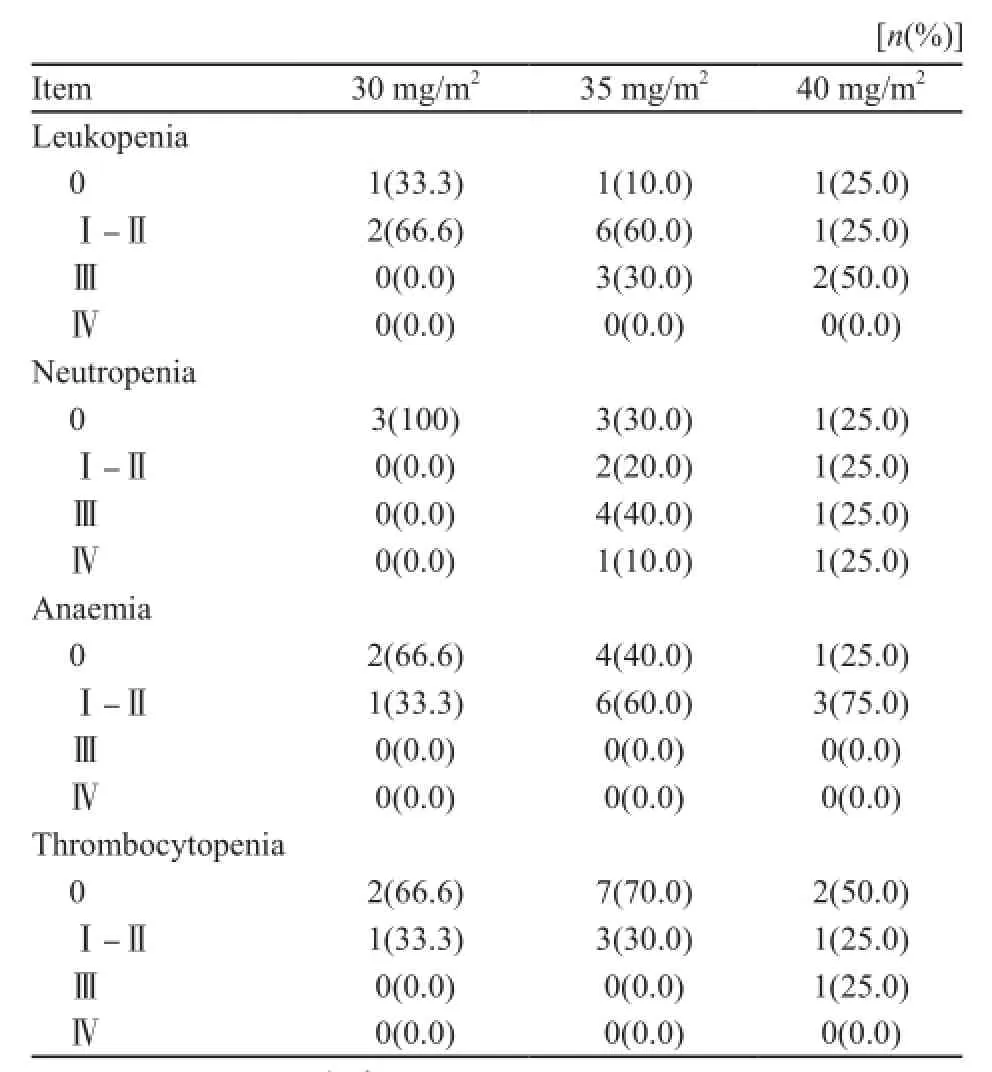
表3 洛铂各剂量组血液学毒性Tab. 3 The hematologic toxicities
2.4.2 非血液学毒性
非血液学毒性均为Ⅰ~Ⅱ级(表4)。
2.5 生存分析
经过短期随访,获得了患者的初步生存情况。所有患者中位TTP为132 d(95%CI:42~223 d,图1)。NSCLC患者中位TTP为177 d(95%CI:100~255 d,图2)。

表4 非血液学毒性Tab. 4 The non-hematologic toxicity
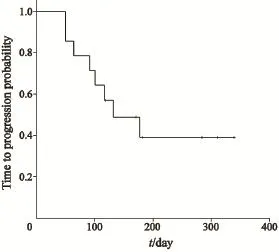
图1 实体瘤患者洛铂联合多西紫杉醇治疗后的无进展生存期Fig. 1 The TTP of solid tumor patients treated with lobaplatin and docetaxel
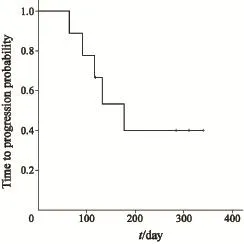
图2 NSCLC患者洛铂联合多西紫杉醇治疗后的无进展生存期Fig. 2 The TTP of NSCLC patients with lobaplatin and docetaxel
3 讨 论
洛铂与顺铂作用机制相似,通过形成Pt-GG和Pt-AG链内交叉连接,阻断DNA的复制和转录过程,干扰肿瘤细胞的表达。洛铂的药代动力学参数在中国人中优于西方人群[19-20]。国内一般应用洛铂的剂量为30~50 mg/m2,单药为50 mg/m2,联合用药为30 mg/m2,每3~4周重复[21]。但是其剂量并非基于严格的临床Ⅰ~Ⅱ期试验。有研究提示洛铂与多西紫杉醇具有协同抗肿瘤作用[5],并且多西紫杉醇对于多种恶性实体肿瘤有效。因此,我们选择了洛铂联合多西紫杉醇的Ⅰ期临床研究,以期得出洛铂在联合方案中的最大耐受剂量。
本研究的4例DLT中有3例是粒细胞减少症,而非其他研究报道的严重血小板减少症。多个临床试验表明,洛铂单药(50 mg/m2)Ⅲ~Ⅳ级血小板减少的发生率为26.0%~72.7%[7-8],而在洛铂的联合化疗中,洛铂的剂量多为30 mg/m2,Ⅲ~Ⅳ级血小板减少的发生率为5.0%~23.8%[22-23],远低于单药化疗。因此,我们也考虑血小板减少的发生主要与洛铂剂量相关。本研究分别设立洛铂为30 mg/m2、35 mg/m2、40 mg/m2组,Ⅲ~Ⅳ级血小板减少发生率为5.9%(1/17),本研究的洛铂用量均低于单药洛铂剂量,且Ⅲ~Ⅳ级血小板减少发生率低于单药洛铂,Ⅲ级血小板减少发生于40 mg/m2组,也证实血小板减少发生率与洛铂剂量有关。本研究大多数不良反应为轻度或中度,这些不良反应经对症治疗处理均能顺利恢复正常,耐受性较好,无治疗相关性死亡。
本研究显示,RR为7.1%(1/14),DCR为78.6%(11/14)。在NSCLC患者中,RR为11.1%(1/9),DCR为77.8%(7/9)。而何安兵等[24]报道的洛铂30 mg/m2联合多西紫杉醇75 mg/m2二线治疗NSCLC的RR为26.7%(4/15),DCR为 73.3%(11/15),张彦等[23]报道的洛铂30 mg/m2联合多西紫杉醇75 mg/m2治疗蒽环类耐药的晚期乳腺癌患者的RR为54.8%(23/42),DCR为80.9%(34/42)。与本研究的RR相差较多,考虑原因可能包括:①乳腺癌的二线治疗效果明显优于NSCLC,本研究入组的主要是NSCLC;②在NSCLC治疗中,本研究包含一部分三线治疗的患者,而何安兵等所进行的NSCLC研究均为二线治疗。但本研究的DCR与两者的报道相一致[23-24]。
在NSCLC患者中,本研究的中位TTP为177 d(95%CI:100~255 d)。Weiss等[25]综述了晚期NSCLC的二线治疗,细胞毒类化疗药二线治疗NSCLC的TTP为55~87 d,表皮生长因子受体酪氨酸激酶抑制剂二线治疗NSCLC的TTP为48~108 d,与本研究的TTP对比显著,并且本研究有27%(3/11)的三线患者。因此,无论从RR还是中位TTP来看,本研究的结果都是令人鼓舞的。
综上所述,本研究的洛铂MTD为35 mg/m2,第2天,多西紫杉醇为60 mg/m2,第1天,每21天重复。洛铂联合多西紫杉醇方案治疗化疗后进展的晚期实体肿瘤安全性好,无严重的不良反应,并显示了初步的近期疗效。目前,我们正在应用此剂量进行一项前瞻性Ⅱ期研究,以期进一步评价其疗效和安全性。
[1] 陈万青, 郑荣寿, 曾红梅, 等. 中国恶性肿瘤发病趋势分析和预测 [J]. 中华预防医学杂志, 2012, 46(7): 581-586.
[2] MCKEAGE M J. Lobaplatin: a new antitumor platinum drug[J]. Expert Opin Investig Drugs, 2001, 10(1): 119-128.
[3] SARIS C P, VANDEVART P J, RIETBROEK R C, et al. In vitro formation of DNA adducts by cisplatin, lobaplatin and oxaliplatin in calf thymus DNA in solution and in cultured human cells [J]. Carciogenesis, 1996, 17(12): 2763-2769.
[4] DENG Q Q, HUANG X E, YE L H, et al. Phase Ⅱ trial of Loubo® (Lobaplatin) and pemetrexed for patients with metastatic breast cancer not responding to anthracycline or taxanes [J]. Asian Pac J Cancer Prev, 2013, 14(1): 413-417.
[5] XIE C Y, XU Y P, JIN W, et al. Antitumor activity of lobaplatin alone or in combination with antitubulin agents in non-small-cell lung cancer [J]. Anticancer Drugs, 2012, 23(7): 698-705.
[6] HARSTRICK A, BOKEMEYER C, SCHARNOFKSE M, et al. Preclinical activity of a new platinum analogue, lobaplatin, in cisplatin-sensitive and resistant human testicular, ovarian, and gastric carcinoma cell lines [J]. Cancer Chemother Pharmacol, 1993, 33(1): 43-47.
[7] FIEBIG H H, HENSS H, MROSS K, et al. Phase Ⅰ clinical trial of lobaplatin (D-19466) after intravenous bolus injection[J]. Onkologie, 1994, 17: 142-148.
[8] MANEGOLD C, DRINGS P, GATZEMEIER U, et al. Lobaplatin (D-19466) in patients with advanced non-smallcell lung cancer: a trial of the association for medical oncology (AIO) phase Ⅱ study group [J]. Onkologie, 1996, 19: 248-251.
[9] DEGARDIN M, ARMAND J P, CHEVALLIER B, et al. A clinical screening cooperative group phase Ⅱ evaluation of lobaplatin (ASTA D-19466) in advanced head and neck cancer [J]. Invest New Drugs, 1995, 13(3): 253-255.
[10] KAVANAGH J J, EDWARDS C L, FREEDMAN R S, et al. A trial of lobaplatin (D-19466) in platinum-resistant ovarian cancer [J]. Gynecol Oncol, 1995, 58(1): 106-109.
[11] LIN Q, GAO X S, QIAO X Y, et al. Phase Ⅰ trial of escalating-dose cisplatin with 5-fluorouracil and concurrent radiotherapy in Chinese patients with esophageal cancer[J]. Acta Med Okayama, 2008, 62(1): 37-44.
[12] LIN Q, LIU Y E, CHANG C L, et al. Phase Ⅰ trial of dose escalation of capecitabine combined with fixed docetaxel in previously treated patients with non-small cell lung cancer[J]. Chinese-German J Clin Oncol, 2012, 11(1): 6-10.
[13] LAI C L, TSAI C M, CHIU C H, et al. Phase Ⅱ randomized trial of tri-weekly versus days 1 and 8 weekly docetaxel as a second-line treatment of advanced non-small cell lung cancer[J]. Jpn J Clin Oncol, 2005, 35(12): 700-706.
[14] KUNITOH H, WATANABE K, ONOSHI T, et al. Phase Ⅱ trial of docetaxel in previously untreated advanced non-smallcell lung cancer: a Japanese cooperative study [J]. J Clin Oncol, 1996, 14(5): 1649-1655.
[15] NAKAMURA Y, KUNITOH H, KUBOTA K, et al. Retrospective analysis of safety and efficacy of low-dose docetaxel 60 mg/m2in advanced non-small cell lung cancer patients previously treated with platinum-based chemotherapy[J]. Am J Clin Oncol, 2003, 26(5): 459-464.
[16] RATAIN M J, MICK R, SCHILSKY R L, et al. Statistical and ethical issues in the design and conduct of phase ⅠandⅡclinical trials of new anticancer agents [J]. J Natl Cancer Inst, 1993, 85(20): 1637-1643.
[17] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
[18] CHO K H, AHN S J, PYO H R, et al. A Phase Ⅱ study of synchronous three-dimensional conformal boost to the gross tumor volume for patients with unresectable Stage III nonsmall-cell lung cancer: results of Korean Radiation Oncology Group 0301 study [J]. Int J Radiat Oncol Biol Phys, 2009, 74(5): 1397-1404.
[19] 史健, 袁志芳, 刘伟娜, 等. 国产注射用洛铂在恶性肿瘤患者体内药动学的研究[J]. 中国药学杂志, 2007, 42(24): 1888-1891.
[20] WELINK J, PECHSTEIN B, VANDERVIJQH W J. Determination of the two diastereoisomers of lobaplatin (D-19466) in plasma ultrafiltrate of cancer patients with a normal or an impaired kidney or liver function by high-performance liquid chromatography with ultraviolet detection [J]. J Chromatogr B Biomed Appl, 1996, 675(1): 107-111.
[21] 杨柳青, 秦叔逵. 第3代铂类药物洛铂的研究新进展 [J].临床肿瘤学杂志, 2009, 14(12): 1134-1139.
[22] 杨柳青, 施毅, 秦叔逵, 等. 洛铂联合长春瑞滨治疗晚期非小细胞肺癌的临床研究 [J]. 临床肿瘤学杂志, 2006, 11(12): 890-894.
[23] 张彦, 刘英光, 孙红. 多西他赛联合洛铂治疗蒽环类耐药的晚期乳腺癌疗效分析 [J]. 现代肿瘤医学, 2011, 19(3): 473-474.
[24] 何安兵, 罗云秀, 王群, 等. 洛铂联合多西他赛与多西他赛单药二线治疗晚期非小细胞肺癌的比较 [J]. 临床肿瘤学杂志, 2012, 17(10): 923-926.
[25] WEISS J M, STINCHCOMBE T E. Second-line therapy for advanced NSCLC [J]. Oncologist, 2013, 18(8): 947-953.
Dose escalation of lobaplatin combined with fixed docetaxel in second-line chemotherapy with solid tumors
LIU Yue’e, REN Xiaocang, CHEN Xueji, MA Yan, LI Jing, PENG Yu, GUO Zhijun, CAO Bin,LIN Qiang (Department of Oncology, Hebei Medical University Affliated North China Petroleum Bureau General Hospital, Renqiu Hebei 062552, China)
LIN Qiang E-mail: billhappy001@163.com
Background and purpose:Malignant tumors often relapsed or metastasized after first-line chemotherapy and needed second-line or above treatment. We conducted this study to defne the maximum-tolerated dose (MTD) of lobaplatin with fxed docetaxel for Chinese patients in previously treated solid tumors.Methods:Escalating doses of lobaplatin with fixed docetaxel were administered in a modified Fibonacci sequence. The initial doses were lobaplatin 30 mg/m2and docetaxel 60 mg/m2, respectively. Escalating doses was 5 mg/m2. The regimen was repeated every 21 days. If no dose-limiting toxicity (DLT) was observed, the next dose level was applied. The procedures were repeated until DLT appeared. The MTD was declared to be one dose level below the level at which DLT appeared.Results:Seventeen patients received fifty-eight cycles chemotherapy at lobaplatin of level Ⅰ (30mg/m2), level Ⅱ (35 mg/m2)and level Ⅲ(40 mg/m2). Cases of complete response (CR), partial response (PR), stable disease (SD) and progression disease (PD) for the whole group were 0, 1, 10 and 3, respectively. Response rate (RR, CR+PR) and disease control rate (DCR, CR+PR+SD) were 7.1% (1/14) and 78.6% (11/14), respectively. The most common toxicity was leukopenia. Three DLTs occurred in 3 patients in the whole group, including 2 DLTs in dose level Ⅲ. We declared thus level Ⅱ was MTD.Conclusion:MTD of lobaplatin in our research was 35 mg/m2combined with fixed dose of docetaxel. This combination regimen was well tolerated.
Dose escalation; Lobaplatin; Docetaxel; Second-line chemotherapy; Malignant tumor
10.3969/j.issn.1007-3969.2015.03.009
R730.53
A
1007-3639(2015)03-0211-06
2014-04-29
2014-11-27)
蔺强 E-mail:billhappy001@163.com
