致动脉粥样硬化过程中不同表型的巨噬细胞对泡沫细胞形成的影响及机制
2015-01-04尚茹茹刘晓红
尚茹茹,刘晓红,张 锦,袁 锋,温 婷
致动脉粥样硬化过程中不同表型的巨噬细胞对泡沫细胞形成的影响及机制
尚茹茹1,刘晓红2,张 锦2,袁 锋3,温 婷3
目的 探讨致动脉粥样硬化过程中不同表型的巨噬细胞对泡沫细胞形成的影响及机制。方法 提取C57BL/6小鼠骨髓单核细胞诱导分化为巨噬细胞,分别给予干扰素γ(IFN-γ)、内毒素(LPS)、白细胞介素4(IL-4)刺激分化为M1和M2型巨噬细胞,加入氧化型低密度脂蛋白(ox-LDL)孵育48 h。高效液相色谱法(HPLC)检测细胞内的总胆固醇(TC)、游离胆固醇(FC)及胆固醇酯(CE)的含量。行RT-PCR及Westernblot检测巨噬细胞清道夫受体CD36及SR-A1在mRNA和蛋白水平的表达;行Westernblot检测内质网应激(ERS)的标志性分子糖调节蛋白78 ( GRP78)和GRP94的表达。结果 M1型巨噬细胞组油红O染色阳性细胞较M2型巨噬细胞组少,M1型巨噬细胞内TC、FC及CE的含量较M2型巨噬细胞低(P<0.05)。清道夫受体CD36及SR-A1在M2型巨噬细胞的表达高于M1型巨噬细胞,内质网应激的标志性分子糖调节蛋白78和糖调节蛋白94的表达在M2型巨噬细胞高于M1型巨噬细胞。结论 在ox-LDL刺激下M2型巨噬细胞较M1型巨噬细胞更易形成泡沫细胞,其机制可能是由于内质网应激增加了清道夫受体CD36及SR-A1在M2型巨噬细胞的表达,促进了M2型巨噬细胞对ox-LDL的吞噬。
动脉粥样硬化;巨噬细胞; 泡沫细胞; 表型
动脉粥样硬化(AS)是心脑血管疾病的主要病理基础。单核/巨噬细胞在动脉粥样硬化的病理过程中发挥着重要作用[1]。在体内外不同微环境影响下巨噬细胞可分化为M1型(经典活化型)和M2型(替代活化型),在干扰素γ(IFN-γ)加内毒素(LPS)诱导下可分化为M1型,分泌大量的IL-12、IL-23及肿瘤坏死因子-α(TNF-α)等炎性细胞因子,参与炎症反应、病原体的清除及活性氧的表达,具有促AS作用;在IL-4诱导下分化为M2型,IL-10及精氨酸酶等的分泌和表达增多,有抑炎及促损伤修复的作用[2,3]。巨噬细胞通过清道夫受体途径吞噬氧化型低密度脂蛋白(ox-LDL)形成泡沫细胞是动脉粥样硬化的重要环节[4]。近年来研究发现内质网应激通过上调清道夫受体CD36的表达促进了巨噬细胞源性泡沫细胞而形成,参与了AS的启动和进展[5]。那么经诱导分化形成的M1/M2型巨噬细胞吞噬脂质能力是否有所不同,这一差别是否与内质网应激调控的清道夫受体的表达有关需要进一步研究。
1 材料与方法
1.1 实验材料 C57BL/6小鼠购自山西医科大学动物中心;巨噬细胞集落刺激因子(M-CSF)、IL-4、LPS、IFN-γ;ox-LDL(北京协生生物有限公司);RT-PCR试剂盒(FERMENTA公司);cDNA合成试剂盒和Real Master Mix(SYBR Green )试剂盒(Takara,日本);辣根过氧化物酶标记山羊抗兔IgG(北京中杉金桥公司);兔抗CD36、SR-A1、GRP78和GRP94多克隆抗体(Santa Cruz公司)。
1.2细胞培养及分组 据文献方法[6],将分化的巨噬细胞按1×108个/L的密度种入6孔板内,分成3组:空白对照组、IFN-γ+LPS处理组、IL-4处理组。IFN-γ+LPS处理组加入20 ng/mL IFN-γ和LPS100 ng/L分化成M1型巨噬细胞,IL-4处理组加入20 ng/mL-4分化成M2型巨噬细胞,孵育24 h。然后,在IFN-γ+LPS组、IL-4组中分别加入40 ng/mL ox-LDL孵育48 h,空白组不行任何处理。实验组每组设3个复孔。
1.3 行油红O染色观察 M1/M2型细胞内脂质的聚集情况:将细胞培养在放有无菌盖玻片的6孔板内,处理结束后用PBS洗3次,4%多聚甲醛固定15 min,PBS洗1次,再用丙二醇固定5 min,弃丙二醇,加入0.5%油红O的丙二醇溶液,置60℃烤箱中染色15 min,用85%丙二醇冲洗5 min,再用PBS 洗3次,蒸馏水洗1次,苏木素复染2 min~5 min,1%HCl分色及返蓝后
封片,显微镜下观察到:脂滴染成红色,细胞核染成蓝色。
1.4 细胞内胆固醇含量测定[7]处理结束后弃上清PBS洗3次,用细胞刮刀刮取细胞置于离心管中,反复冻融,冰浴中超声裂解细胞。用于提取总胆固醇和游离胆固醇。胆固醇用外标法峰面积定量细胞蛋白。
1.5 RT-PCR检测CD36和SR-A1 按Trizol试剂盒说明书提取细胞总RNA。取2 μg RNA逆转录合成cDNA产物。按RT-PCR试剂盒说明书准备20 μ gPCR扩增反应体系,以β-actin为内参,利用2-△△Ct公式计算目的基因的表达情况。
1.6 Western blot检测CD36、SR-A1、GRP78和GRP94的表达 处理结束后收集细胞并裂解后移至一个新EP管中,用BCA法测蛋白浓度。然后配置8% SDS-PAGE凝胶进行电泳分离,结束后转至硝酸纤维素膜(NC)膜上,根据Marker的位置裁剪所需的目的蛋白、内参条带对应的膜,5%脱脂奶粉封闭后分别用兔抗鼠CD36(1∶400)、SR-A1 (1∶300)、GRP78 (1∶400)、GRP94抗体(1∶200)和抗β-actin抗体(1∶5 000),4℃孵育过夜。次日,洗膜后加入辣根过氧化物酶标记的二抗室温孵育2 h。用Odyssey分析蛋白的表达。

2 结 果
2.1 油红O染色结果 空白对照(MO)无油红O,M2型巨噬细胞内油红O较M1型巨噬细胞多。
2.2 HPLC法检测泡沫细胞内胆固醇含量 M2型巨噬细胞内TC、FC 和CE的含量高于M1型巨噬细胞。详见表1。
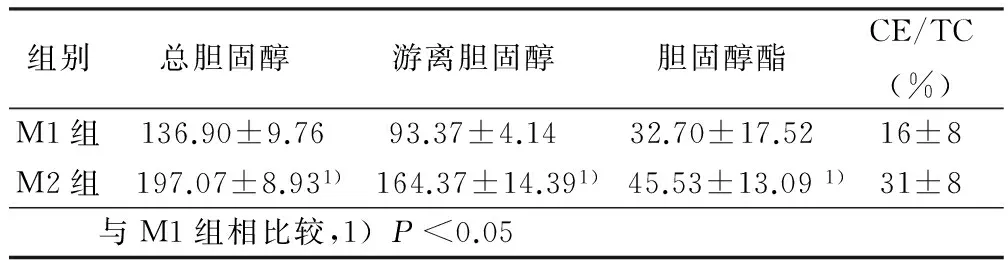
表1 M1/M2型巨噬细胞内胆固醇含量
2.3 M1/M2型巨噬细胞源性泡沫细胞CD36、SR-A1、GRP78和GRP94的表达 M2型巨噬细胞在mRNA水平和蛋白水平上,CD36和SR-A1的表达均高于M1型巨噬细胞;M1型巨噬细胞在蛋白水平GRP78和GRP94的表达低于M2型巨噬细胞。详见表1、表2、图1。


指标M1M2PCD360.90±0.132.57±0.570.01SR-A11.24±0.272.57±0.740.04

图1 M1和M2型巨噬细胞CD36、SR-A1、GRP94及GRP78在蛋白水平的表达
3 讨 论
本实验用ox-LDL诱导M1型和M2型巨噬细胞泡沫化,行油红O染色示M2型巨噬细胞内的油红O较M1型巨噬细胞多。行HPLC法检测细胞内脂质含量发现M2型巨噬细胞内的TC、FC 和CE均高于M1型巨噬细胞。清道夫受体(主要是CD36和SR-A1)介导的ox-LDL无限制摄取是泡沫细胞形成和AS发生发展的重要环节[8],推测M2型巨噬细胞吞入胆固醇含量较M1型巨噬细胞吞入胆固醇含量多的原因可能是:M2型巨噬细胞表达的清道夫受体CD36和SR-A1较M1型多。用RT-PCR和Western blot检测发现:M2型巨噬细胞在mRNA水平和蛋白水平上,CD36和SR-A1的表达均高于M1型巨噬细胞。
内质网是调控蛋白质和钙稳态的重要细胞器,主要调控细胞内蛋白的合成、折叠、修饰和运输以及钙稳态。氧化应激、胆固醇超负荷、钙稳态失衡等理化环境变化均可导致内质网功能紊乱,出现以未折叠/错误折叠蛋白聚集和钙稳态失衡为主要特征的内质网应激反应[9]。内质网功能紊乱首先导致蛋白质的合成和运输障碍,造成大量未折叠或错误折叠蛋白在内质网中堆积,后者称为未折叠蛋白反应(UPR)。GRP78、GRP94及蛋白激酶样内质网激酶( PERK)等上调均为内质网应激发生的标志。ERS诱导剂衣霉素可上调巨噬细胞清道夫受体 CD36表达水平[10]。内质网应激和未折叠蛋白反应能诱导清道夫受体CD36和SR-A1的表达[11]。行Western blot检测经过ox-LDL刺激后M2型巨噬细胞GRP78和GRP94的表达高于在M1型巨噬细胞。推测M2型巨噬细胞较M1型巨噬细胞更易形成泡沫细胞,可能是ox-LDL作用后M2型巨噬细胞更易发生ESR,促使清道夫受体CD36和SR-A1在M2型上的表达增高,增加了对ox-LDL的摄入。
[1] Liu YanCun,Zou XianBiao,Chai YanFen.Macrophage polarization in inflammatory diseases[J].Int J Biol Sci,2014,10(5): 520-529.
[2] Lauran SJ,Marion JG,Saskiavan der Velden,et al.Distribution of macrophage polarization markers in human atherosclerosis[J].Atherosclerosis,2012,225(2):461-468.
[3] Woollard KJ,Geissmann F.Monocytes in atherosclerosis:Subsets and functions[J].Nat Rev Cardiol,2010,7(2):77-86.
[4] Young MI.Park.CD36,ascavenger receptor implicated in atherosclerosis[J].Experimental &Molecular Medicine,2014,46(6):1-7.
[5] Yao Shutong,Miao Cheng,Tian Hua,et al.Endoplasmic reticulum stress promotes macrophage-derived foam cell formation by up-regulating cluster of differentiation 36(CD36) expression[J].J Biological Chemistry,2014,289(7):4032-4042.
[6] Alexander F,Joerg H,Soenke W,et al.Generation of mature murine monocytes from heterogeneous bone marrow and description of their properties[J].J Histochemistry & Cytochemistry,2011,59(9):813-825.
[7] 王术玲,潘华新,王培训.THP-1巨噬细胞源性泡沫细胞模型的建立及鉴定[J].中药新药与临床药理,2009,20(3):281-285.
[8] Seimon T,Tabas I.Mechanisms and consequences of macrophage apoptosis in atherosclerosis[J].J Lipid Res,2009,50(Suppl):S382-S387.
[9] Cao SS,Kaufman RJ.Targeting endoplasmic reticulum stress in metabolic disease[J].Expert Opin Ther Targets,2013,17(4):437-448.
[10] Hua Y,Kandadi MR,Zhu M,et al.Taurour-sodeoxycholic acid attenuates lipid accumulation in endoplasmic reticulum-stressed macrophages[J].J Cardiovasc Pharmacol,2010,55(1):49-55.
[11] Erbay E,Babaev VR,Mayers JR,et al.Reducing endoplasmic reticulumstress through amacrophage lipid chaperone alleviates atherosclerosis[J].Nat Med,2009,15:1383-1391.
(本文编辑 王雅洁)
山西省科学技术厅项目(No.2014011043-5)
1.山西医科大学第一临床医院(太原 030001);2.山西省人民医院;3.山西医科大学
刘晓红,E-mail: docliuxh@163.com
R540 R285
A
10.3969/j.issn.1672-1349.2015.11.009
1672-1349(2015)11-1273-03
2015-02-09)
