硫酸亚铁铵制备实验的改进
2015-01-03徐敏
徐 敏
(成都理工大学 材料与化学化工学院, 四川 成都 610059)
硫酸亚铁铵制备实验的改进
徐 敏
(成都理工大学 材料与化学化工学院, 四川 成都 610059)
硫酸亚铁铵制备的经典方法是经过蒸发,浓缩,冷却来得到晶体,既耗时长,Fe2+又易氧化,影响硫酸亚铁铵产率及等级。此次改进利用复盐的溶解度比组成它的简单盐溶解度小的特点,而硫酸亚铁铵又不溶于乙醇及水与乙醇可任意比互溶的特征,通过常压过滤于乙醇中,即刻可得浅蓝绿色硫酸亚铁铵单斜结晶,省去经典方法中的蒸发、浓缩,冷却步骤,同时也有利于防止Fe2+被氧化。
硫酸亚铁铵;结晶;溶解度
硫酸亚铁铵为浅蓝绿色单斜晶体,在空气中较稳定,溶于水但不溶于乙醇,因价格低,工艺简单,容易得到比较纯净的晶体而得到应用广泛;在工业上常用于废水处理的混凝剂,基准物质,在分析化学中通常做为基准物质[1]。
1 实验原理
像所有复盐一样,硫酸亚铁铵在水中的溶解度比组成它的任何一个组分FeSO4或(NH4)2SO4的溶解度都要小,如表1所示,因此从FeSO4和(NH4)2SO4的混合液中很容易得到结晶的硫酸亚铁铵。

表1 FeSO4·7H2O,(NH4)2SO4,硫酸亚铁铵在水中的溶解度Table 1 The solubility of FeSO4·7H2O,(NH4)2SO4, ammonium ferrous sulfate in waterg/mL
本实验采用Fe粉与硫酸作用,生成FeSO4,往制得的FeSO4溶液中加入(NH4)2SO4并使其全溶解,趁热过滤与乙醇溶液中即得到溶解度较小的硫酸亚铁铵晶体。
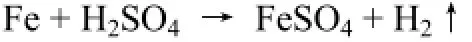
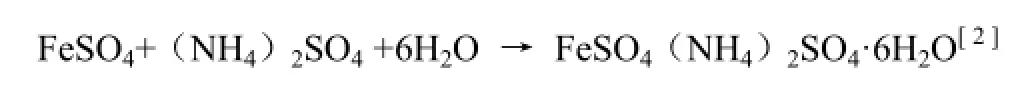
用目测比色法可估计产品中所含杂质Fe3+的量,由于Fe3+与SCN-生成红色的物质[Fe(SCN)n]3-n,红色越深,表明制得的成品中Fe3+越多;红色越浅制得的成品中Fe3+越少。所以将所制得的FeSO(NH4)2SO4·晶体与KSCN溶液在比色管中配制成待测溶液,将它与含一定量Fe3+标准[Fe(SCN)n]3-n系列进行比较,根据红色深浅程度情况,即可知制得的FeSO4(NH4)2SO4晶体中Fe3+的含量,从而确定产品的等级[3]。
2 实验内容
2.1 FeSO4的制备
往盛有1.0 g铁粉(1)的100 mL洁净烧杯中加入20 mL 3 mol·L-1H2SO4, 在电热板上低温加热,观察加热过程中水分的流失,以免FeSO4晶体的析出(注意控制溶液pH≯1),当Fe粉与稀H2SO4反应不再冒泡停止加热,趁热常压过滤与100 mL烧杯中,残渣取出称重,根据已作用的Fe粉,计算出FeSO4的理论产量。
2.2 硫酸亚铁铵的制备
根据制得FeSO4的量,计算并称出所需要(NH4)2SO4的用量,并将其加入到制得的FeSO4溶液中,同时在水浴中搅拌使其完全溶解。将制得的FeSO4与(NH4)2SO4的混合液趁热常压过滤与盛有50 mL无水乙醇的100 mL烧杯中,观察硫酸亚铁铵晶体的析出,待晶体完全析出后,将上层乙醇清液倾出并回收,烧杯中晶体用少量乙醇清液清洗至布氏漏斗中,进行减压过滤,即得浅蓝绿色硫酸亚铁铵晶体,用电吹风低温吹干称重。

2.3 成品检验
称取1.0 g产品与25 ml比色管中,加入2 mL 2 mol·L-1HCl和1 mL 1 mol·L-1KSCN溶液,摇匀后稀释至刻度,与下列标准系列进行目视比色,得出成品等级。
吸取Fe3+标准溶液(0.010 0 mg·mL-1(2))5、10、 20 mL与3支25 mL比色管中,在3支比色管中各加入2 mL 2 mol·L-1HCl和1 mL 1 mol·L-1KSCN溶液,并稀释至刻度摇匀。配制好的比色管溶液中各含Fe3++0.05 mgⅠ级标准,0.10 mgⅡ级标准,0.20 mgⅢ级标准[5-7]。
3 实验结果与讨论
数据记录与整理 (见表2)。
此方法的优点在于:
(1)因为不需要蒸发,从而有效防止了Fe2+的氧化,提高了硫酸亚铁铵的产率及等级;
(2)与经典方法相比缩短实验时间1 h左右;
(3)缩短实验时间1 h左右;
(4)实验中所用乙醇还可回收经重蒸馏重复使用,大大降低实验成本。
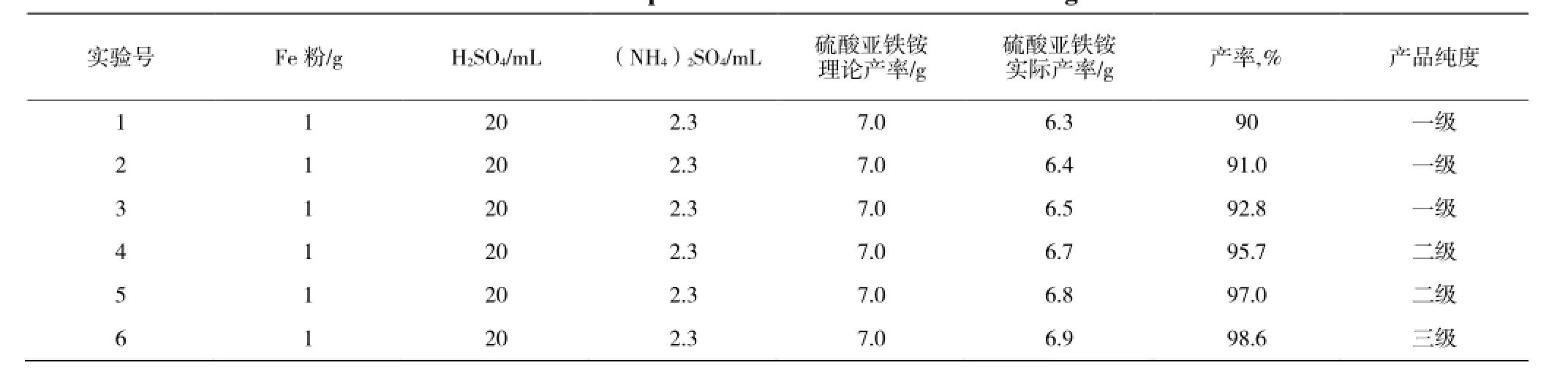
表2 实验数据记录与整理Table 2 The experimental data record and finishing
[1]北京师范大学无机化学教研室等编.无机化学实验[M]. 第三版. 北京: 高等教育出版社, 2004-8-30.
[2]梁渠. 近代基础化学实验[M]. 北京:化学工业出版社,2008-09-01.
[3]张勇主. 现代化学基础实验[M].第三版.北京: 科学出版社,2010-08-01.
[4]大连理工大学无机化学教研室.无机化学实验[M].第二版.北京:高等教育出版社,2004-06-0.
[5]陈秉堄. 普通无机化学实验[M].第二版.上海:同济大学出版社,2006 -07.
[6]中山大学等校编 无机化学实验[M].第三版. 北京:高等教育出版社,2010-04-01.
[7]孟祥丽. 现代化学基础实验[M].第1版. 哈尔滨:哈尔滨工业大学出版 社,2008-04-01.
Improvement of Preparation Experiment of Ammonium Ferrous Sulfate
XV Min
(College of Materials and Chemistry&Chemical Engineering, Chengdu University of Technology, Sichuan Chengdu 610059,China)
Classic method of preparing ammonium ferrous sulfate is to gain crystals via evaporation, concentration and cooling processes. The method needs long time and Fe2+is easily oxidized, which can affect product yield and level of ammonium ferrous sulfate. Because double salt solubility is lower than single salt solubility, ammonium ferrous sulfate is insoluble in ethanol, but water and ethanol are mutually soluble, blue green ammonium ferrous sulfate monoclinic crystalline can be obtained through the atmospheric pressure filtration, so evaporation , concentration and cooling processes in the classic method may be saved, and Fe2+can be prevented from oxidation
Ammonium ferrous sulfate;Crystal;Solubility
TQ 115
: A
: 1671-0460(2015)01-0037-02
2014-07-11
徐敏,女,四川成都人,实验师,1990年毕业于成都地质学院化学专业,从事实验室技术工作。E-mail:283231450@qq.com。
