五种中草药水溶性多糖对α-葡萄糖苷酶活性的影响
2015-01-03陈丽华曹可生彭勤龙潘自红马庆一
陈丽华,曹可生,彭勤龙,潘自红,马庆一
(平顶山学院化学化工学院,河南 平顶山 467000)
五种中草药水溶性多糖对α-葡萄糖苷酶活性的影响
陈丽华,曹可生,彭勤龙,潘自红,马庆一
(平顶山学院化学化工学院,河南 平顶山 467000)
从山茱萸、知母、甘草、地榆及诃子中提取水溶性多糖,并通过酶抑制动力学反应考察其对α-葡萄糖苷酶活性的影响。酶动力学反应结果表明:地榆多糖对α-葡萄糖苷酶有激活作用;知母多糖对α-葡萄糖苷酶的活性随时间的变化先激活后抑制;山茱萸多糖、甘草多糖及诃子多糖均对α-葡萄糖苷酶有抑制活性,其中抑制活性最好的是甘草多糖,其抑制率为72.5%;其各自的影响机理还有待进一步研究。
山茱萸;知母;甘草;地榆;诃子;α-葡萄糖苷酶;抑制率
糖尿病是一种以慢性高血糖为特征的代谢紊乱性疾病,已经成为继心血管和肿瘤之后的第三位“健康杀手”[1]。 研究还表明,餐后高血糖对心脑血管并发症的发生有着重要的影响[2],α-葡萄糖苷酶又是血糖产生的关键酶,有效抑制α-葡萄糖苷酶的活性而降低餐后血糖是糖尿病防治的根本办法之一[3],为此以降低α-葡萄糖苷酶活性为目的的糖尿病新药α-葡萄糖苷酶抑制剂的研究逐渐兴起[4-11]。
从近些年来看,α-葡萄糖苷酶抑制剂大多从中草药植物中提取,提取的有效成分包括多糖,皂甙、黄酮、单宁、有机酸和生物碱等几大类[12],其中尤以水溶性多糖提取f分离、纯化时试剂相对安全和其本身没有细胞毒性最为关注,据报道,已有近百种植物多糖被分离提取并进行了结构鉴定,用于探讨其降糖效果和机理研究[13,14]。
1 仪器试剂和材料
FFC-15粉碎机:山东即墨农业机械厂;QYQ微量移液器 :北京表云航空仪表有限公司;ZFQ85A旋转蒸发器:上海医械专机厂;TGL-18C高速台式离心机: 上海安亭科学仪器厂; ZF-C三用紫外灯:上海康禾光电仪器有限公司;80-1离心沉淀器:上海手术器械厂;紫756MC外可见分光光度计 :上海分析仪器厂;85-2磁力搅拌器江苏中大仪器厂;
对硝基苯酚(PNP)仪征市鼎信化工有限公司;α-葡萄糖苷酶 SIGMA;4-硝基苯-α-D-吡喃葡萄糖苷(PNPG) E.Merck公司;拜糖平:购于郑州药店;APD-600大孔树脂 西安树脂厂;山茱萸、地榆、知母、甘草、诃子均购于郑州中药城;其余试剂均为国产分析纯。
2 实验方法
2.1 中草药中多糖成分的提取[15]
取一定量的山茱萸、地榆、知母、甘草、诃子粉碎过40目筛,备用。取5个洁净的500 mL的圆底烧瓶,称取山茱萸、地榆、知母、甘草、诃子等五种中草药粗粉50 g分别加入其中,再分别加入95%乙醇(原料与醇的比为1∶10 w/v),加热回流2 h,热抽滤,取所得滤渣再用95%乙醇(原料与醇比为1∶8 w/v),再回流2 h, 后热抽滤,取滤渣加蒸馏水(原料与水比为1 ∶8 w/v)在55 ℃水浴下搅拌提取2 h,趁热抽滤,收集滤液,滤渣再加蒸馏水(原料与水比为1 ∶6 w/v)再回流提取2 h,趁热减压抽滤,收集并合并前次滤液,减压浓缩至原体积1/3,后加入适量的聚酰胺树脂过夜,后减压抽滤,收集滤液并真空浓缩后,定容,冷藏,待进行其组分的定性检测及酶抑制动力学测定。
2.2 多糖的定性检测[16,17]
α-萘酚试验(Molisch紫环反应):取待检样品水溶液1 mL于试管中,先加入萘酚试剂(5%)3-5滴后充分振摇(注意不要溅出),再沿管壁滴入5-6滴浓硫酸,溶液出现分层,静置,待2~3 min后,观察两层液面间变化(出现紫红色环示有多糖或糖苷)。
三氯化铁试验:取待检样品的水溶液1 mL于试管中,加入FeCl3试剂2滴,观察颜色(呈现绿色、污绿色、蓝黑色或暗紫色示有鞣质类物质)。
明胶试验:取待检检样品的水溶液1 mL于试管中,加NaCl-明胶试剂2~3滴,观察结果(生成白色沉淀物示有鞣质类物质)。
盐酸-镁粉试验:取待检样品少许溶于乙醇中,取该溶液1mL于试管中,先放少量镁粉,然后滴加浓盐酸4~5滴,后置沸水浴中加热2~3 min,观察颜色(出现红色或粉红色有游离黄酮类或黄酮甙)。
泡沫试验:取待检样品的水溶液2 mL加入带塞试管中,用力持续振摇3 min,观察泡沫情况(产生持久性蜂窝状泡沫,泡沫可维持10 min以上且泡沫量应超过液体体积的1/3为皂苷)。
醋酐浓硫酸试验(Liebrmann Burchard反应):取待检样品的水溶液少许,置蒸发皿中水浴蒸干,先加入少量冰醋酸于残渣中使其溶解,再加入醋酐-浓硫酸(19∶1)试剂,观察颜色变化(由黄色转变为红色、紫色、蓝色或绿色为皂苷类)。
氯仿-浓硫酸实验(Tschugaeff反应): 取待检检品的水溶液少许置蒸发皿中,于水浴上蒸干,先加入少量氯仿于残渣中,收集溶液于试管中,后再加入浓硫酸少许于试管,观察氯仿层颜色(呈现红或蓝色,硫酸层有绿色荧光出现)。
溴甲酚绿实验:在干燥的滤纸上滴1滴待检液体,待干燥后喷洒溴甲酚绿指示剂,观察颜色(有机酸即可在蓝色的背景上显黄色)。
2.3 多糖成分抑制效果的测定
2.3.1 α-葡萄糖苷酶活性的测定
方法1:取六支带塞试管,分别加入3 mL缓冲液(pH 6.81)和0.75 mL的PNPG溶液(2 mmol/L),于37℃水浴中保温10 min后,随后再分别加入15 µL的α -葡萄糖苷酶(酶的浓度为5.0 mg/mL), 再于37℃水浴中反应,在2,4,6,8,10,15 min时各取一支加入适量4% Na2CO3用以终止上述反应,在波长400 nm处测定反应液的吸光值【18】。同时用未加酶的反应液为空白对照,以消除PNPG自身水解后产生的对硝基苯酚(PNP)对测定波长下吸光度的影响所造成偏差。
方法2:取一比皿,直接加入3 mL缓冲液(pH6.81)和0.75 mL的PNPG溶液(2 mmol/L),放置10 min后再加入15 µL的α-葡萄糖苷酶(酶的浓度为5.0 mg/mL),每一分钟记录一次吸光度值。同时也用未加酶的反应液为空白对照。
2.3.2 各多糖的酶反应抑制活性的测定
反应体系见表1,操作同2.3.1中的方法2,以反应15 min时的吸光值为基准计算各组分的抑制率,实验以拜糖平标准品为对照。抑制率计算:


表1 各提取液抑制活性的反应体系Table 1 Reaction system for evaluating the effects of extracts on the activity of a-glucosidase
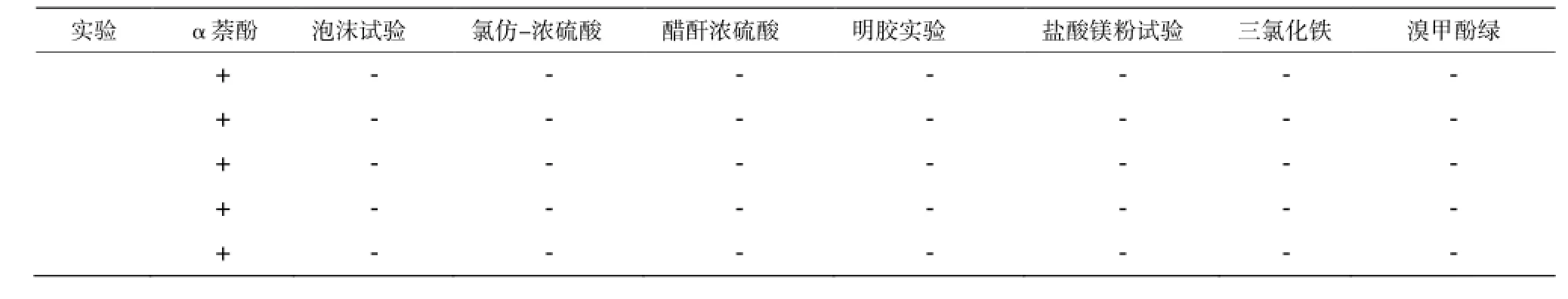
表2 定性检测结果Table 2 The results of qualitative test for inhibitors
3 结果与讨论
3.1 提取率
从山茱萸、地榆、知母、甘草、诃子中提取、分离并部分纯化得到多糖得率分别为2.00%、1.27%、5.2%、3.0%、1.3%。
3.2 多糖成分的定性检测
山茱萸、地榆、知母、甘草、诃子所提取多糖的定性检测结果如表2所示 。
3.3 实验条件的确定和α-葡萄糖苷酶活性的测定
由实验记录的37 ℃和室温26 ℃下所测时间所测得的的吸光度数值,绘制成A~t曲线,如图1所示。
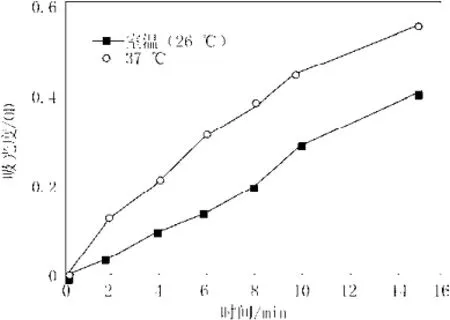
图1 两种温度下A~t曲线图Fig.1 The absorb value curves of different temperature with time
由图1可知,在实验所取的这两个温度下吸光度仅有的差别是绝对数值的不同,但两曲线的变化趋势基本相像(即在同样的时间点上完成从直线到上翘弧线至平台的过渡),鉴于本实验考察的是多糖抑制率,与绝对值关系不大,为此实验拟将传统Tremblay[19]测定法改为在室温下比色皿中直接测定,方便实验进行。
3.4 多糖对α-葡萄糖苷酶活性的作用效果及其与拜堂平的比较
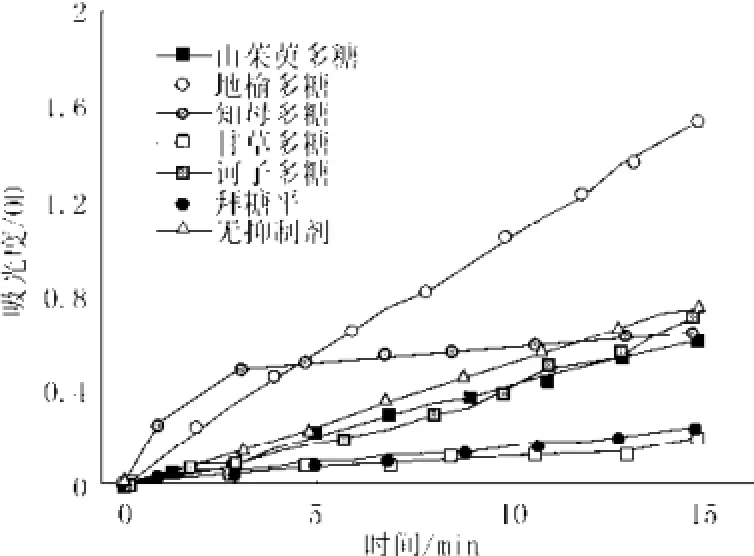
图2 多糖对酶作用的时间与吸光度曲线图(拜糖平为对照)Fig.2 The absorb value curves of all inhibitors extracted from Chinese herbals with time
山茱萸、地榆、知母、甘草、诃子中提取的活性多糖对α-葡萄糖苷酶活性的影响结果如图2所示,各组分对酶的抑制效果及与拜堂平的比较见图2。由图显示结果可知:山茱萸多糖、诃子多糖和甘草多糖均对α-葡萄糖苷酶活性有抑制作用,其中,甘草多糖的抑制性最好;地榆多糖对α-葡萄糖苷酶活性有激活作用;知母多糖对α-葡萄糖苷酶活性的影响随时间的改变而不同,在0~11 min内是激活,11~15 min内是抑制,但抑制效果不显著。
以第15 min的吸光度计算有抑制活性多糖的α-葡萄糖苷酶抑制率,可得诃子多糖抑制率为1.6%,山茱萸多糖抑制率为16.9%,抑制效果最好的是甘草多糖,抑制率为72.5%,且高于同浓度对照品拜糖平(糖平的抑制率为68.5%)。抑制率结果的直方图如图3所示。

图3 各成份的α-葡萄糖苷酶抑制率图Fig.3 The inhibit ratio of all inhibitors extracted from Chinese herbals
4 结论与展望
山茱萸、知母、甘草、地榆及诃子中提取水溶性多糖对α-葡萄糖苷酶活性的影响各不一样,知母多糖对α-葡萄糖苷酶的活性随时间的变化先激活后抑制,在0~11 min内对糖苷酶起激活作用,11~15 min内是抑制作用,但抑制效果不显著;山茱萸、甘草和诃子这三种中草药提取得到的水溶性多糖均对α-葡萄糖苷酶有抑制作用,其中抑制活性最好的是甘草多糖,其抑制率为72.5%,诃子多糖抑制效果极差,仅为1.6%;其各自的影响机理及其它条件都还有待进一步研究。
[1]杨菊红.糖尿病的全球流行现状和未来20年发展趋势-2009年IDF第4版《糖尿病图集》最新数据[J].国际内分泌代谢,2009,29 (6):附录6-1;6-2.
[2]Gaster B.hirschl.B.The effects of improved glycemic control on complication in type 2 diabetes[J].Arch.Intern.Med., 1998, 158:134-141.
[3]刘霞,冯长根.酶抑制剂在抗糖尿病药物中的应用研究[J]. 中国医学杂质,2003,38(2):89-91.
[4]沈忠明 殷建伟等. 虎杖鞣质的降血糖作用研究[J].天然产物研究与开发, 2004,16(3):220-221.
[5]马庆一,陈丽华,杨海延,等.山茱萸中α-葡萄糖苷酶抑制活性因子的筛选(I)[J].食品科学,2007(1):169-170.
[6]马庆一,陈丽华,杨海延,等.山茱萸中α-葡萄糖苷酶抑制活性因子的筛选(II)[J].食品科学,2007(2):73-77.
[7]陈丽华,潘自红,曹云丽,等.纸色谱法筛选知母中α-葡萄糖苷酶抑制剂[J].当代化工,2013,42(7):889-893.
[8]翟清波,李诚,王静,等.植物多酚降血糖和降血脂作用研究进展[J].中国药房,2012,23(3):278-280.
[9]魏金凤.珍珠菜属植物狭叶落地梅和山高粱保肝、降血糖作用及化学成分研究[D].开封:河南大学,2012.
[10]陈丽华,马庆一,杨冰,等.降糖功能因子天然资源的分布概况[J].现代食品科技,2005,28(3):172-175.
[11]杨少波,张其安,王娟.降血糖天然食品资源及其降血糖机理研究进展[J].食品研究与开发,2012,33(4):211-215.
[12]程素娇,张英,王立,等.天然资源功能因子降血糖研究进展[J].食品工业科技,2012,33(10):387-390.
[13]Frauz G.Polysaccharides in pharmacy:Current application and future concepts[J].Planta Med,1989,55 (6) :493-497.
[14]廖冬冬.林文庭. 植物多糖降血糖作用机制的研究进展[J].海峡预防医学杂志,2012,18(2):26-28.
[15]李平等.山茱萸多糖提取过程研究[J].北京化工大学学报,2003,30(1):13-16.
[16]北京医学院.北京中医学院主编.中草药成分化学[M]. 北京:人民卫生出版社,1980.
[17]裴月湖.天然药物化学实验[M]. 北京:人民卫生出版社,2005.
[18]李英,等. α-葡萄糖苷酶抑制剂的分离纯化及其性质研究[J].天然产物研究与开发,2002,12(4):24-28.
[19]PierreC,Roland R.Tremblay.p-Nitrophenol- α-glucopyramoside as substract for measurement of maltase activity in human semen[J]. The journal of clinical chemcical chemistry,1978, 24:208-211.
Influence on the Activity of α-glucosidase by Water-soluble Polysaccharide Form Five Kinds of Chinese Herbal
CENG Li-hua,CAO Ke-sheng,PEGN Qin-long,PAN Zi-hong,MA Qing-yi
(School of Chemistry and Chemical Engineering,Pingdingshan University, Pingdingshan Henan 476000,China )
The water-soluble polysaccharide was extracted from Cornus officinalis,Rhizoma anemarrhenaes, Licorice, Sanguisorba officinalis and Terminalia chebula ribs. Influence of these water-soluble polysaccharides on the activity of α-glucosidase was investigated by enzyme kinetics reaction. The results show that sanguisorba officinalis polysaccharide has the activation function to α-glucosidase;influence of Rhizoma anemarrhenae polysaccharide on α-glucosidase activity changes with time, activation first and then inhibition; Cornel polysaccharide, Licorice polysaccharide and Terminalia chebula ribs polysaccharide have inhibitory activities against α-glucosidase. Licorice polysaccharide shows the best α-glucosidase inhibitory activity of all, the inhibition rate can reach to 72.5 %.
Cornus officinalis; Rhizoma anemarrhenaes; Licorice; Sanguisorba officinalis ; Terminalia chebula ribs; α-glucosidase; Inhibition rate
TQ 028
: A
: 1671-0460(2015)01-0021-03
2014-07-07
陈丽华(1977-),女,河南信阳人,副教授,硕士研究生,2006年毕业于郑州轻工业学院食品与生物工程专业,研究方向:天然产物化学与食品功能因子。E-mail:249549769qq.com
