局部亚低温治疗对神经外科重症的价值
2015-01-03凌继勇苏亦明
凌继勇 李 龙 苏亦明
神经手术重症患者以颅脑损伤居多,流行病学调查结果显示,重症颅脑损伤的发生率持续升高,已成为影响人类健康的重要困扰[1]。所以,降低重症颅脑损伤患者的致残率和致死率一直是当前急诊和神经科的重点课题。对于重症颅脑损伤的机理研究显示,脑组织损伤后引起的局部和全身性炎症反应以及颅内压力的改变都在颅脑损伤患者的病情中发挥重要作用[2-3]。已有研究证实肿瘤坏死因子和白细胞介素等炎症因子与颅脑损伤密切相关[4]。而亚低温治疗具有保护脑组织的作用已得到了越来越多的认同[5-7],且局部亚低温治疗方法由于并发症较少已逐步取代了全身性亚低温治疗[8]。因此,考察亚低温治疗在神经手术重症患者中的应用效果,并对炎症因子水平的变化进行对比,有助于了解亚低温治疗的效果和作用机理。
1 资料与方法
1.1 一般资料
完全随机法选取2012 年1 月~2014 年1 月间收治手术治疗的重症颅脑损伤患者82 例。所有患者均经颅脑CT 扫描确诊,GCS 评分小于等于8 分,近期无感染或其他严重内科疾病。所有患者均知情同意并得到医院伦理委员会批准。使用随机数字表法将患者分为研究组和对照组,每组41 例。两组患者在年龄、性别等一般资料无统计学差异(p >0.05),具体见表1。
表1 两组患者一般资料比较 (n,±s)

表1 两组患者一般资料比较 (n,±s)
病理类型男性 女性 单纯脑挫裂 单纯膜下血肿 单纯膜外血肿 单纯实质内血肿研究组组别n 性别 年龄(岁)41 32 9 41.0±14.4 18 10 7 6对照组41 31 10 40.6±14.5 17 12 6 6
1.2 方法
1.2.1 常规治疗方法 所有患者均进行生命体征监护,并记录GCS 评分,依据病情进行手术治疗并给予脱水、抗炎和脑保护等对照组治疗。术后给予常规脑室外引流,持续监测ICP。记录出院时和伤后6 个月的GOS 评分。
1.2.2 亚低温治疗方法 治疗组在对照组常规治疗基础上实施局部亚低温治疗。采用由康诺公司提供的KN01 型冰毯机对患者颅部和颈部进行降温,将冰毯贴敷于患者头部并将水温设置为6 ℃,将温度感应器放置于患者病灶侧耳内测量温度。同时给予冬眠合剂辅助降温,4 ~8 h 内将患者颅脑温度降低至35 ℃以下,并维持48 h。采取缓慢升温法进行复温。每6 h 复温1 ℃。
1.2.3 脑脊液TNFα、IL-6 和IL-8 的测定 研究组患者于治疗前,亚低温治疗后1、2 d,复温后1 d 和伤后一个月取脑脊液5 ml,对照组于相对应时间点取脑脊液各5 ml,采用生工公司提供的细胞因子试剂盒测定脑脊液中的各炎症因子水平。
1.3 统计学分析
采用SPSS 20.0 软件分析,对于符合正态性的计量资料采用(±s)表示,组间比较采用重复性资料采用重复测量方差分析,组内采用双因素方差分析,计数资料采用χ2分析,p <0.05 为差异有统计学意义。
2 结果
2.1 两组患者炎症因子水平比较
两组患者TNFα、IL-6 和IL-8 治疗前均无统计学差异(p >0.05),亚低温治疗后均出现统计学差异,具体见表2 ~表4(p <0.01)。
2.2 两组患者预后比较
治疗后两组患者ICP 和GOS 评分均存在统计学差异(p <0.05),具体结果见表5、表6。
表2 两组患者脑脊液TNFα 水平比较 (±s,ng/ml)
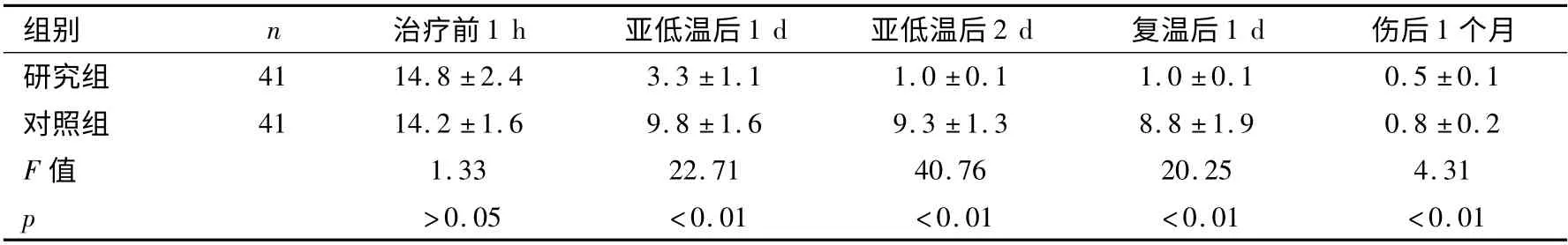
表2 两组患者脑脊液TNFα 水平比较 (±s,ng/ml)
组别 n 治疗前1 h 亚低温后1 d 亚低温后2 d 复温后1 d 伤后1个月研究组41 14.8 ±2.4 3.3 ±1.1 1.0 ±0.1 1.0 ±0.1 0.5 ±0.1对照组 41 14.2 ±1.6 9.8 ±1.6 9.3 ±1.3 8.8 ±1.9 0.8 ±0.2 F 值 1.33 22.71 40.76 20.25 4.31 p >0.05 <0.01 <0.01 <0.01 <0.01
表3 两组患者脑脊液IL-6 水平比较 (±s,pg/ml)

表3 两组患者脑脊液IL-6 水平比较 (±s,pg/ml)
组别 n 治疗前1 h 亚低温后1 d 亚低温后2 d 复温后1 d 伤后1个月研究组 41 84.9 ±62.5 79.3 ±25.2 24.8 ±8.8 19.4 ±5.0 27.4 ±10.8对照组 41 87.4 ±21.8 98.5 ±26.6 81.1 ±21.1 92.7 ±17.3 100.7 ±18.3 F 值 0.24 3.04 10.71 19.84 20.87 p >0.05 <0.01 <0.01 <0.01 <0.01
表4 两组患者脑脊液IL-8 水平比较 (±s,ng/ml)
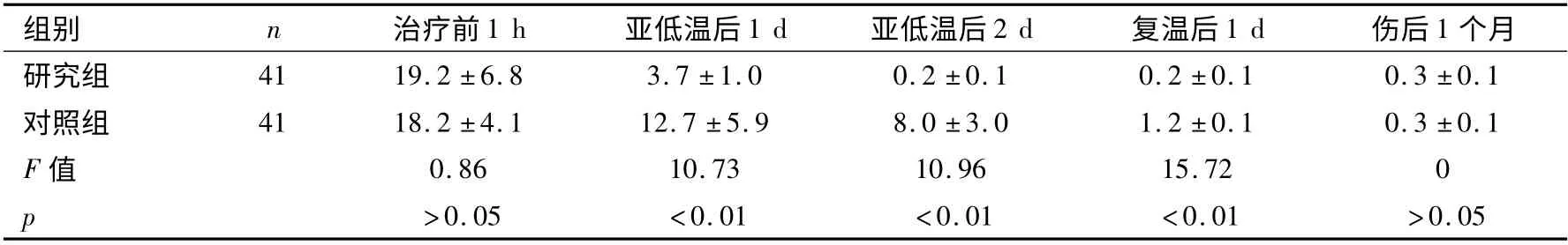
表4 两组患者脑脊液IL-8 水平比较 (±s,ng/ml)
组别 n 治疗前1 h 亚低温后1 d 亚低温后2 d 复温后1 d 伤后1个月研究组41 19.2 ±6.8 3.7 ±1.0 0.2 ±0.1 0.2 ±0.1 0.3 ±0.1对照组 41 18.2 ±4.1 12.7 ±5.9 8.0 ±3.0 1.2 ±0.1 0.3 ±0.1 F 值 0.86 10.73 10.96 15.72 0 p >0.05 <0.01 <0.01 <0.01 >0.05
表5 两组患者间ICP 值比较 (±s,mmHg)

表5 两组患者间ICP 值比较 (±s,mmHg)
组别 n 治疗前1 h 亚低温后1 d 亚低温后2 d 复温后1 d 伤后1个月研究组 41 26.2 ±7.8 19.3 ±7.5 12.3 ±5.0 11.7 ±5.1 11.0 ±2.2对照组 41 25.4 ±8.3 25.4 ±6.5 22.1 ±5.1 22.4 ±6.2 17.9 ±8.3 F 值 0.45 3.94 8.07 8.53 5.15 p >0.05 <0.01 <0.01 <0.01 <0.01

表6 两组患者预后GOS 评分比较
2.3 两组患者不良反应比较
研究组患者并发肺炎2 例,尿路感染2 例,心率失常1例,总不良反应率12.2%(5/41),对照组并发肺炎2 例,尿路感染1 例,总不良反应率7.3%(3/41),两组间无统计学差异(χ2=0.55,p >0.05)。
3 讨论
由于现代交通工具和工业的发展,严重颅脑损伤的发生率也在逐渐增加。颅脑损伤不仅有较高的致死率,其幸存患者大多数也会遗留有不同程度的神经功能缺失。随着神经分子生物学和神经免疫学相关研究的逐步深入,细胞因子在颅脑损伤中发挥的级联放大作用也逐渐为人们所熟知[9]。FAN 等[10]证实大鼠后脑创伤区域的TNF 表达量显著增加并可诱导花生四烯酸产物的释放,导致内皮细胞损伤和脑水肿。ROTHWELL 等[11]对小鼠颅脑创伤模型中的IL -6 水平进行的检测证实其存在高水平的IL -6 表达并介导了颅脑损伤的众多生理反应。LIANG 等[12]证实颅脑损伤的神经内分泌和椎体外系改变与IL-8 的过量表达相关。
亚低温治疗主要机制包括:降低大脑耗氧量,减轻脑组织酸中毒;抑制白三烯LTS 生成,保护血脑屏障,以减轻脑水肿和降低颅内压力;抑制儿茶酚胺、乙酰胆碱和兴奋性氨基酸等有害因子的释放;减少钙离子内流,以阻断钙离子对神经元的损伤;减少脑细胞结构蛋白的损伤和消耗;促进细胞间信号传递恢复。
研究证实,通过在术后进行亚低温治疗可以有效降低神经手术重症患者的炎症水平,其治疗后1 d 的各炎症因子水平均显著低于对照组。已有研究证实脑内的小胶质细胞和星形胶质细胞是颅脑损伤中过量表达的炎症因子的主要来源,通过亚低温治疗有效降低了颅脑内各细胞的生理活性和蛋白表达速率,使得各炎症因子的产生速率显著降低。已有学者证实过量的炎性细胞可以导致颅内压力的升高[13]。而在本研究中,治疗前两组患者的颅内压力均明显高于正常水准,即便经过手术治疗和引流后压力显著降低,但仍未恢复正常水平。而通过亚低温治疗,研究组患者的治疗后各时间点颅内压力均显著低于对照组,则提示通过抑制炎症反应可以有效降低患者的颅内压力。颅内压力与预后之间的联系已为医疗工作者所熟知。本研究同样证实了降低颅内压力对改善预后的帮助。研究证实,研究组患者的GOS 评分显著高于对照组,提示应用亚低温治疗可以通过改善患者炎症水平和颅内压力而最终改善预后。在对两组患者的术后不良反应进行比较中发现,研究组患者的术后不良反应发生率与对照组无统计学差异,提示应用局部亚低温疗法而非全身性亚低温疗法可以有效控制不良反应的发生,降低应用风险。
综上所述,应用亚低温治疗神经手术重症患者安全有效可以有效减轻患者的炎症反应和颅内压力并改善预后,具有临床应用价值。
[1] ROOZENBEEK B,MAAS A I R,MENON D K. Changing patterns in the epidemiology of traumatic brain injury[J]. Nature Reviews Neurology,2013,9(4):231 -236.
[2] CASSIDY J D,CANCELLIERE C,CARROLL L J,et al. Systematic review of self-reported prognosis in adults after mild traumatic brain injury:results of the International Collaboration on Mild Traumatic Brain Injury Prognosis[J]. Archives of physical medicine and rehabilitation,2014,95(3):S132 -S151.
[3] XIONG Y,MAHMOOD A,CHOPP M. Animal models of traumatic brain injury[J]. Nature Reviews Neuroscience,2013,14(2):128 -142.
[4] SCHAIBLE E V,STEINSTR??ER A,JAHN-EIMERMACHER A,et al. Single administration of tripeptide α -MSH (11 -13)attenuates brain damage by reduced inflammation and apoptosis after experimental traumatic brain injury in mice[J]. PloS one,2013,8(8):e71056.
[5] GEORGIOU A P,MANARA A R. Role of therapeutic hypothermia in improving outcome after traumatic brain injury:a systematic review[J]. British journal of anaesthesia,2013,110(3):357 -367.
[6] 管玉华,赵东刚,姜 莱,等. 亚低温治疗急性缺血脑卒中的Meta 分析[J].实用医学杂志,2013,29(9):1518 -1521.
[7] 宋向奇,陈 通,付爱军,等.亚低温治疗对重型颅脑损伤患者疗效及安全性的系统评价[J]. 实用医学杂志,2014,30(7):11136 -1141.
[8] GEURTS M,MACLEOD M R,KOLLMAR R,et al. Therapeutic Hypothermia and the Risk of Infection:A Systematic Review and Meta-Analysis[J]. Critical care medicine,2014,42(2):231-242.
[9] WOODCOCK T,MORGANTI - KOSSMANN M. The role of markers of inflammation in traumatic brain injury[J]. Frontiers in Neurology[J],2013,4:1 -18. DOI:10.3389/fneur.2013.00018
[10] FAN L,YOUNG P R,BARONE F C,et al. Experimental brain injury induces differential expression of tumor necrosis factor - α mRNA in the CNS[J]. Molecular brain research,1996,36(2):287 -291.
[11] ROTHWELL N J,RELTON J K. Involvement of cytokines in acute neurodegeneration in the CNS[J]. Neuroscience&Biobehavioral Reviews,1993,17(2):217 -227.
[12] LIANG X Y,LI H N,YANG X Y,et al. Effect of Danshen aqueous extract on serum hs-CRP,IL-8,IL-10,TNF-α levels,and IL-10 mRNA,TNF - α mRNA expression levels,cerebral TGF-β1 positive expression level and its neuroprotective mechanisms in CIR rats[J]. Molecular biology reports,2013,40(4):3419 -3427.
[13] GRAETZ D,NAGEL A,SCHLENK F,et al. High ICP as trigger of proinflammatory IL -6 cytokine activation in aneurysmal subarachnoid hemorrhage[J]. Neurological research,2010,32(7):728 -735.
