黑曲霉胞外β–葡萄糖苷酶的纯化及酶学性质的研究
2015-01-03黄琳琳别松涛
徐 星,肖 华,黄琳琳,别松涛
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
黑曲霉胞外β–葡萄糖苷酶的纯化及酶学性质的研究
徐 星,肖 华,黄琳琳,别松涛
(工业发酵微生物教育部重点实验室,工业酶国家工程实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
利用硫酸铵盐析、Superdex 200凝胶柱层析等步骤,从黑曲霉发酵液中纯化得到两种β–葡萄糖苷酶蛋白,其相对分子质量分别为1.15×105和7.0×104左右,比活力分别为62.1,U/mg(相对分子质量约为1.15×105)和53.0,U/mg(相对分子质量约为7.0×104),纯化倍数分别为1.54和1.31,回收率分别为19.6%,和19.1%,β–葡萄糖苷酶最适水解pH为4.6,最适反应温度为50~55,℃.在pH 4.2~4.8、温度40~60,℃下均能保持稳定.Mn2+、Mg2+和K+对β–葡萄糖苷酶有不同程度的激活作用,而Ca2+、Fe3+、Zn2+、Cu2+和Fe2+会抑制β–葡萄糖苷酶的酶活,Na+和Ba2+对β–葡萄糖苷酶活力影响不明显.以pNPG为底物时,该酶的Km和vmax分别为2.33,mmol/L与3.14,mmol/(L·min).
β–葡萄糖苷酶;分离纯化;黑曲霉
β–葡萄糖苷酶(β-glucosidase,EC 3.2.1.21),属于水解酶类,又称β–D–葡萄糖苷水解酶、龙胆二糖酶、纤维二糖酶和苦杏仁苷酶,最早被Liebig等[1]于1837年首次在苦杏仁中发现.作为纤维素分解酶系中重要组成之一,它能催化糖基原子团与水解芳香基或烃基之间的糖苷键,释放β–D–葡萄糖与相应的配基,属于纤维素酶类[2].
延龄草苷(Trillin),是中药中的一个有效成分,对大多数植物病原真菌均有广谱高效的抑菌作用,具有作为农用杀菌剂的潜在开发价值[3],可以作为合成具有生物活性的薯蓣类皂苷的前体物质.但是,现在很难采用分离提取的方法从中药材中大量获得延龄草苷,主要利用化学合成的方法进行制备[4].
目前,通过酶法制备延龄草苷的报道并不多见.本研究主要从黑曲霉CICC2475 中分离出β–葡萄糖苷酶,并对该酶的酶学性质进行研究,为该酶催化薯蓣皂苷水解生成延龄草苷提供理论依据.
1 材料与方法
1.1 微生物菌株与培养基
黑曲霉(Aspergillus niger)CICC2475斜面保藏培养基为PDA培养基,于4,℃下保藏.产酶发酵培养基(g/L):麸皮20,(NH4)2SO41.5,KH2PO42.0,MgSO4·7H2O 0.2,CaCl20.01,FeSO40.01,121,℃湿热灭菌20,min.
1.2 培养方法与粗酶液的制备
采用摇瓶发酵法,取活化好的黑曲霉的斜面,用山梨醇溶液洗下孢子,并以107,mL-1接种量接种于50,mL/250,mL发酵培养基中,28,℃、180,r/min,振荡培养4~5,d.发酵液经4层纱布过滤,10,000,r/min离心,上清液即为β–葡萄糖苷酶粗酶液.
1.3 β–葡萄糖苷酶的分离与纯化
向粗酶液中边搅动边缓慢加入一定饱和度的硫酸铵盐析,4,℃条件下静置过夜.10,000,r/min离心10,min,收集蛋白沉淀.上述粗蛋白用0.02,mol/L、pH 4.8的醋酸–醋酸钠缓冲溶液溶解,放入透析袋经透析除盐,用BaCl2检验是否除尽.离心收集上清液,并冷冻干燥成粉末.
将上述浓缩后的粗酶粉溶于醋酸–醋酸钠缓冲液(pH 4.8,0.02,mol/L),过0.22,µm水系膜,制成样品.样品上样至经0.02,mol/L、pH 4.8的醋酸–醋酸钠缓冲液平衡好的Superdex 200层析柱,用平衡缓冲液洗脱,流量为1,mL/min,收集具有β–葡萄糖苷酶活力的组分,脱盐浓缩,于4,℃保存,用于酶学性质的研究.
1.4 测定方法
1.4.1 β–葡萄糖苷酶酶活力的测定
β–葡萄糖苷酶酶活力测定时以对硝基苯基–β–D–葡萄糖苷(pNPG)为底物,测定波长为400,nm.定义每分钟单位体积内催化生成1,µmol对硝基苯酚所需的酶量为一个酶活力单位[5].
1.4.2 蛋白含量的测定
蛋白含量的测定采用Bradford法[6].
1.4.3 酶蛋白纯度及相对分子质量的测定
酶蛋白纯度及相对分子质量的测定采用SDS–聚丙烯酰胺凝胶电泳(SDS-PAGE)法[7],5%,浓缩胶,10%,分离胶.
1.5 酶学性质分析
1.5.1 酶反应最适pH
配制浓度为0.2,mol/L不同pH(4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6)的醋酸–醋酸钠缓冲液,作为β–葡萄糖苷酶酶活测定中的催化反应缓冲溶液,将反应体系置于50,℃下水浴10,min,利用pNPG法测定β–葡萄糖苷酶酶活,确定反应最适pH.
1.5.2 酶反应最适温度
采用pH为4.6的醋酸–醋酸钠缓冲液作为酶活测定的缓冲溶液,分别在40、45、50、55、60,℃条件下测定酶活,根据其酶活力大小确定β–葡萄糖苷酶的最适反应温度.
1.5.3 酶的pH稳定性和热稳定性
将酶液置于不同pH的醋酸–醋酸钠缓冲液中,在4,℃冰箱中保存12,h,然后将各酶液的反应pH调整至4.6,在相同条件下测定各酶液的酶活.
将pH为4.6的酶液分别置于不同温度下保温12,h,在50,℃下利用pNPG法测定各样品酶活.
1.5.4 金属离子对β–葡萄糖苷酶的影响
在反应体系中添加不同的金属离子溶液,使金属离子的终浓度分别达到10,mmol/L和50,mmol/L,50,℃下保温后测定酶活,并以未添加金属离子的反应体系为对照.
1.5.5 酶催化动力学特征常数
测定以pNPG为底物的动力学参数.配制1~10,mmol/L的底物溶液,按1.4.1的方法测定β–葡萄糖苷酶的活性,初速度只测定前10,min内的数据.以时间t(min)为横坐标,产物浓度c(mmol/L)为纵坐标作曲线图,其斜率即为反应速率v(mmol/(L·min)).采用双倒数作图法作图,计算Km和vmax.
2 结果与讨论
2.1 硫酸铵盐析最佳饱和度的确定
取β–葡萄糖苷酶粗酶液各50,mL,取饱和度为25%,~100%,(4,℃)的硫酸铵进行盐析,分别测上清液和沉淀中β–葡萄糖苷酶酶活,并以未经硫酸铵盐析时粗酶液的酶活为对照,其相对酶活为100%,,结果如图1所示.当硫酸铵饱和度为0~35%,(4,℃)时,上清液的酶活与沉淀的酶活无明显变化;当饱和度在35%~80%,(4,℃)时,沉淀的酶活随硫酸铵的饱和度增加而显著增加,同时上清液的酶活则随着硫酸铵饱和度的增加而降低,尤以在65%,~80%,(4,℃)时降低的最为明显;当硫酸铵饱和度达到80%,(4,℃)以上时,上清液和沉淀的酶活均无明显变化,可认为此阶段中沉淀出的蛋白大部分为杂蛋白或变形蛋白.故,可先用饱和度为35%,的硫酸铵盐析出杂蛋白,再用80%,饱和度的硫酸铵将目的蛋白充分沉降.
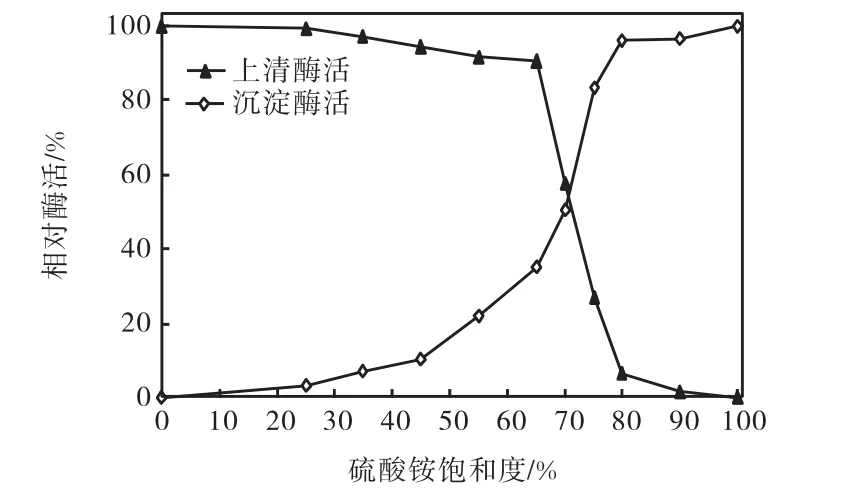
图1 黑曲霉CICC2475 的β-葡萄糖苷酶盐析曲线Fig.1 Salting out curve of β-glucosidase from Aspergillus niger CICC2475
2.2 酶的纯化
粗酶液经过硫酸铵盐析与透析除盐后,上样至Superdex 200凝胶层析柱.用0.02,mol/L、pH为4.8的醋酸–醋酸钠缓冲液平衡,并用平衡缓冲液以1,mL/min的流量洗脱.开始出峰时,洗脱体积为218,mL,从此时开始收集洗脱液,每3,mL收集1管,检测每管的β–葡萄糖苷酶酶活.
洗脱体积为218~230,mL和239~245,mL处的收集液有β–葡萄糖苷酶活性.分别合并218~224,mL、224~230,mL和239~245,mL处的收集液,3个组分经过脱盐浓缩后,进行SDS-PAGE分析,结果如图2所示.图2显示两条蛋白带,相对分子质量约为1.15×105和7.0×104.
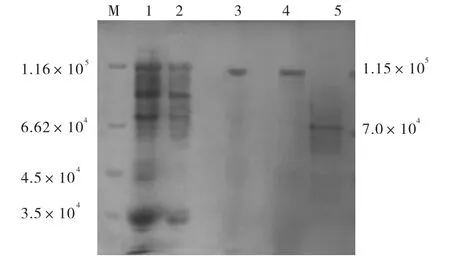
图2 纯化酶SDS-聚丙烯酰胺凝胶电泳Fig.2 SDS-PAGE of purified β-glucosidase
各个分离纯化步骤的数据见表1.黑曲霉CICC2475发酵液经过纯化后,比活力分别达62.1 U/mg(相对分子质量约为1.15×105)和53.0,U/mg(相对分子质量约为7.0×104),纯化倍数分别为1.54和1.31,回收率分别为19.6%,和19.1%,.

表1 黑曲霉CICC2475的β-葡萄糖苷酶的初步纯化Tab.1 Purification of the β-glucosidase from Aspergillus niger CICC2475
2.3 酶学性质
2.3.1 β-葡萄糖苷酶的最适反应pH和pH稳定性
pH对β–葡萄糖苷酶活性及稳定性的影响如图3所示.

图3 pH对β-葡萄糖苷酶活性及稳定性的影响Fig.3 Effect of pH on β-glucosidase activity and stability
该酶最适水解pH为4.6;在pH=4.2~4.8范围内较稳定,当pH>5.6时,酶的稳定性下降.
2.3.2 β–葡萄糖苷酶的最适反应温度和热稳定性
温度对β–葡萄糖苷酶活性及稳定性的影响如图4所示.β–葡萄糖苷酶酶活在40~55,℃随温度升高而增高,并在55,℃下达到最高酶活20.4,U/mL;酶活在50~55,℃下变化平缓,几乎保持不变;而在温度低于50,℃和高于55,℃会呈明显下降趋势.其最适温度为50~55,℃,与已知的大部分β–葡萄糖苷酶的最适温度相符[8].将酶液分别置于不同温度下保温12,h,然后在50,℃下利用pNPG法测定各样品酶活.由图4可知:黑曲霉CICC2475的β–葡萄糖苷酶在所测温度(40~60,℃)下,均具有较好的稳定性,与Mchale等[9]的研究结果相同.

图4 温度对β–葡萄糖苷酶活性及稳定性的影响Fig.4 Effect of temperature on β-glucosidase activity and stability
2.3.3 金属离子对β–葡萄糖苷酶的影响
在反应体系中添加一定浓度的金属离子溶液,使其终浓度分别达到10,mmol/L和50,mmol/L,50,℃水浴1,h后测定各组酶活,以未添加金属离子的反应体系中的酶活性定义为100%,,结果见表2.

表2 金属离子对β–葡萄糖苷酶活性的影响Tab.2 Effects of metallic ions on the activity of β-glucosidase
由表2可知:Mg2+和Mn2+对β–葡萄糖苷酶活力有较强的激活作用,当加入的Mg2+和Mn2+的浓度为50,mmol/L时,β–葡萄糖苷酶酶活分别为对照的129.4%,和135.4%,;K+对酶活力也有一定的激活作用.而Zn2+和Cu2+对β–葡萄糖苷酶活力有很强的抑制作用,当两种离子的浓度为50,mmo/L时,酶活力仅为对照的32.1%,和21.4%,;此外,Fe3+、Ca2+和Fe2+对β–葡萄糖苷酶也有一定的抑制作用;Na+和Ba2+对β–葡萄糖苷酶活力影响不明显.
在陈静等[10]的研究中,Mn2+、Fe2+、Ag+、Zn2+和Co2+对来源于米曲霉giF-10的β–葡萄糖苷酶有不同程度的激活作用,Fe3+、Cu2+对β–葡萄糖苷酶活力有抑制作用.谢宇等[11]报道来源于曲霉No.5.1的β–葡萄糖苷酶,K+、Na+、Mg2+和Zn2+对其有激活作用,而Ag+和Fe2+对其具有明显的抑制作用.来自黑曲霉NL-1的β–葡萄糖苷酶,Ag+对该酶具有强的抑制作用,其他金属离子对酶活力影响不大[12].刘德海等[13]对伞枝犁头霉菌D8所产β–葡萄糖苷酶的研究结果显示,K+、Mg2+、Ca2+和Fe2+对该酶具有一定的激活作用,而Cu2+则对β–葡萄糖苷酶活力有一定的抑制作用.
2.3.4 酶催化动力学特征常数
根据1.5.5的方法,测得不同浓度的pNPG溶液在2、4、6、8、10,min下产物对硝基苯酚pNP的浓度.以反应时间t为横坐标,以产物浓度为纵坐标作图,得到以10、5、2、1,mmol/L pNPG为底物的反应速率,分别记为v10、v5、v2和v1.以底物浓度的倒数为x轴坐标,反应速率的倒数为y轴坐标,采用Lineweaver-Burk作图法作图,结果见图5.由图5得到的公式计算出x轴与y轴上截距分别为-0.455和0.276,即1/Km与1/vmax的值分别是0.455与0.276.所以,以pNPG为底物的黑曲霉CICC2745分泌的β–葡萄糖苷酶的米氏常数Km为2.33,mmol/L,最大反应速率vmax为3.14,mmol/(L·min).

图5 以pNPG为底物的β–葡萄糖苷酶Lineweaver-Burk图Fig.5 Lineweaver-Burk chart of β-glucosidase using pNPG as the substrate
3 结 论
利用硫酸铵盐析法和凝胶柱层析法,从黑曲霉CICC2475发酵液中分离纯化得到两个β–葡萄糖苷酶蛋白,其相对分子质量分别为1.15×105和7.0× 104左右.该酶最适水解pH为4.6;最适反应温度为50~55,℃.在pH=4.2~4.8、温度40~60,℃下均能保持稳定.Mn2+、Mg2+和K+对β–葡萄糖苷酶有不同程度的激活作用,而Ca2+、Fe3+、Zn2+、Cu2+和Fe2+抑制β–葡萄糖苷酶的酶活,Na+和Ba2+对β–葡萄糖苷酶活力影响不明显.以pNPG为底物时,该酶的Km和vmax分别为2.33,mmol/L与3.14,mmol/(L·min).经分离纯化后的β–葡萄糖苷酶,可用于水解薯蓣皂苷生成延龄草苷,为酶法制备延龄草苷提供新的方法.
参考文献:
[1] Liebig J,Wohler F.The composition of bitter almonds[J].Annalen,1837,22(1):1-24.
[2] 王华夫,游小清.茶叶中β–葡萄糖苷酶活性的测定[J].中国茶叶,1996(3):16–17.
[3] 何明华,刘坚.延龄草苷的制备[J].化工时刊,2012,26(2):25-26.
[4] 江洪,谭汝成,刘汉兰,等.盾叶薯蓣根抽提物中甾体皂甙成分对植物病原真菌的抑菌活性[J].华南农业大学学报:自然科学版,2002,23(3):93.
[5] Hu J N,Zhu X M,Lee K T,et al.Optimization of ginsenosides hydrolyzing beta-glucosidase production from Aspergillus niger using response surface methodology[J].Biological & Pharmaceutical Bulletin,2008,31(10):1870–1874.
[6] Bardford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1/2):248–254.
[7] 汪家政.蛋白质技术手册[M].北京:科学技术出版社,2002:77–110.
[8] Le Traon-Masson Marie-Paule,Pellerin P.Purification and characterization of two β-D-glucosidases from an Aspergillus niger enzyme preparation:Affinity and specificity toward glucosylated compounds characteristic of the processing of fruits [J].Enzyme and Microbial Technology,1998,22(5):374-382.
[9] Mchale A,Coughlan M P.Properties of the βglucosidases of Talaromyces emersonii[J].Microbiology,1982,128(8):2327–2331.
[10] 陈静,郝伟伟,王春梅,等.产β–葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析[J].食品科学,2013,34(5):191–196.
[11] 谢宇,尚晓娴,胡金刚.β–葡萄糖苷酶纯化及酶学性质研究[J].江西农业大学学报,2008,30(3):521-524.
[12] 赵林果,游丽金,孟鹏,等.黑曲霉胞外耐高糖β–葡萄糖苷酶的分离纯化及部分特性研究[J].林产化学与工业,2007,27(6):41–46.
[13] 刘德海,郝益民,岳丹丹,等.一株产β–葡萄糖苷酶菌株的筛选及酶学性质研究[J].中国酿造,2013,32(6):47–51.
责任编辑:周建军
Purification of β-glucosidase from Aspergillus niger and its Enzymological Character
XU Xing,XIAO Hua,HUANG Linlin,BIE Songtao
(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,National Engineering Laboratory for Industrial Enzymes,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
Two kinds of beta-glucosidase protein were separated and purified from Aspergillus niger through ammonium sulfate precipitation and Superdex 200,gel filtration chromatography.The enzyme molecular weights were about 1.15×105and 7.0×104,which were identified by SDS-PAGE.The specific activifies were 62.1 U/mg and 53.0 U/mg.And then they were purified to 1.54-fold and 1.31-fold with a recovery of 19.6%, and 19.1%,.The optimum reaction pH and temperature for beta-glucosidase were 4.6,and 50-55,℃.The enzyme is stable in the pH value range of 4.2-4.8 and at the temperature between 40,℃ to 60,℃.Mn2+,Mg2+and K+have different degree of activation to the beta-glucosidase,while Ca2+,Fe3+,Zn2+,Cu2+and Fe2+can inhibit the activity of the beta-glucosidase.Na+and Ba2+have no obvious effect on the activity.The Kmand vmaxvalues of the enzyme are 2.33 mmol/L and 3.14 mmol/(L·min) respectively.
beta-glucosidase;purification;Aspergillus niger
Q814.1
A
1672-6510(2015)05-0015-05
10.13364/j.issn.1672-6510.20140081
2014–05–21;
2014–12–28
徐 星(1987—),女,河南郑州人,硕士研究生;通信作者:别松涛,副教授,biesongtao@tust.edu.cu.
