四种核酸染料对用LAMP方法检测猪繁殖与呼吸综合征病毒的影响
2015-01-03,,
,,
(中国检验检疫科学研究院 动物检疫研究所,北京 100029)
四种核酸染料对用LAMP方法检测猪繁殖与呼吸综合征病毒的影响
袁向芬,吴绍强,林祥梅
(中国检验检疫科学研究院 动物检疫研究所,北京 100029)
本研究旨在建立一种基于颜色变化的北美洲型猪繁殖与呼吸障碍综合征病毒(PRRSV)RT-LAMP检测方法及结果判定方法,方便LAMP技术的现场检测应用。根据GenBank中美洲型PRRSV的保守序列设计一套LAMP引物,对反应进行优化后建立了PRRSV LAMP检测方法。对比Dye63、钙黄绿素(Calcein)、SYBR Green I和Picogreen 4种核酸染料对于LAMP反应的适用性。结果显示,只有Calcein、Dye63适于LAMP反应前加入,但对扩增效率均产生一定抑制,造成反应时间延迟:Calcein的延迟作用更强(约10min),Dye63延迟作用较小(约5min)。加入Dye63的LAMP反应灵敏度为2×101拷贝,而加入Calcein的灵敏度要低10倍。经多功能酶标仪对荧光强度的检测,含Dye63的反应阴阳性差异明显,可用于LAMP反应结果的判定。据此建立的基于新型核酸染料Dye63的PRRSV RT-LAMP检测方法操作简单、方便、直观,可大大减少环境污染造成的假阳性。Dye63有望成为继Calcein之后,可用于LAMP反应前加入,反应后闭管判定的一种新核酸染料,方便LAMP检测技术现场应用。
PRRSV;环介导等温扩增;检测方法;核酸染料;比较;结果判定
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种传染病[1,2],病毒分为欧洲型和北美型两种基因型,上世纪90年代以后,PRRSV就已经在世界上所有养猪国家广泛流行[3,4],我国目前出现的疫情主要为北美型PRRSV感染,严重危害养猪业的发展。因此,加强对该疫病的检验检疫,建立快速、高效、简便的检测方法是临床检疫的迫切需要。
随着分子生物学的发展和传统核酸扩增技术的不断改进,2000年,日本荣研化学株式会社的研究人员Notomi研发了一种新的核酸扩增技术,即环介导等温扩增(loop-mediated isothermal amplifi -cation,LAMP)[5]。该技术依赖于能够识别靶序列上6个特异性区域的引物和一种具有链置换特性的DNA聚合酶,在等温条件下可高效、快速、高特异地扩增靶序列,近年来已有较多文献报道了该技术成功应用于多种病原体的检测。
LAMP扩增反应结果判定目前主要有三种方法:浊度检测、凝胶电泳检测或核酸染料检测。然而,由于LAMP扩增效率较高,电泳、酶切等开盖操作极易引起实验环境的污染,一般建议采用闭管操作,而沉淀法在无仪器辅助时仅凭肉眼判定易发生误判的情况,染料法则由于易辨别、方便快捷、灵敏度高等优点得到口岸、临床动物疫病快速诊断的青睐。
本研究通过对Dye63、SYBR Green I、Picogreen、Calcein 4种染料在LAMP结果判定中的使用情况进行分析,期望筛选并建立一种快速便捷的PRRSV RT-LAMP方法及其染料判定方法。
1 材料与方法
1.1 主要试剂与仪器核酸染料Dye63(10,000×)为本实验室研制;SYBR Green I(10,000×)、Picogreen(10,000×)均购自Invitrogen公司;Calcein、LAMP扩增反应试剂盒及RT-LAMP扩增反应试剂盒均为日本荣研化学株式会社研制产品。
实时浊度仪Loopamp LA-320c;多功能酶标仪EnVision等。
1.2 阳性质粒及病毒材料包含PRRSV一段保守序列的阳性质粒TPRRS376为本实验制备保存;PRRSV活疫苗株(CH-1R株)、CSFV兔化弱毒疫苗株(HCLV株)均由中国兽医药品监察所保存并提供;猪伪狂犬病病毒(PrV)、猪圆环病毒2型(PCV2)、猪传染性胃肠炎病毒(TGEV-H弱毒株)、猪流行性腹泻病毒(PEDV-CV777弱毒株)、猪轮状病毒(PRV-NX株)均为本实验室保存的灭活毒株。
1.3 方法
1.3.1 PRRSV LAMP检测方法的建立。根据GenBank中PRRSV的保守序列设计一套引物(表1),并对反应温度、引物浓度等条件进行优化,建立PRRSV的LAMP检测方法。
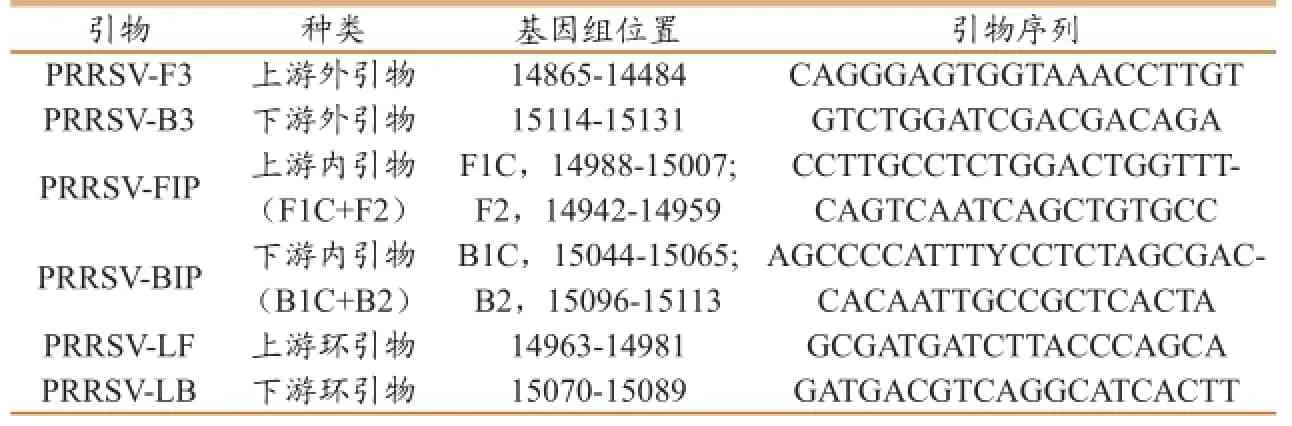
表1 PRRSV LAMP检测的引物
1.3.2 染料筛选及使用浓度确定。Calcein、Dye63、SYBR Green、Picogreen 4种核酸染料中,只有钙黄绿素(Calcein)是已商品化,可于LAMP反应前加入的染料,其使用量参照说明书。此外,经过一系列前期试验发现,将Dye63和SYBR Green I终浓度控制在4×左右,Picogreen终浓度控制在40×左右时,阴阳性可表现出较为明显的颜色差异。在此基础上进行进一步研究。
以不使用环引物的PRRSV LAMP反应为基础,以实验室制备保存的阳性质粒为模板,按表2所示将不同量的染料分别加入反应液中,于实时浊度仪LA-320c中进行反应,并观察浊度变化,反应完成后于紫外光照射下观察反应液颜色变化。最后综合染料的抑制作用大小和颜色变化程度确定染料最佳使用量。

表 2 染料最佳使用量的确定
1.3.3 染料对LAMP反应灵敏度的影响。将阳性质粒模板进行10倍系列稀释(1×106、1×105、1×104、1×103、1×102、1×101、1×100拷 贝 / μL)后备用。按照筛选出来的染料最佳使用量加入反应体系中进行灵敏度试验。与不加染料的正常反应进行比较,观察染料的加入对LAMP反应灵敏度的影响。
1.3.4 基于染料的PRRSV RT-LAMP检测方法的建立。在PRRSV LAMP反应体系基础上,加入反转录步骤,结合最佳染料及其使用量,最终建立基于染料的一步法PRRSV RT-LAMP快速检测法及其判定方法。
1.3.5 PRRSV RT-LAMP检测方法敏感性及特异性试验。按照Trizol法提取PRRSV疫苗毒RNA并对其进行10倍系列稀释,同样方法分别提取CSFV、TGEV、PEDV、PRV的RNA,置-80℃保存备用。PrV、PCV2 DNA的提取采用Qiagen公司的DNeasy Blood & Tissue Kit试剂盒进行。依照优化后的反应条件,分别对系列稀释的PRRSV RNA及各病毒RNA进行RT-LAMP扩增。扩增完成后,将反应液置365nm紫外光下,观察各管的颜色变化,以确定反应的敏感性及特异性。同时,作为对比,用PRRSV荧光RT-PCR试剂盒对系列稀释后的RNA样品进行检测。
2 结果
2.1 PRRSV LAMP检测方法的建立
以LAMP DNA扩增试剂盒为基础,经过对温度、引物浓度等条件进行优化后,建立了PRRSV的LAMP检测方法,并确定其反应体系(25μL)中包含:PRRSV-FIP和PRRSV-BIP各50pmol,PRRSV- F3和 PRRSV-P3各 5pmol,PRRSV-FLP和PRRSV-BLP各20pmol,核酸DNA 2μL。反应程序确定为:63℃恒温扩增60min;80℃酶灭活5min。
2.2 染料筛选及最佳使用量的确定
反应前加入不同量的4种染料,反应后观察实时浊度曲线及颜色变化。研究表明,荧光染料加入量越大,溶液颜色越明显,阴阳性反应的颜色差异也越大,但相对于反应的抑制作用也越明显。试验发现,4种染料中,Dye63对反应的抑制作用最小,当染料终浓度为2×时,扩增时间与正常LAMP反应相比仅延后5min左右,对浊度曲线基本无影响且反应后365nm光线下肉眼观察可区分阴阳性;当染料浓度增加至4×、6×时,反应时间进一步延后,浊度曲线也不似正常LAMP反应平滑,最高浊度值降至0.4~0.6之间(图1-A)。加入染料Calcein的反应,反应时间与正常LAMP反应相比延后10min左右,其他方面无明显影响且反应完成后在紫外线照射下肉眼观察阴阳性差异明显(图1-B)。而Picogreen和SYBR Green对反应的抑制作用最大,完全抑制了反应的进行,无扩增。以上结果表明,Dye63与商品化的Calcein相比对LAMP反应的抑制作用更小,可作为一种新的LAMP结果判定染料进行进一步研究。
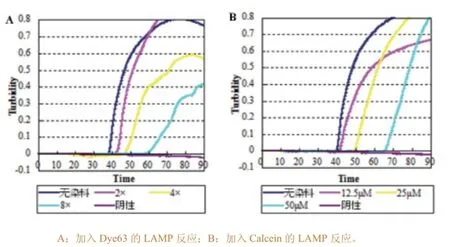
图1染料的筛选及使用量的确定
2.3 核酸染料对PRRSV LAMP反应灵敏度的影响
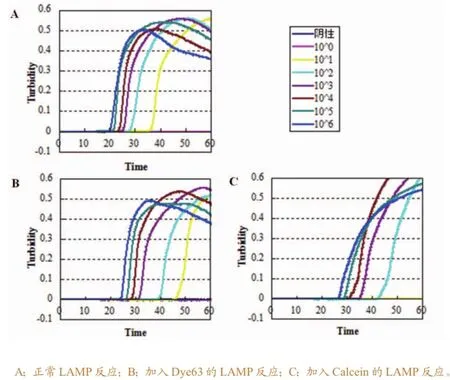
图 2 染料对LAMP反应灵敏度的影响
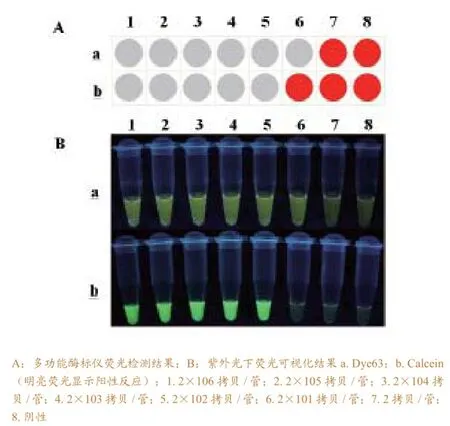
图3 应用不同染料时LAMP反应的灵敏度比较
将10倍系列稀释的阳性模板分别加入含2× Dye63和25μM Calcein的反应液中进行反应,对比两种染料的加入对反应灵敏度的影响。结果如图2所示,两种染料均使反应时间较正常反应延长,其中,加入Dye63的LAMP反应浊度曲线更为平滑,与正常反应相比灵敏度相同,均为2×101拷贝,而加入Calcein的LAMP反应灵敏度下降10倍,为2×102拷贝。反应完成后,通过多功能酶标仪对反应管荧光强度进行检测,结果显示,阳性孔荧光强度明显高于阴性孔(图3-A)。在365nm紫外光照射下,由5位实验员通过肉眼观察反应管颜色(图3-B),均可进行快速判定,两种染料均可呈现足够的荧光色差供肉眼辨别,阳性反应颜色呈草绿色荧光,阴性反应呈橘红色。另外,试验结果显示,加入Calcein的LAMP反应最高浊度值由原来的0.5左右上升至0.7左右(图2),推测其原因可能是体系中加入Calcein后,导致沉淀更易沉降,因而导致反应管内部浊度累积增加所致。
2.4 基于染料的PRRSV RT-LAMP检测方法的建立
最终确定RT-LAMP反应体系(25μL) 为:PRRSV-FIP和PRRSVBIP各50pmol、PRRSV- F3和PRRSVP3各 5pmol、PRRSV-FLP和 PRRSVBLP各 20pmol、2×Reaction Mix 12.5μL(Tris-HCl(pH 8.8)20 mM、KCl 10mM、MgSO48mM、(NH4)2SO4 10mM、Tween 20 0.1%、betaine 0.8 M、dNTPs 5.6mM、酶Mix 1.0μL、核酸RNA 2μL、核酸染料Dye63 2×。反应程序为:63℃恒温水浴锅中扩增60min;80℃酶灭活5min。反应完成后闭管判定颜色变化结果(图3)。
2.5 PRRSV RT-LAMP检测方法的敏感性及特异性
灵敏度试验显示,所建立的RT-LAMP方法与荧光RT-PCR检测方法相比较,拥有相同灵敏度,均可检测到稀释至10-4的RNA;特异性试验显示,未与其它病毒发生交叉反应(图4)。可见,本方法具有良好的灵敏度与特异性。
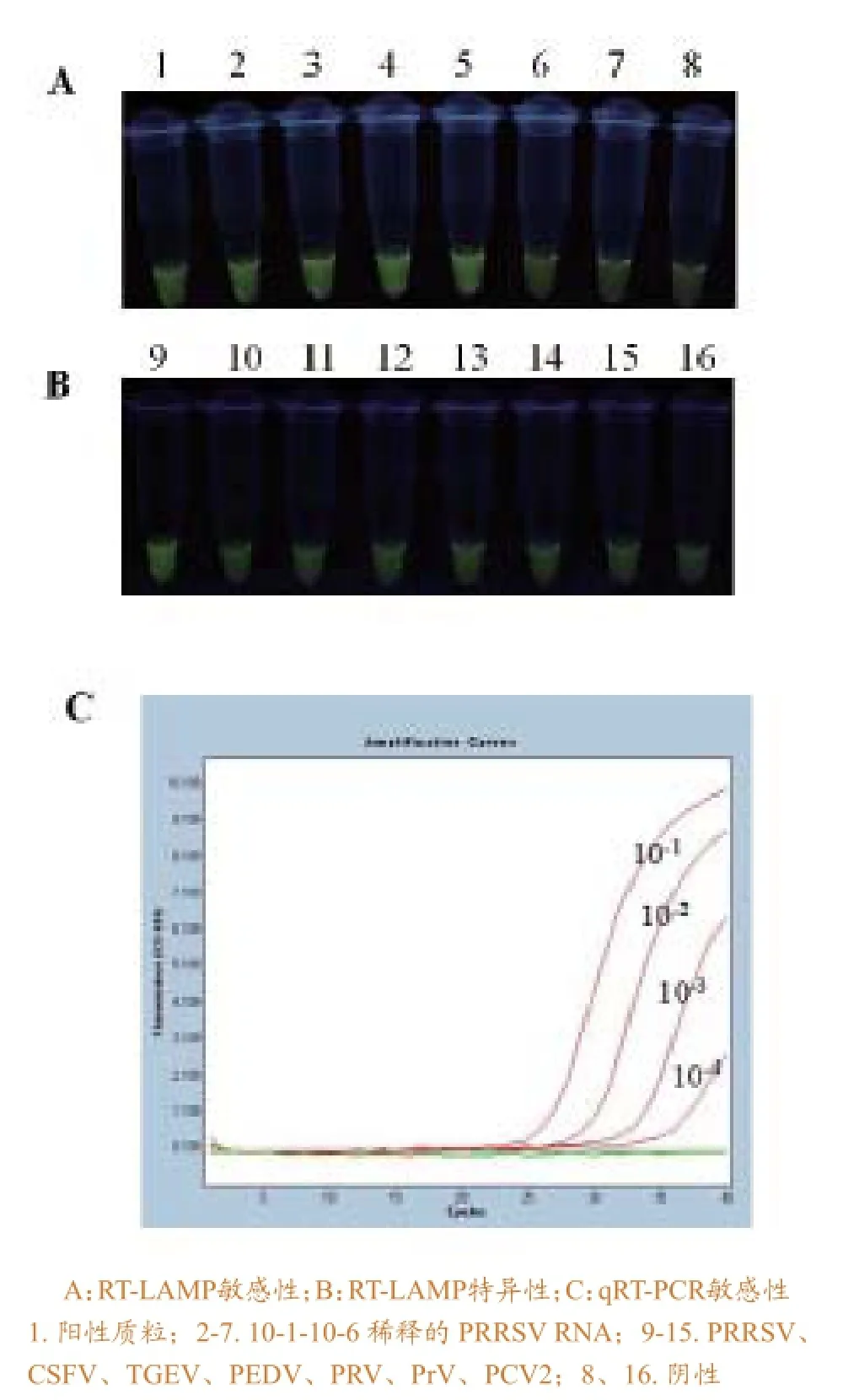
图4 PRRSV RT-LAMP敏感性及特异性分析
3 讨论
本文通过对4种核酸染料的对比研究,筛选到一种可用于LAMP反应前加入,而对LAMP结果判定没有显著影响的新染料Dye63,并在此基础上建立了检测PRRSV用的一步法RT-LAMP检测方法,该方法具有良好的敏感性与特异性,且实验操作、反应条件及判定方法均便捷快速,为LAMP检测方法现场应用提供新的技术储备。
环介导等温扩增技术的优点在于:反应过程不用反复升温降温,在田间、口岸或一些设备不足的地方,利用简单的恒温设备即可进行;反应效率极高,单个目的基因可迅速扩增至109拷贝数;反应时间快速,检测时间最低可降至30min左右。另外,其结果判定方法也较为快捷,常用的有琼脂糖凝胶电泳法、浊度法和染料法三种,其中,染料法在便捷性、准确性、灵敏性等方面表现较优,获得广泛的关注及应用。2008年Tomita筛选到一种镁离子指示剂-钙黄绿素,可于反应前加入试剂中,反应结束后直接根据颜色即可判别阴阳性。该方法的原理是先以锰离子抑制钙黄绿素的荧光,随着阳性反应的进行,产生大量的焦磷酸根,与钙黄绿素竞争锰离子形成白色沉淀,钙黄绿素失去锰离子的抑制作用后,便会接受镁离子并在紫外光激发下发出荧光,溶液则由原本的橘红色转为苹果绿色[21]。
本研究通过对比Calcein和Dye63、SYBR Green、Picogreen 4种染料的使用效果,筛选出一种新的,反应前即可加入试剂中的核酸染料Dye63,该染料的分子结构目前还处于技术保密中,因此它的作用原理还有待进一步了解。但通过一系列的试验发现,Dye63在终浓度为2×时使用效果较佳,既可使阴阳性反应产生颜色变化,又不会对反应时间、灵敏度造成显著影响,有望成为继Calcein以后可在LAMP反应前加入,反应后进行结果判定的一种新的染料。而SYBR Green和Picogreen由于抑制作用较大而仅适于反应后加入。基于染料法的LAMP技术仍有三点需要注意:首先,反应时间与正常LAMP反应相比会出现延迟现象,且反应的浊度曲线可能不似正常LAMP反应平滑,可能与加入染料影响了模板与各反应组分的相互作用有关;其次,当反应中不包含环引物时,染料的抑制作用更为显著,而包含环引物的反应则显示较低的抑制作用,可能是由于加入环引物大大提高了反应效率,从而缓解了染料的抑制作用;另外,高扩增率带来的污染问题应值得注意,由于灵敏度高,一旦开盖容易形成气溶胶污染,加上目前假阳性问题较严重,因此最好不要将反应后的管子打开。
LAMP技术自2000年面世以来,经历了十多年发展历程,已经日趋完善,该技术的主要发展方向趋于病毒、细菌、寄生虫等病原微生物或疫病的现场快速筛查应用。虽然LAMP技术发展至今仍有一些缺点,但纵观其发展历程已有了很大进步:反应模板从DNA扩展到RNA[22,23],反应速度在环引物的添加下大幅度提高,反应从单重扩展到双重[24],产物的检测更是由单纯的观察沉淀演变到加入染料[20,21],目前,用于LAMP反应前加入的核酸染料主要为Calcein,本研究结果将使得染料的选择更加多样化。本方法的建立使得基于LAMP技术的检疫工作更加快速、便捷。相信在不久的将来,LAMP技术通过不断的完善与发展,会逐渐成为更适合于临床和基层应用的一种技术,而且也会逐渐成为核酸研究的一种重要手段。
[1] Allende R,Laegreid W W,Kutish G F,et al. Porcine reproductive and respiratory syndrome virus:description of persistence in individual pigs upon experimental infection[J]. J Virol,2000,74(22):10834-10837.
[2] Israrul H A,Byungjoon K,Fernando A O,et al. Influence of N-linked glycosylation of porcine reproductive and respiratory syndrome virus GP5 on virus infectivity,antigenicity,and ability to induce neutralizing antibodies[J]. J Virol,2006,80(8):3994-4004.
[3] Mardassi H,Mounir S,Dea S. Identification of major differences in the nucleocapsid protein genes of a Québec strain and European strains of porcine reproductive and respiratory syndrome virus[J]. J gen Virol,1994,75:681-685.
[4] Meng X J,Paul P S,Halburl P G. Molecular cloning and nucleotide sequencing of the 3′-terminal genomic RNA of the porcine reproductive and respiratory syndrome virus[J]. J gen Virol,1994,75:1795-1801.
[5] Notomi T,Okayama H,Masubuchi H,et al. Loopmediated isothermal amplification of DNA [J]. Nucleic Acids Res,2000,28:E63.
[6] Tomita N,Mori Y,Kanda H,et al. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nature Protocols,2008,3:877-882.
[7] Zhang J,Zhu J,Ren H,et al. Rapid visual detection of highly pathogenic Streptococcus suis serotype 2 isolates by use of loop-mediated isothermal amplifi cation[J]. Clin Microbiol,2013,51(10):3250-3256.
[8] Shirato K,Yano T,Senba S,et al. Detection of Middle East respiratory syndrome coronavirus using reverse transcription loop-mediated isothermal amplification(RTLAMP)[J]. Virol J,2014,11:139. http://www.virologyj. com/content/11/1/139.
[9] Iseki H,Alhassan A,Ohta N,et al. Development of a multiplex loop-mediated isothermal amplifi cation(mLAMP)method for the simultaneous detection of bovine Babesia parasites[J]. J Microbiol Methods,2007,71:281-287.
[10] Goto M,Honda E,Ogura A,et al. Colorimetric detection of loop-mediated isothermal amplifi cation reaction by using hydroxynaphthol blue[J]. BioTechniques,2009,46:167-172.
Effects of Four Nucleic Acid Dyes on Loop-Mediated Isothermal Amplifi cation Assay for Detection of Porcine Reproductive and Respiratory Syndrome Virus
Yuan Xiangfen,Wu Shaoqiang,Lin Xiangmei
(Chinese Academy of Inspection and Quarantine,Beijing 100029,China)
The objective of the study is to establish a loop-mediated isothermal amplifi cation assay(LAMP)for rapid detection of PRRSV and its result determination method based on nucleic acid dye in order to make the LAMP assay more convenient and fast in fi eld application. According to the sequences published in GenBank,a set of primers were designed targeting the conserved region of PRRSV. Through optimizing the LAMP primers and reaction conditions,a LAMP assay for detection of PRRSV was established. Four nucleic acid dyes were compared for their applicability to LAMP. The result showed only Calcein and Dye63 in the four dyes could be used before the LAMP reaction but with certain inhibition to the amplifi cation effi ciency,resulting in 10 minutes reaction delay with Calcein and 5 minutes reaction delay with Dye63. In addition,the detection limit of the LAMP with Dye63 was ten times higher than with Calcein. After the reaction,the fl uorescence intensity was detected by the Microplate Reader and observed with naked eye. The results showed that the negative and positive reaction presented enough differences and Dye63 was suitable for LAMP result determination. RT-LAMP was developed based on Dye63 for detection of PRRSV with simplicity,convenience,sensitivity and direct vision. And Dye63 was expected to be a new dye used in LAMP after Calcein.
PRRSV;loop-mediated isothermal amplifi cation(LAMP);detection;nucleic acid dye;comparison;determination
S852.651
:A
:1005-944X(2015)02-0072-06
质检公益性行业专项(201210018);国家科技支撑计划课题(2013BAD12B00)
林祥梅
