α-硫辛酸联合依帕司他治疗2型糖尿病周围神经病变临床疗效评价
2015-01-03颜斌
颜 斌
(南华大学附属第一医院内分泌科湖南衡阳,421001)
α-硫辛酸联合依帕司他治疗2型糖尿病周围神经病变临床疗效评价
颜 斌
(南华大学附属第一医院内分泌科湖南衡阳,421001)
目的 评价α-硫辛酸联合依帕司他治疗2型糖尿病周围神经病变的临床疗效。 方法 72例2型糖尿病周围神经病变患者,随机分为三组,各24例,α-硫辛酸组使用α-硫辛酸600mg(静滴,1次/天),依帕司他组使用依帕司他50mg(口服,3次/天),联合用药组联合使用α-硫辛酸600mg(静滴,1次/天)及依帕司他50mg(口服,3次/天),疗程3周。治疗前后对各组患者进行多伦多临床评分系统(TCSS)、总症状评分系统(TSS)评分及神经传导速度(NCV)检测。 结果 治疗3周后三组TCSS、TSS评分较治疗前均降低(P<0.05),联合用药组较单用药组评分降低更明显,组间差异有统计学意义(P<0.05),联合用药组NCV较单用药组明显改善,差异有显著性(P<0.05)。 结论 α-硫辛酸联合依帕司他治疗糖尿病周围神经病变较单用依帕司他和α-硫辛酸治疗疗效更为显著。
糖尿病; 神经病变; α-硫辛酸; 依帕司他
糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)是因慢性高血糖状态及其所致各种病理生理改变而导致的神经系统损伤,可累及全身神经系统任何部分,是糖尿病最常见和最复杂的并发症,60%~90%的糖尿病患者会出现严重程度不等的周围神经病变[1],是导致糖尿病患者足溃疡、截肢、死亡的主要原因。临床上以远端对称性多发性神经病变为主要类型,表现为感觉减退、肢体麻木、疼痛、运动障碍等症状。其发病机制复杂,与氧化应激、代谢紊乱、微循环异常、神经营养因子缺乏等多种因素有关。依帕司他是一种可逆性醛糖还原酶抑制剂,可以降低神经胶质细胞内山梨醇和果糖的水平,改善神经病变。α-硫辛酸是一种抗氧化剂,具有清除氧自由基、减少自由基对神经损伤,再生其他抗氧化的物质,促进神经元生长,从而改善神经细胞功能[2];这两种药物在临床上均有使用,多以单用为主,两种药物联合使用少有报道,为评价两药联用较单用药的疗效,本研究采用多伦多临床评分系统(Toronto clinical scoring system,TCSS)、总症状评分系统(The total symptom score,TSS)评分及神经传导速度(Nerve conduction velocity,NCV)检测来评价α-硫辛酸和依帕司他联用对糖尿病周围神经病变的临床疗效。
1 资料与方法
1.1 一般资料
回顾性分析2012年1月~2014年1月我院收治的2型糖尿病周围神经病变患者72例,其中男性43例,女性29例,平均年龄54.8±9.3岁,2型糖尿病病史11.7±2.3年。入选病例分为三组:α-硫辛酸组,依帕司他组,联合用药组,各组均为24例;三组患者在年龄、性别、糖尿病病程、HbA1c%、体重等方面差异无统计学意义(P>0.05),具有可比性。入选患者均符合2010年中国2型糖尿病防治指南糖尿病周围神经病变诊断标准[3]。排除标准:①Ⅰ型糖尿病或其他特殊类型糖尿病,②其他原因引起的神经病变,如颈腰椎病变、脑梗、格林-巴利综合征、严重动静脉血管性疾病等。③对α-硫辛酸和依帕司他过敏及有禁忌症的患者。本研究资料得到病人及家属同意。
1.2 治疗方法
三组患者均予以糖尿病教育、糖尿病饮食、口服药物或胰岛素控制血糖达标等常规治疗,在上述治疗基础上,α-硫辛酸组仅予以α-硫辛酸600 mg加入生理盐水250 mL静滴,每日一次;依帕司他组仅予依帕司他50 mg口服,每日三次;联合用药组使用α-硫辛酸600 mg加入生理盐水250 mL静滴,每日一次,及依帕司他50 mg口服,每日三次。疗程均为3周。痛性神经病变患者不得服用止痛药。治疗前后均进行TCSS、TSS评分及NCV检测。
1.3 疗效观察指标
TCSS评分:三组患者治疗前后根据神经症状(麻木、疼痛、针刺感、乏力、走路不稳、上肢出现同样症状)、神经反射(踝反射、膝反射)、感觉功能检查(痛觉、温度觉、触压觉、振动觉、位置觉)评分,TSS评分:对下肢疼痛、麻木、烧灼感、感觉减退的强度和频度评分,神经肌电图检查(正中神经、腓总神经感觉及运动神经传导速度)。治疗效果评定:TCSS、TSS治疗前后差值(治疗后评分-治疗前评分),变化率(差值绝对值/治疗前评分×100%),神经传导速度的变化[4-6]。
1.4 统计学方法
采用SPSS13.0统计学软件进行统计学处理。计量以均数±标准差表示,采用t检验,组间治疗有效率比较采用χ2检验,P<0.05差异有统计学意义。
2 结 果
2.1 治疗前后三组TCSS、TSS评分的比较
治疗3周后,三组的TCSS、TSS评分均较治疗前有降低,联合用药组TCSS、TSS评分降低较α-硫辛酸组、依帕司他组更显著,评分差值绝对值及变化率在联合用药组与α-硫辛酸组、依帕司他组间比较差异有显著性,P<0.05;α-硫辛酸组与依帕司他组组间比较差异无统计学意义,P>0.05(表1)。
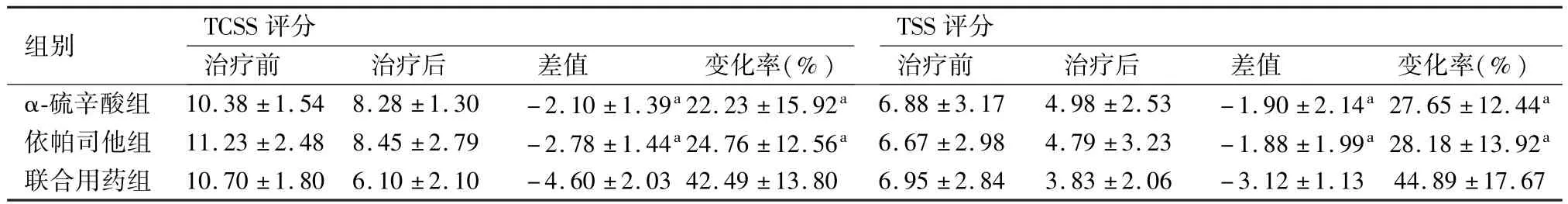
表1 三组TCSS、TSS评分及差值、变化率的比较
2.2 治疗前后神经传导速度比较
神经肌电图检测,三组治疗后正中神经及腓总神经感觉神经传导速度及运动神经传导速度较治疗前均提高,治疗后较治疗前比较差异有统计学意义(P<0.05);且联合用药组神经传导速度增加明显优于α-硫辛酸组、依帕司他组,差异有统计学意义(P<0.05),α-硫辛酸组和依帕司他组间差异无显 著性(P>0.05)(表2)。
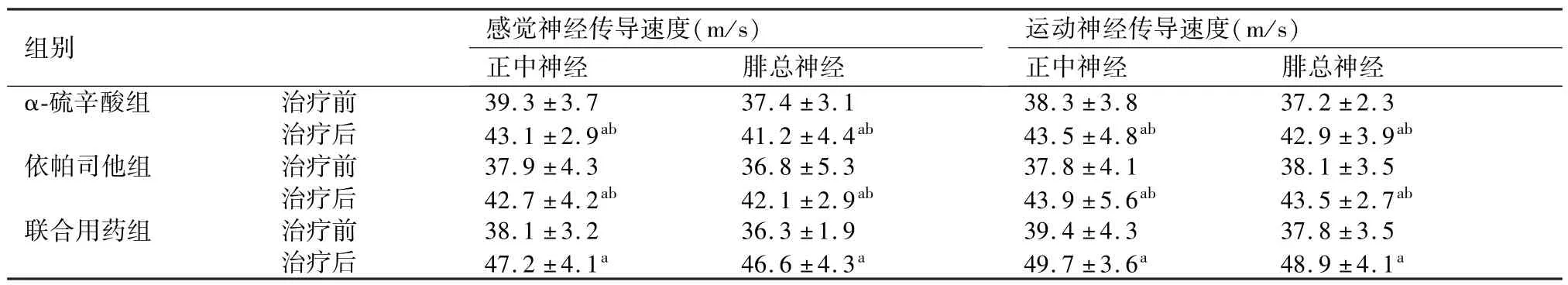
表2 三组治疗前后感觉神经传导速度及运动神经传导速度比较
3 讨 论
糖尿病周围神经病变是糖尿病最常见的慢性并发症,常影响患者的生存质量,严重者可致残、致死。DPN的发病机制较复杂,可能与高血糖毒性、氧化应激、代谢紊乱、微血管病变、自身免疫反应等多种因素相互作用导致神经细胞损伤、神经纤维缺血性脱髓鞘有关[7]。目前认为氧化应激在DPN病因学中起着重要作用[8-10],有效改善糖尿病患者机体的氧化应激及代谢紊乱状态,能延缓DPN的发生与发展。而近年来研究最多及临床应用最广的抗氧化剂为α-硫辛酸,它是一种强效抗氧化剂,一直以来被称为线粒体脱氢酶辅助因子,它可以直接清除氧自由基、一氧化氮自由基等氧化应激产物,改善氧化应激状态,同时促进内源性抗氧化剂的再生,发挥抗氧化性能,且该作用对血糖控制不佳的患者依然有效[11-14]。DPN中另一重要发病机制为代谢紊乱,在血糖持续增高时,醛糖还原酶被激活,使明显高于生理状态的葡萄糖进入多元醇通路,转化成山梨醇,导致体内山梨醇及果糖大量增加,从而引起神经细胞脱髓鞘、坏死[15],依帕司他是一种新型的可逆性醛糖还原酶抑制剂,通过抑制醛糖还原酶活性,减少多元醇通路的山梨醇及果糖的产生,从而改善糖尿病周围神经病变的症状和神经传导速度[16]。
本研究在控制饮食、控制血糖达标等基础上,对72例DPN患者分别给予依帕司他、α-硫辛酸、α-硫辛酸联合依帕司他治疗,结果提示:三组治疗后TCSS、TSS评分均较治疗前下降,但联合使用依帕司他和α-硫辛酸治疗组TCSS、TSS评分较单用依帕司他、α-硫辛酸组下降更显著。神经肌电图结果显示,联合用药组感觉神经传导速度及运动神经传导速度的改善较单用药组更加明显。三组患者用药过程中均未出现明显不良反应。因此,短期联合应用α-硫辛酸和依帕司他治疗糖尿病周围神经病变较两药单独使用疗效更好。目前联合使用依帕司他和α-硫辛酸对糖尿病周围神经病变的疗效优于单独用药的具体机制尚未完全阐明,可能是由于糖尿病周围神经病变发病机制复杂,与众多致病因素相关,而α-硫辛酸和依帕司他分别针对于其不同发病机制,从而疗效更佳,对于这一方面还需要进一步研究。
[1]Aszmann O,Tassler PL,Dellon AL.Changing the natural history of diabetic neuropathy:incidence of ulcer/amputation in the contralateral limb of patients with a unilateral nerve decompression procedure[J].Ann Plast Surg,2004,53(6):517-522.
[2]刘一敬,李晓冰.糖尿病周围神经病变的药物治疗[J].西南军医,2013,15(5):507-509.
[3]杨文英,纪立农,陆菊明,等.中国2型糖尿病防治指南(2010年版)[M].北京:北京大学医学出版社,2011,1-85.
[4]刘会贞,刘雯,李金荣,等.4种方法诊断糖尿病周围神经病变的评价[J].广东医学,2010,31(24):3253-3255.
[5]刘凤,毛季萍,颜湘,等.多伦多临床评分系统在糖尿病周围神经病变中的应用价值[J].中南大学学报(医学版),2008,33(12):1137-1141.
[6]韩亚娟,高方,薛耀明,等.α-硫辛酸注射液联合前列地尔治疗糖尿病周围神经病变的疗效观察[J].广东医学,2011,32(18):2464-2466.
[7]Yagihashi S.Recent advances in clinical practice and in Basic research on diabetic neuropathy[J].Brain Nerve,2011,63(6):571-582.
[8]Winkler G,Kempler P.Pathomechanism of diabetic neuropathy:background of the pathogenesis-oriented therapy[J].Orv Hetil,2010,151(24):971-981.
[9]Kovrazhkina EA.Demyelinating polyneuropathies in patients with diabetes mellitus and chronic alcoholic intoxication[J].Zh Nevrol Psikhiatr Im SSKorsakova,2012,112(5):41-45.
[10]Volchegorski IA,Rassokhina LM,Miroshnichenko IIu.Antihypoxic effect of 3-hydroxypyridine and succinic acid derivatives and their nootropic action in alloxan diabetes[J].Eksp Klin Farmakol,2011,74(12):27-32.
[11]Ziegler D,Low PA,Litchy WJ,et al.Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy:the NATHAN 1 trial[J].Diabetes Care,2011,34(9):2054-2060.
[12]Kapoor S.Pain Management in patients with diabetic nephropathy:the emerging role of伪-lipoic acid[J].Foot Ankle Spec,2012,5(4):228-229.
[13]McIlduff CE1,Rutkove SB.Critical appraisal of the use of alpha lipoic acid(thioctic acid)in the treatment of symptomatic diabetic polyneuropathy[J].Ther Clin Risk Manag,2011,7:377-385.
[14]Lyzogub VH,Altunina NV,Bondarchuk OM.Application of alpha-lipoic acid in clinical practice[J].Lik Sprava,2011,7-8:20-28.
[15]Hattori T,Matsubara A,Taniguchi K,et al.Aldose reductase inhibitor fidarestat attenuates leukocyte-endothelial interactions in experimental diabetic rat retina in vivo[J].Curr Eye Res,2010,35(2):146-154.
[16]Maladkar M,Rajadhyaksha G,Venkataswamy N,et al.Efficacy,safety,and tolerability of Epalrestat compared to Methylcobalamine in patients with diabetic neuropathy[J].Int JDiabetes Dev Ctries,2009,29(1):28-34.
Clinical Efficacy ofα-lipoic Acid Combined with Epalrestat in the Treatment of Type 2 Diabetic Peripheral Neuropathy
YAN Bin
(Department of Endocrinology,the First Affiliated Hospital,University of South China,Hengyang 421001,Hunan)
Objective To evaluate the clinical effect of combined therapy ofα-lipoic acid and epalrestat for diabetic peripheral neuropathy(DPN). Methods 72 patients of type2 diabetic peripheral neuropathy were randomly divided into 3 groups,24 cases in each group,group ofα-lipoic acid was only injected α-lipoic acid with 600mg,once daily;group of epalrestat was only with 50mg epalrestat orally,three times daily;combination group was injectedα-lipoic acid with 600mg,once daily,and taken with 50mg epalrestat orally,three times daily;for three weeks.Toronto clinical scoring system(TCSS),the total symptom score(TSS)and nerve conduction velocity(NCV)were performed before and after therapy. Result The scores of TCSS and TSS were decreased after treatment as compared with before treatment in three groups,and the scores of the combined treatment group were more significantly reduced than that of monotherapy groups;NCV in the combined treatment group improved greatly more than that in monotherapy groups;the efficiency was statistically significant(P<0.05). Conclusion The combined therapy withα-lipoic acid and epalrestat has more significant effect than single drug therapy with epalrestat andα-lipoic acid for diabetic peripheral neuropathy in the clinic.
diabetes; neuropathy; α-lipoic acid; epalrestat
R587.1
A
10.15972/j.cnki.43-1509/r.2015.02.012
2014-11-10;
2014-12-26
(此文编辑:秦旭平)
