土壤熏蒸-微生物有机肥联用对连作马铃薯生长和土壤生化性质的影响
2015-01-02刘星张书乐刘国锋邱慧珍王蒂张俊莲沈其荣
刘星,张书乐,刘国锋,邱慧珍*,王蒂,张俊莲,沈其荣
(1.甘肃农业大学资源与环境学院,甘肃省干旱生境作物学重点实验室,甘肃 兰州730070;2.甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州730070;3.甘肃农业大学农学院,甘肃 兰州730070;4.南京农业大学资源与环境科学学院,江苏 南京210095)
马铃薯(Solanumtuberosum)是继小麦(Triticumaestivum)、玉米(Zeamays)和水稻(Oryzasativa)之后全球第四大粮食作物,中国是世界最大的马铃薯生产国,马铃薯产业在国民经济发展和保证粮食供应安全中占有重要地位[1-2]。甘肃中部沿黄灌区是我国加工型马铃薯的主要生产基地,也是西北最大的种薯繁殖基地,该地区马铃薯种植呈现规模化、机械化和集约化的特点,经营销售模式以订单农业为主,随着近年来农产品价格的不断走高和马铃薯消费逐步向高附加值产品转变,农垦企业在满足订单需求的同时,也造成了作物结构相对单一、倒茬困难和马铃薯的多年连作[3-5],导致植株生长发育受阻,块茎产量和品质下降,土传病害猖獗等一系列问题,严重影响企业和农户的种植效益。因而探明马铃薯种植的连作障碍机理,寻求能够缓解和克服马铃薯连作障碍的有效途径,对于促进该地区马铃薯生产的可持续发展具有重要的理论意义和实践价值。
农作物连作障碍机理目前已成为全球性的研究热点,随着研究的深入以及相关学科间的交叉融合,作为植株和土壤媒介的微生物尤为受到关注。研究表明[6-14],细菌型土壤向真菌型土壤的转变和根际微生物群落结构的显著改变是连作障碍产生的主要原因,可以导致根际微生态环境恶化以及土壤微生物区系的失衡并诱发土传病害,特别是真菌型的土传病害,造成了连作系统下作物的大幅度减产。这与本课题组前期在甘肃中部沿黄灌区进行的长期定位试验结果一致。随着连作年限的延长,马铃薯根际土壤微生物群落结构显著改变,病原菌过渡成为优势种群,真菌型土传病害病原菌的数量明显增加,带来病害的大面积发生[15-20]。因而在国内外连作障碍防控研究中,土传病原菌合理有效抑制并重建土壤健康的微生物区系都是重点考虑的科学问题。目前,多采用土壤熏蒸的方法,如甲醛、石灰氮、过氧乙酸、甲基溴和三氯硝基甲烷等进行化学熏蒸直接杀灭连作土传病原菌,但其后果是土壤中的有益微生物类群同样受到破坏性的影响,微生物群落结构显著改变,土壤微生物区系失衡[21-23]。这类方法的应用也未能考虑连作有益土壤微生物区系的修复和重建。很多学者试图从生防的角度出发,施用携带针对性的拮抗菌和其他有益菌的微生物有机肥料来调节土壤微生物区系以克服连作障碍,但耗时较长且田间效果不稳定,这主要与微生物有机肥的种类和质量、有机物料和土传病原菌的种类以及供试的生态环境条件具有重要关系[24-25]。本课题组在2010和2011年连续进行的田间试验证实,单独施用微生物有机肥料进行土壤改良并不能抑制连作系统下马铃薯块茎产量的严重下降。为寻求缓解或克服马铃薯连作障碍的有效方法,本课题组提出将土壤熏蒸和微生物有机肥料施用两种方法有机结合的思路,即在播种前通过土壤熏蒸来杀灭土传致病菌,而后在植株生育期内将微生物有机肥多次兑水浇灌至植株根部,持续地向马铃薯根际直接补充拮抗微生物和有益微生物,人工定向调控马铃薯连作土壤微生物区系,改善根际微生态环境。本研究的目的在于评估这种土壤熏蒸和微生物有机肥联用的方法对甘肃省中部沿黄灌区马铃薯连作障碍的防控效果,特别是对块茎产量、植株生长以及土壤致病菌动态、微生物区系和酶活性等的影响,以期为实践生产提供科学依据。
1 材料与方法
1.1 试验区概况
田间试验于2012年在位于甘肃省中部沿黄灌区的白银市景泰县条山农场进行(东经103°33′-104°43′,北纬36°43′-37°38′;海拔1274~3321m),当地具有充足的水源和良好的农业灌溉条件。属温带大陆性干旱气候,年均气温为9.1℃,年均无霜期141d。年均降水量185.6mm,年均蒸发量1722.8mm。年均日照时数2713h,全县光热资源丰富,日照百分率62%,太阳年平均辐射量6.20×105J/m2,≥0℃的年活动积温3614.8℃,≥10℃的年有效积温3038℃。供试土壤为灰钙土,质地为砂壤。
1.2 试验设计与方法
选择地势平坦、整齐、且土壤肥力均匀的马铃薯连作3年地块进行田间试验,熏蒸开始前采集混合土样测定耕层土壤基本理化性状:有机质12.7g/kg,全氮0.52g/kg,碱解氮51.63mg/kg,速效磷6.96mg/kg,速效钾174.62mg/kg,水土比5∶1条件下pH为8.67。基于环境风险和人畜健康考虑,本研究选择氨水和石灰氮作为土壤的化学熏蒸剂,试验设计5个处理:CK,空白对照;SFA,施用氨水进行土壤熏蒸;SFB,施用石灰+碳铵进行土壤熏蒸;SFA+BOF,土壤氨水熏蒸+微生物有机肥浇灌;SFB+BOF,土壤石灰+碳铵熏蒸+微生物有机肥浇灌。每个处理3次重复,完全随机区组排列,小区面积为5.4m×10.0m。采用统一的马铃薯栽培种植模式和施肥量,宽垄双行覆膜种植,在播种前一天切种薯,并用浓度为1.5%的高锰酸钾溶液浸泡消毒,垄宽和行距分别为1.35m和0.70m,株距为0.17m,种植密度约为8.25×104株/hm2。氮肥用量为210kg N/hm2,N∶P2O5∶K2O比例为1.4∶1.0∶2.0,化肥分别用养分含量为15-15-15的复合肥和含 N 46%的尿素以及含 K2O 51%的硫酸钾进行施用。土壤熏蒸的具体操作如下:将半腐熟玉米秸秆平铺至处理小区,将氨水(或石灰+碳铵)均匀洒到秸秆表面,然后快速地人工翻埋,深度为0~20cm,再用水浇灌使土壤饱和,最后用双层棚膜覆盖整个小区,四周用土压实密闭防止氨挥发和风吹。土壤熏蒸1个月时间,而后揭膜晾晒7d,使氨完全挥发,最后采集少量熏蒸后土壤进行室内发芽试验,以保证马铃薯正常出苗。市售氨水和秸秆的用量分别为130L/667m2和3 m3/667m2,碳铵和生石灰的用量均为200kg/667m2,氨水和碳铵为等氮量施用。微生物有机肥施用的具体操作如下:在马铃薯出苗后每间隔20d进行浇灌,全生育期共计4次,将微生物有机肥兑水后沿马铃薯植株茎基部浇灌,浇灌浓度为2%,每株浇灌量为0.5kg。其他处理小区的马铃薯植株浇灌等量的清水代替。微生物有机肥由南京农业大学植物营养系提供,有机质含量为30.4%,全氮为2.0%,其中氨基酸态氮占总氮的60%以上,P2O5为3.7%,K2O为1.1%,含根际促生细菌和抗土传病害功能菌数量大于108cfu/g,拮抗型微生物菌种为枯草芽孢杆菌和木酶。播种和施肥过程采用机械化一次进行,而后由人工覆膜。所有化肥均在播种时一次性基施,无追肥,其余栽培、灌溉和田间管理措施均按农场统一方法进行。2012年5月15日播种,9月15日收获。供试材料为当地主栽的加工型马铃薯品种大西洋,由条山农场提供。
1.3 样品采集与分析
分别在马铃薯播前(5月10日,即土壤消毒完成后)、苗期(6月25日)、开花期(7月10日)、块茎膨大期(8月10日)、淀粉积累期(8月27日)和收获期(9月14日)采用五点取样法采集各小区土壤样品,采样均在垄上马铃薯行间进行,深度为0~20cm。块茎膨大期调查各个小区的植株发病率,同时采集植株样品,每个小区使用铁锹在尽量不破坏根系的前提下将植株整株挖出5株,测定植株主茎上顶枝的倒3和倒4叶的叶绿素含量,然后用剪刀将根系剪下,置于冰盒中带回实验室测定根系形态学参数。收获时在每个小区随机采集健壮程度和长势一致的无病害马铃薯植株10株,进行考种,调查株高和茎粗等农艺性状和产量构成要素,将植株整株挖出,分根、茎、叶和块茎四部分在105℃下杀青30min,80℃烘至恒重,称量干物质。记录试验小区马铃薯块茎实测产量,并对薯块进行分级,调查商品薯率、病薯率和畸形薯率。
叶绿素含量采用SPAD值来表示,SPAD-502型叶绿素仪测定。在室内将根系用水缓慢冲洗干净,尽量不伤及毛根,根系形态包括总根长、根表面积、根直径、根体积和根尖数等指标,采用加拿大产 Win RHIZOTM 2009根系扫描与分析系统测定[26]。
土壤微生物计数采用稀释平板法,真菌采用马丁氏培养基,细菌采用牛肉膏蛋白胨培养基,放线菌采用高氏1号培养基,镰刀菌的计数采用Komada培养基[10,27]。土壤酶包括脲酶、蔗糖酶、过氧化氢酶、脱氢酶和磷酸酶活性的测定方法参考相关的实验工具书[28-29]。
1.4 数据处理
采用SPSS 19.0数据处理软件对试验数据进行统计分析,不同处理间数据的多重比较采用Duncan新复极差法完成。图表绘制在Microsoft Excel 2007软件上进行。
2 结果与分析
2.1 土壤熏蒸和微生物有机肥联用对连作马铃薯块茎产量和产量构成及农艺性状的影响
马铃薯收获时,对各处理的块茎产量和产量构成因素以及植株的农艺性状进行调查(表1)。与CK相比,SFA处理的块茎产量无显著变化,SFB处理则显著下降5.09%。SFA+BOF和SFB+BOF处理块茎产量较CK均有显著的增加,增幅分别达到13.62%和20.36%,表明单独土壤熏蒸并不能改善连作马铃薯的块茎产量,而土壤熏蒸和微生物有机肥联用则能够显著增加连作马铃薯的块茎产量。在与微生物有机肥料联用的条件下,石灰+碳铵熏蒸的效果优于氨水熏蒸。单株产量、单株结薯数量和单薯重量是表征马铃薯块茎产量构成的重要因素,从表1也可以看出,单株产量的变化趋势与块茎产量一致。而不同处理之间单株结薯数量均无显著差异,单薯重量则差异显著。SFB+BOF处理单薯重量较CK显著增加33.71%,而SFA、SFB和SFA+BOF处理与CK相比均无显著变化。统计分析表明,块茎产量同单株产量(R2=0.8873,P<0.0001,n=15)与单薯重量(R2=0.2851,P=0.0403,n=15)之间均具有显著或极显著的线性关系,表明单株产量和单薯重量的变化共同导致了土壤熏蒸和微生物有机肥联用处理下连作马铃薯产量的增加;另外,单株产量与单薯重量之间也存在显著的线性关系(R2=0.3129,P=0.0302,n=15),而其与单株结薯数量之间则并无显著线性关系存在,表明马铃薯块茎产量的形成更多依赖于单薯重量的增加而非结薯数量,推测马铃薯结薯数量可能更多地受基因型控制。在植株的田间农艺性状上,不同处理间株高、茎围和分株数均无显著差异,但主茎分枝数差异明显。SFA+BOF和SFB+BOF处理的主茎分枝数较CK分别显著增加13.92%和16.46%,SFA和SFB处理较CK则无显著变化。主茎分枝数的增加一方面能够使得SFA+BOF和SFB+BOF处理下单株马铃薯承载更多的叶片,提高光合器官源面积;另一方面有利于形成更为庞大的地上冠层结构,在群体动态上增加对光能辐射的单位截获量。
2.2 土壤熏蒸和微生物有机肥联用对连作马铃薯生物量的影响
马铃薯植株整株和不同器官的生物量以及根冠比和收获指数的结果见表2。SFA+BOF和SFB+BOF处理的整株生物量较CK分别显著增加55.86%和78.15%,表明土壤熏蒸和微生物有机肥联用能够大幅度增加连作马铃薯的生物产量。另外,SFB+BOF处理较SFA+BOF处理相比整株生物量也显著增加14.30%,这与块茎产量的趋势一致,石灰+碳铵熏蒸与微生物有机肥联用的效果优于氨水熏蒸与微生物有机肥的联用。SFA和SFB处理下整株生物量较CK均有不同程度的增加,但增幅较小。就不同器官而言,SFA+BOF和SFB+BOF处理下的茎和叶,以及块茎的生物量较CK都有显著的增加。块茎生物量占到整株生物量的80%以上,不同处理下块茎生物量的变化趋势与整株一致。与CK相比,单独的土壤熏蒸或与微生物有机肥联用条件下根冠比和收获指数均无显著变化。
2.3 土壤熏蒸和微生物有机肥联用对植株发病率和薯块分级的影响
马铃薯植株发病率和收获后薯块分级的结果如图1所示。SFA和SFB处理与CK相比在植株发病率上并未出现显著差异,表明单独的土壤熏蒸应用并不能有效降低连作马铃薯植株的发病率,SFA+BOF和SFB+BOF处理较CK发病率分别显著下降54.92%和72.82%,且SFB+BOF处理发病率也显著低于SFA+BOF处理,土壤熏蒸和微生物有机肥的联用可以作为抑制连作马铃薯植株发病的有效措施。统计结果表明,块茎产量与植株发病率之间具有极显著的负相关关系(R2=-0.9013,P<0.0001,n=15)。不同处理下连作马铃薯的商品薯率无显著的变化。而在病薯率上,SFA、SFB、SFA+BOF和SFB+BOF处理与CK相比均出现显著的下降,其中以SFA+BOF和SFB+BOF处理的降幅最大,分别为66.15%和64.76%,表明土壤熏蒸和微生物有机肥联用能够显著降低连作马铃薯的薯块发病率。SFA+BOF和SFB+BOF处理与CK相比在畸形薯率上无显著差异。
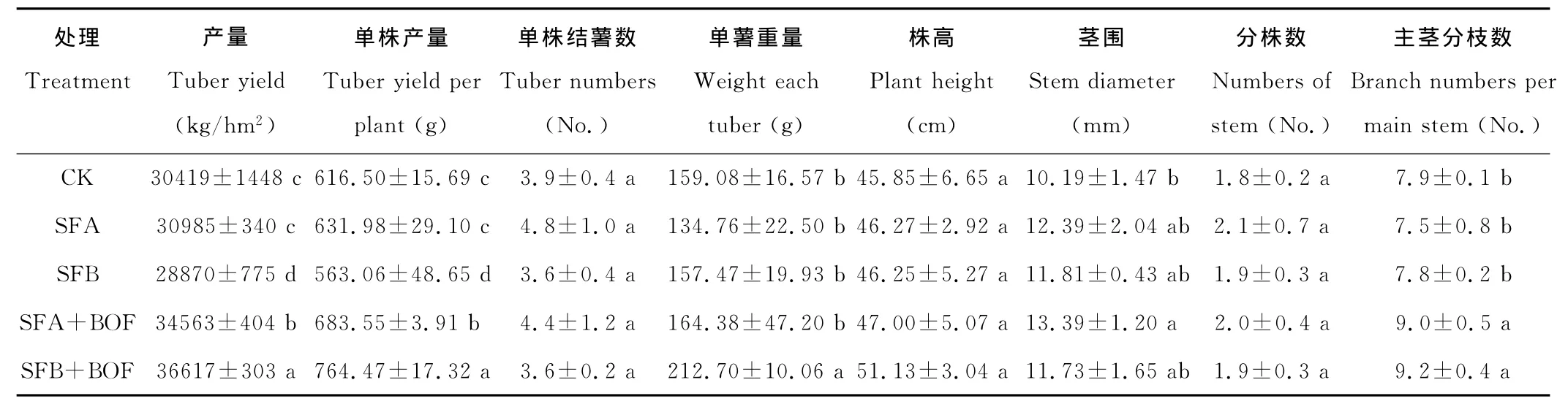
表1 马铃薯块茎产量及其产量构成要素和植株农艺性状的比较Table 1 Comparison on tuber yield and its yield component factors as well as field agronomic characteristics of potato plants
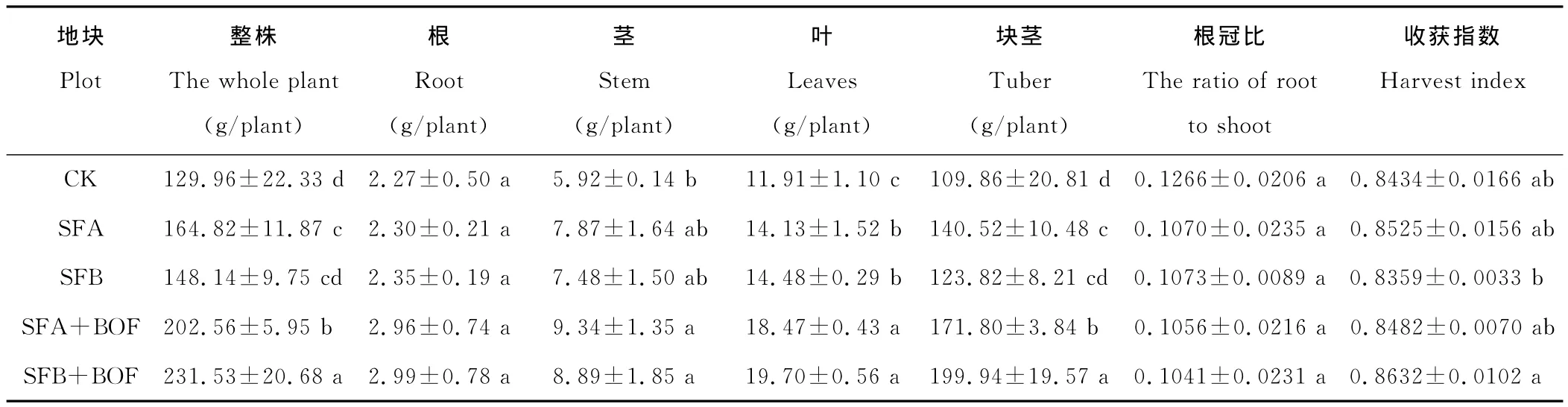
表2 马铃薯整株和不同器官生物量的比较Table 2 Comparison on biomass of the whole plant and different organs of potato
2.4 土壤熏蒸和微生物有机肥联用对连作马铃薯叶绿素含量和根系形态参数的影响
块茎膨大期是马铃薯产量形成的关键时期,马铃薯整个生育期内,块茎膨大期植株干物质的积累量占总积累量的60%以上。本研究测定了块茎膨大期时马铃薯植株的叶绿素含量和根系的形态参数,从表3可知,土壤熏蒸和微生物有机肥的联用影响了连作马铃薯植株的生长发育。SFA+BOF和SFB+BOF处理与CK相比,叶绿素含量分别显著增加14.46%和13.75%,从而有效增强马铃薯植株同化产物的生产以及花后更多的同化产物向块茎中的转运。而SFA和SFB处理的叶绿素含量较CK则无显著变化。在根系的形态特征上,SFA+BOF和SFB+BOF处理的总根长较CK分别显著增加16.46%和22.65%,根表面积分别增加31.59%和35.71%,同时根尖数也分别显著增加30.10%和35.86%,表明土壤熏蒸和微生物有机肥联用能够有效改善连作马铃薯的根系形态特征,促进根系伸展,同时形成更多的侧根,扩大根系所接触的土壤面积,从而有利于对土壤养分和水分的吸收,为块茎产量的提高打下了良好的基础。SFA和SFB处理对连作马铃薯植株的根系形态特征则无显著影响。

图1 土壤熏蒸和微生物有机肥对植株发病率和马铃薯薯块分级的影响Fig.1 Effect of soil fumigation and bio-organic fertilizer application on the incidence of diseased plant and classification of potato tuber

表3 块茎膨大期马铃薯植株叶绿素含量和根系形态参数的比较Table 3 Comparison on SPAD value and root morphological parameters of potato plant in tuber bulking stage
2.5 土壤熏蒸和微生物有机肥联用对马铃薯连作土壤可培养微生物数量的影响
从图2可以看出,土壤熏蒸和微生物有机肥的联用显著影响马铃薯连作土壤可培养微生物的数量。与CK相比,土壤熏蒸尽管降低了播前和苗期土壤细菌的数量,但随着马铃薯生育进程的推进,微生物有机肥料多次浇灌后,大量的外源细菌型有益微生物和拮抗微生物进入土壤,SFA+BOF和SFB+BOF处理细菌数量出现快速的增加并大幅度地高于CK、SFA和SFB处理,这一过程持续至马铃薯收获。而SFA和SFB处理较CK在细菌数量上并未出现显著的差异。
不同处理条件下土壤真菌的数量在马铃薯整个生育期内均表现出SFB+BOF>SFA+BOF>SFA或SFB>CK的趋势,表明单独的土壤熏蒸或与微生物有机肥联用均能降低马铃薯连作土壤真菌数量,且SFA+BOF和SFB+BOF处理较CK均达到差异显著水平。就土壤放线菌数量而言,不同处理间的差异主要体现在马铃薯淀粉积累期和收获期,表现为SFA+BOF和SFB+BOF处理显著高于CK、SFA和SFB处理,而SFA和SFB处理较CK均无显著差异。另外,自花期开始,随着微生物有机肥的浇灌,SFA+BOF和SFB+BOF处理较CK大幅度地提高了土壤中细菌与真菌数量的比值,驱动着连作土壤向“细菌型”的转变,SFA和SFB处理较CK相比均无显著差异。
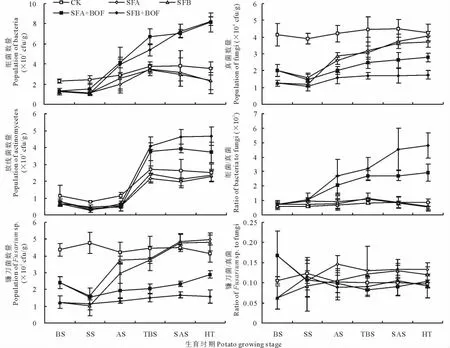
图2 土壤熏蒸和微生物有机肥对土壤可培养微生物数量的影响Fig.2 Effect of soil fumigation and bio-organic fertilizer application on population of soil cultural microorganisms
SFA和SFB处理较CK都显著降低了播前和苗期土壤的镰刀菌数量,且SFB处理条件下镰刀菌数量显著低于SFA处理,表明土壤熏蒸能够有效抑制连作土壤中的镰刀菌生长,石灰+碳铵熏蒸的抑制效果优于氨水熏蒸。这种土壤熏蒸对镰刀菌的抑制效果持续至马铃薯苗期,但从花期开始,SFA和SFB处理下镰刀菌数量都出现快速的回升,至马铃薯收获,两个处理镰刀菌数量都高于CK。在SFA+BOF和SFB+BOF处理下,这种土壤镰刀菌数量回升的情况并未出现,随着微生物有机肥的浇灌,拮抗微生物的引入使得镰刀菌的数量仍然维持在一个远低于CK的水平,且SFB+BOF处理的镰刀菌数量在整个生育期都要低于SFA+BOF处理。结果表明,土壤熏蒸和微生物有机肥联用能够有效抑制马铃薯整个生育期内连作土壤镰刀菌的数量,石灰+碳铵熏蒸与微生物有机肥联用的效果更好。而镰刀菌与真菌数量的比值,不同处理与CK相比在整个生育期内并未出现显著差异。
统计分析结果表明,从块茎膨大期开始至马铃薯收获,细菌/真菌与块茎产量(R2=0.7774,P<0.0001,n=45)和植株发病率(R2=-0.7923,P<0.0001,n=45)均具有显著或极显著的线性相关关系,同时,镰刀菌数量与块茎产量(R2=-0.7608,P<0.0001,n=45)和植株发病率(R2=0.8421,P<0.0001,n=45)也具有显著或极显著的线性相关关系。表明通过抑制连作系统下土传真菌的数量来控制植株发病率和改善土壤微生物区系是土壤熏蒸和微生物有机肥联用处理下块茎产量显著增加的直接原因。
2.6 土壤熏蒸和微生物有机肥联用对马铃薯连作土壤酶活性的影响
本研究也测定了土壤中与C、N、P转化和氧化还原等生化过程相关的酶类活性(表4)。从苗期至马铃薯收获,SFA+BOF和SFB+BOF处理的脲酶活性均高于CK、SFA和SFB三个处理。在苗期、花期和块茎膨大期,SFA+BOF处理土壤脲酶活性与CK相比分别显著增加了113.78%,56.70%和163.14%,SFB+BOF处理较CK相比在整个生育期内均未出现显著差异。就土壤蔗糖酶、脱氢酶和过氧化氢酶活性而言,马铃薯播前及其整个生育期内,SFA+BOF和SFB+BOF处理较CK并未出现显著变化。土壤熏蒸和微生物有机肥联用对土壤磷酸酶的活性影响显著。从播前开始至马铃薯收获,土壤磷酸酶活性均表现出SFA+BOF或SFB+BOF>SFA或SFB>CK的趋势,且SFA+BOF和SFB+BOF处理显著高于CK。在块茎膨大期,SFA+BOF和SFB+BOF处理土壤磷酸酶活性较CK显著增加了32.77%和38.11%;在淀粉积累期,分别增加了30.90%和37.16%。SFA+BOF和SFB+BOF处理间土壤磷酸酶活性在播前和整个生育时期未出现显著差异。
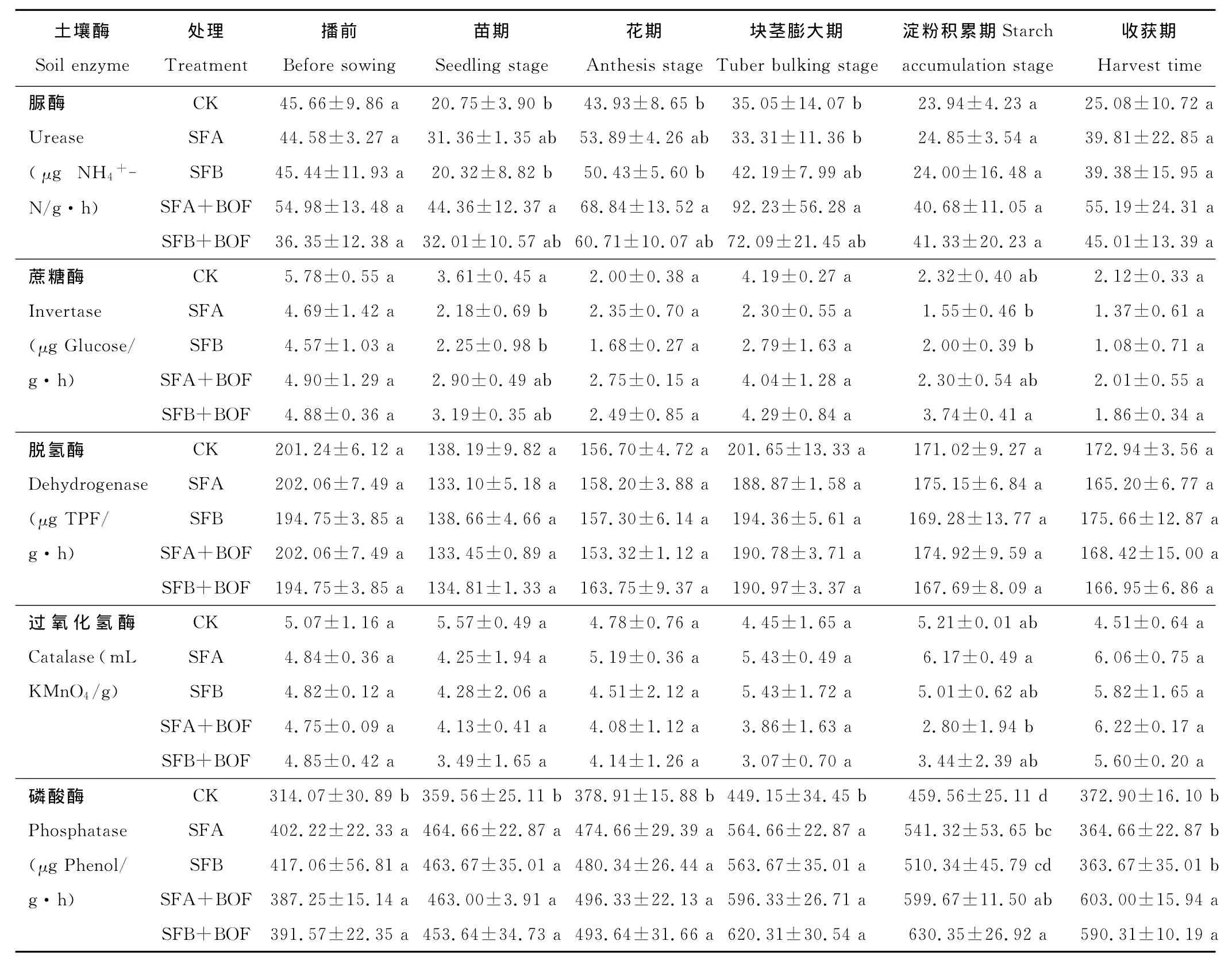
表4 土壤熏蒸和微生物有机肥联用对土壤酶活性的影响Table 4 Effect of the combination of soil fumigation and bio-organic fertilizer application on soil enzyme activities
3 讨论
3.1 土壤熏蒸和微生物有机肥联用对连作马铃薯块茎产量和生长发育的影响
集约化条件下的马铃薯生产和订单农业的种植模式导致甘肃省中部沿黄灌区出现严重的马铃薯连作障碍。本课题组前期的研究结果显示,连作两年是在当地生态环境和栽培及品种条件下马铃薯连作的阈值年限,自连作三年开始,马铃薯块茎产量开始出现严重的下降,降幅通常能够达到25%~50%[3,16]。因而本研究选择在马铃薯连作三年地块上开展田间试验,试图通过土壤熏蒸和微生物有机肥联用的方法来减少连作马铃薯产量的损失,将产量维持在当地平均水平。田间试验结果表明,土壤熏蒸和微生物有机肥的联用能够显著增加连作三年马铃薯的块茎产量,石灰+碳铵熏蒸配合微生物有机肥浇灌的效果显著优于氨水熏蒸与微生物有机肥的联用。SFB+BOF处理下块茎产量达到36617kg/hm2,已达到当地马铃薯的平均产量水平(亩产2.5t左右)。Yao等[30]关于苹果(Maluspumila)连作障碍防控的研究结果表明,土壤熏蒸和堆肥改良的联合应用并不能改善果树生长发育状况和提高果实产量,推测可能与堆肥的种类和性质、熏蒸剂的选择和用量以及熏蒸剂效用成分在不同质地土壤中的渗透效果等多种因素有关[31]。同时,土壤熏蒸和微生物有机肥的联用大幅度地降低了连作马铃薯植株的发病率,直接导致块茎产量的增加,表明对于土传病害严重的土壤,先进行土壤预处理,然后再施用微生物有机肥能有效抑制病害的产生,克服连作障碍,这与前人的报道一致[32]。就收获后的薯块而言,尽管不同处理之间在薯块商品率上无显著差异,但土壤熏蒸和微生物有机肥的联用显著降低病薯率,病薯率的大幅度降低对于改善马铃薯的窖藏品质,提高规模化马铃薯种植企业的经济效益具有重要意义。土壤熏蒸和微生物有机肥联用处理也显著改善连作马铃薯植株的生长发育,包括提高叶绿素含量和维持相对优化的根系形态结构,从而能够有效提升植株的光合生产强度,同时增强植株对土壤水分和养分的吸收利用,这是块茎产量增加的又一重要原因。相比之下,单独的土壤熏蒸应用(SFA和SFB处理)并未能造成连作马铃薯根系形态特征的显著改变。阮维斌等[33]和Yuen等[34]分别对连作大豆(Glycinemax)和草莓(Fragariaananassa)的研究证实,使用溴甲烷进行播前土壤熏蒸能够改善作物根系形态,增加总根长和侧根数,以及根长密度等,这与本研究中田间试验结果的差异可能与作物品种以及病害种类的不同有关。
3.2 土壤熏蒸和微生物有机肥联用对马铃薯连作土壤生化性质的影响
不同作物连作障碍发生的原因差别很大,但主要来自土壤,其中微生物种群结构失衡是导致土壤质量下降和作物减产的重要原因,其显著特点是土传病原菌过度,成为优势种群,病虫害大量滋生[7-8,16]。因镰刀菌导致的枯萎病是甘肃省马铃薯连作种植过程中的主要病害。田间试验结果表明,土壤熏蒸和微生物有机肥联用的方法能够有效抑制连作土壤镰刀菌的数量,降低植株的发病率。前人试图通过外源物料的引入或其他农艺措施来抑制连作系统下的土传病害和改善土壤微生物区系,进而达到缓解甚至克服连作障碍的目的,减少作物产量的损失。目前已有部分的报道,主要是从连作土壤熏蒸(消毒或灭菌),以及携带拮抗菌的微生物类肥料的生防应用两个方面开展研究,但未能取得一致的研究效果。结合本研究,可以从3个方面分析原因:1)连作土壤灭菌后尽管能在短期内大量抑制或杀死土壤中的致病微生物,但土壤微生物群落结构会在很短的时间内迅速得以恢复,病原微生物的数量甚至还会有所增加,并且这种变化过程很难受人工控制和定量[35]。这与本研究的结果类似,在播前土壤中,SFA和SFB处理的镰刀菌数量较CK大幅度地降低,但随着生育进程的推进,这两个处理下的土壤镰刀菌数量出现快速的回升。从生态学的角度来看,土壤熏蒸后抑制或消除了土壤中大部分的微生物,一旦外源微生物通过各种途径侵入土壤,就等于微生物进入到一个养分和空间的无限环境,在一定时期内会以指数形式迅速繁殖,其数量也会在短期内超过自然土壤承受极限[36]。甚至消毒后的土壤中残存的部分病原微生物也会在近似于无限养分和空间条件下短期内大量重新生长繁殖。在SFA+BOF和SFB+BOF处理下,由于浇灌带来拮抗微生物和有益微生物不断补充进土壤,能够持续地将镰刀菌的数量维持在一个较低的水平,并且改善微生物区系,抑制因镰刀菌侵染而导致的植株发病。2)目前生产上经常用到的熏蒸剂由于其作用强度较大,土壤中的有害微生物或线虫等被彻底杀死的同时,一些对于作物生长有益的微生物种类同样也被杀死,微生物群落结构改变程度较大,间接导致了土壤微生物区系的不均衡,以及有益菌和致病菌在种群和个体数量上的相对变化[23]。细菌与真菌数量的比值通常被认为是表征土壤健康的重要指标[11],本试验中SFA和SFB处理下细菌/真菌较CK并未表现出显著的差异,而在SFA+BOF和SFB+BOF处理下这一比值在生育后期显著低于CK,大量的细菌型有益微生物和拮抗微生物随肥料浇灌直接进入连作马铃薯根际,导致土壤向“细菌型”的转变,使得连作土壤微生物区系特征得到初步的改善。3)大多数情况下,有机物料对土传病害的防控和微生物区系的改变是基于整个土壤生物活性的提高,因此往往需要大量的投入和较长时间才能获得较好的效果[37]。传统的肥料施用方法也导致拮抗菌远离根系,不能形成在作物根际范围内的有效定植[38-40]。本研究采用浇灌的方式将拮抗菌直接引入马铃薯根际,有助于拮抗菌的定植和根系周围“生物墙”的形成[41-42]。
土壤熏蒸和微生物有机肥的联用对土壤相关酶活性的影响较小,SFA+BOF和SFB+BOF处理下脱氢酶、过氧化氢酶、蔗糖酶和脲酶活性较CK并未出现大幅度的改变,我们认为这对于维持土壤正常的生理生化功能具有重要的意义。前人的报道也证明使用溴甲烷等进行土壤熏蒸能够显著降低土壤多种酶的活性,不利于改善土壤的生产力[21]。但单独的土壤熏蒸或与微生物有机肥联用显著增加了土壤磷酸酶的活性,可能与土壤熏蒸后微生物细胞死亡,微生物生物量磷的向外释放有关[43]。
Reference:
[1]Wang B,Ma Y L,Zhang Z B,etal.Potato viruses in China.Crop Protection,2011,30:1117-1123.
[2]Jansky S H,Jin L P,Xie K Y,etal.Potato production and breeding in China.Potato Research,2009,52:57-65.
[3]Shen B Y,Liu X,Wang D,etal.Effects of continuous cropping on potato eco-physiological characteristics in the Yellow River irrigation area of the central Gansu Province.Chinese Journal of Eco-Agriculture,2013,21(6):689-699.
[4]Shen B Y,Yu B,Wang W,etal.Study on the application of humic ammonia,organic fertilizer,microbial fertilizer to eliminate continuous cropping obstacles of potato in the arid regions of Gansu.Soils and Fertilizers Sciences in China,2011,(2):68-70.
[5]Yu B,Shen B Y,Wang W,etal.Effects of different potato varieties on preventing continuous cropping obstacle in the arid regions.Journal of Gansu Agricultural University,2012,47(4):43-47.
[6]Huang L F,Song L X,Xia X J,etal.Plant-soil feedbacks and soil sickness:from mechanisms to application in agriculture.Journal of Chemical Ecology,2013,39:232-242.
[7]Fiers M,Edel-Hermann V,Chatot C,etal.Potato soil-borne diseases:a review.Agronomy for Sustainable Development,2012,32:93-132.
[8]Shipton P J.Monoculture and soilborne plant pathogens.Annual Review of Phytopathology,1977,15:387-407.
[9]Yim B,Smalla K,Winkelmann T.Evaluation of apple replant problems based on different soil disinfection treatments-links to soil microbial community structure.Plant and Soil,2012,366:617-631.
[10]Savario C F,Hoy J W.Microbial communities in sugarcane field soils with and without a sugarcane cropping history.Plant and Soil,2011,341:63-73.
[11]Li C G,Li X M,Kong W D,etal.Effect of monoculture soybean on soil microbial community in the Northeast China.Plant and Soil,2010,330:423-433.
[12]Yao H Y,Jiao X D,Wu F Z.Effects of continuous cucumber cropping and alternative rotations under protected cultivation on soil microbial community diversity.Plant and Soil,2006,284:195-203.
[13]Larkin R P.Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics,substrate utilization,and fatty acid profiles.Soil Biology and Biochemistry,2003,35:1451-1466.
[14]Li J P,Li M Q,Hui N N,etal.Population dynamics of main fungal pathogens in soil of continuously cropped potato.Acta Prataculturae Sinica,2013,22(4):147-152.
[15]Lu L H,Yin S X,Liu X,etal.Fungal networks in yield-invigorating and-debilitating soils induced by prolonged potato monoculture.Soil Biology and Biochemistry,2013,65:186-194.
[16]Meng P P,Liu X,Qiu H Z,etal.Fungal population structure and its biological effect in rhizosphere soil of continuously cropped soil.Chinese Journal of Applied Ecology,2012,23(11):3079-3086.
[17]Niu X Q,Li J H,Zhang J L,etal.Changes ofFusariumin rhizosphere soil under potato continuous cropping systems in arid irrigated area of Gansu Province.Acta Prataculturae Sinica,2011,20(4):236-243.
[18]Li R Q,Liu X,Qiu H Z,etal.Rapid detection of Rhizoctonia in rhizopshere soil of potato using real-time quantitative PCR.Acta Prataculturae Sinica,2013,22(5):136-144.
[19]Li R Q,Liu X,Qiu H Z,etal.Changes in the dominant pathogens causingFusariumdry rot of potato in rhizospheric soil under continuous potato cropping systems based on real-time quantitative PCR.Acta Prataculturae Sinica,2013,22(6):239-248.
[20]Cao L,Qin S H,Zhang J L,etal.Effects of leguminous forage rotations on soil microbe consortiums and enzyme activity in continuously cropped potato fields.Acta Prataculturae Sinica,2013,22(3):139-145.
[21]Klose S,Acosta-Martínez A,Ajwa H A.Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides.Soil Biology Biochemistry,2006,38:1243-1254.
[22]Ladd J N,Brisbane P G,Butler J H A,etal.Studies on soil fumigation-III:Effects on enzyme activities,bacterial numbers and extractable ninhydrin reactive compounds.Soil Biology Biochemistry,1976,8:255-260.
[23]Jawson M D,Franzluebbers A J,Galusha D K,etal.Soil fumigation within monoculture and rotations:response of corn and mycorrhizae.Agronomy Journal,1993,85:1174-1180.
[24]Zhang R F,Shen Q R.Characterization of the microbial flora and management to induce the disease suppressive soil.Journal of Nanjing Agricultural University,2012,35(5):125-132.
[25]Bonanomi G,Antignani V,Capodilupo M,etal.Identifying the characteristics of organic soil amendments that suppress soilborne plant diseases.Soil Biology and Biochemistry,2010,42:136-144.
[26]Wu Q P,Chen F J,Chen Y L,etal.Root growth in response to nitrogen supply in Chinese maize hybrids released between 1973and 2009.Science China Life Sciences,2011,54:642-650.
[27]Komada H.Development of a selective medium for quantitative isolation ofFusariumoxysporumfrom natural soil.Review of Plant Protection Research,1975,8:114-124.
[28]Li Z G,Luo Y M,Teng Y.Research Methods in Soil and Environmental Microorganisms[M].Beijing:Science Press,2008:395-412.
[29]Zhou Q.Guidbook of Plant Physiological Experiments[M].Beijing:China Agricultural Press,2008:112-113.
[30]Yao S,Merwin I A,Abawi G S,etal.Soil fumigation and compost amendment alter soil microbial community composition but do not improve tree growth.Soil Biology and Biochemistry,2006,38:587-599.
[31]Merwin I A,Byard R,Robinson T L,etal.Developing an integrated program for diagnosis and control of replant problems in New York apple orchards.New York Fruit Quarterly,2001,9:11-15.
[32]Wang L L,Shi J X,Yuan S F,etal.Control of tobacco bacterial wilt with biomanure plus soil amendments.Acta Pedologica Sinica,2013,50(1):150-156.
[33]Ruan W B,Wang J G,Zhang F S,etal.Effect of sterilization with CH3Br on root growth of soybean seedlings.Acta Ecologica Sinica,2001,21(5):759-764.
[34]Yuen G Y,Schroth M N,Weinhold A R,etal.Effects of soil fumigation with methyl bromide and chloropicrin on root health and yield of strawberry.Plant Disease,1991,75:416-420.
[35]Zhang S S,Yang X M,Mao Z S,etal.Effects of sterilization on growth of cucumber plants and soil microflora in a continuous mono-cropping soil.Acta Ecologica Sinica,2007,27(5):1809-1817.
[36]Marschner P,Rumberger A.Rapid changes in the rhizosphere bacterial community structure during re-colonization of sterilized soil.Biology and Fertility of Soils,2004,40(1):1-6.
[37]Noble R,Coventry E.Suppression of soil-borne diseases with compost:a review.Biocontorl Science and Technology,2005,15:3-20.
[38]Weller D M.Biological-control of soilborne plant-pathogens in the rhizosphere with bacteria.Annual Review of Phytopathology,1988,26:379-407.
[39]Cotxarrera L,Trillas-Gay M I,Steinberg C,etal.Use of sewage sludge compost andTrichodermaasperellumisolates to suppressFusariumwilt of tomato.Soil Biology and Biochemistry,2002,34:467-476.
[40]Hoitink H A J,Boehm M J.Biocontrol within the context of soil microbial communities:a substrate-dependent phenomenon.Annual Review of Phytopathology,1999,37:427-446.
[41]Gu L J,Xu B L,Liang Q L,etal.Impact and colonization ability ofTrichodermabiocontrol on lawn soil microflora.Acta Prataculturae Sinica,2013,22(3):321-326.
[42]Lang J J,Hu J,Ran W,etal.Control of cottonVerticilliumwilt and fungal diversity of rhizosphere soils by bio-organic fertilizer.Biology and Fertility of Soils,2012,48:191-203.
[43]Yamamoto T,Ultra Jr V U,Tanaka S,etal.Effects of methyl bromide fumigation,chloropicrin fumigation and steam sterilization on soil nitrogen dynamics and microbial properties in a pot culture experiment.Soil Science and Plant Nutrition,2008,54:886-894.
[3]沈宝云,刘星,王蒂,等.甘肃省中部沿黄灌区连作对马铃薯植株生理生态特性的影响.中国生态农业学报,2013,21(6):689-699.
[4]沈宝云,余斌,王文,等.腐植酸铵、有机肥、微生物肥配施在克服甘肃干旱地区马铃薯连作障碍上的应用研究.中国土壤与肥料,2011,(2):68-70.
[5]余斌,沈宝云,王文,等.连作障碍对干旱地区不同马铃薯品种的影响.甘肃农业大学学报,2012,47(4):43-47.
[14]李继平,李敏权,惠娜娜,等.马铃薯连作田土壤中主要病原真菌的种群动态变化规律.草业学报,2013,22(4):147-152.
[16]孟品品,刘星,邱慧珍,等.连作马铃薯根际土壤真菌种群结构及其生物效应.应用生态学报,2012,23(11):3079-3086.
[17]牛秀群,李金花,张俊莲,等.甘肃省干旱灌区连作马铃薯根际土壤中镰刀菌的变化.草业学报,2011,20(4):236-243.
[18]李瑞琴,刘星,邱慧珍,等.发生马铃薯立枯病土壤中立枯丝核菌的荧光定量PCR快速检测.草业学报,2013,22(5):136-144.
[19]李瑞琴,刘星,邱慧珍,等.连作马铃薯根际干腐病优势病原菌荧光定量PCR快速检测及在根际的动态变化.草业学报,2013,22(6):239-248.
[20]曹莉,秦舒浩,张俊莲,等.轮作豆科牧草对连作马铃薯田土壤微生物菌群及酶活性的影响.草业学报,2013,22(3):139-145.
[24]张瑞福,沈其荣.抑病型土壤的微生物区系特征及调控.南京农业大学学报,2012,35(5):125-132.
[28]李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008:395-412.
[29]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2008:112-113.
[32]王丽丽,石俊雄,袁赛飞,等.微生物有机肥结合土壤改良剂防治烟草青枯病.土壤学报,2013,50(1):150-156.
[33]阮维斌,王敬国,张福锁,等.溴甲烷土壤灭菌对大豆苗期根系生长的影响.生态学报,2001,21(5):759-764.
[35]张树生,杨兴明,茆泽圣,等.连作土灭菌对黄瓜生长和土壤微生物区系的影响.生态学报,2007,27(5):1809-1817.
[41]古丽君,徐秉良,梁巧兰,等.生防木霉对草坪土壤微生物区系的影响及定殖能力研究.草业学报,2013,22(3):321-326.
