不同干湿交替频率对芦苇生长和生理的影响
2015-01-02李晓宇刘兴土李秀军张继涛文波龙
李晓宇,刘兴土,李秀军,张继涛,文波龙
(中国科学院东北地理与农业生态研究所,中国科学院湿地生态与环境重点实验室,吉林 长春130102)
湿地是自然界生物多样性最富有的生态景观和人类最重要的生存环境之一。它具有环境调节、物种基因保护及资源利用、气候调节、净化水质等多项生态功能,被誉为“自然之肾”、“生物基因库”和“人类文明的摇篮”。近年来,由于受自然环境变化及人类活动干扰的影响,湿地面积在不断地减少,功能也在逐渐退化,甚至丧失。据统计,全世界已有53%的湿地消失[1]。我国湿地资源极其丰富,其面积位居世界第四位[2],但同时也面临着湿地面积锐减的问题,许多地区由于降水减少和蒸发量增大,湿地水位不断下降而退化萎缩[3]。例如,三江平原的洪泛湿地面积在过去的50年内已经下降了80%[4]。2004年第七届国际湿地会议提出,恢复和重建受损湿地是当前国际湿地科学的研究热点。合理恢复和重建具有多重功能的湿地,对改善生态环境也具有重要意义。
松嫩平原西部芦苇(Phragmitesaustralis)沼泽湿地属于半干旱半湿润气候,其降雨量低、蒸发量高是典型的气候特征,同时土壤盐碱化严重。因此水源的补给对芦苇湿地恢复是至关重要的因素。遵循“盐随水来,盐随水去”的特点[5],通过恢复地表径流,增加湿地水量进而淋洗盐碱成分,以达到改善湿地水土环境,增加生物多样性和增强湿地生态功能的目的。而目前国家经济发展需求以及粮食增产需要都离不开水资源以及引水工程,这些需求势必与湿地恢复的用水产生竞争,在平衡经济发展和湿地恢复重建的用水需求,节约湿地恢复用水是必要且重要的途径。
芦苇是重要的大型湿地植被,属于多年生根茎型禾本科植物。它是世界广布种,具有很强的生境适应性[6-7]。由于芦苇资源在提供造纸、编席、建房等原材料以及去除污染物、净化水质[8-9]、增加栖息地生物多样性[5]等方面发挥着重要的作用,因此备受国内外学者的关注。松嫩平原是中国内陆盐碱湿地分布较为集中的区域之一,各类盐碱湿地面积约160×104hm2[10],其中盐碱化芦苇湿地面积约30×104hm2[11-12]。盐碱化的芦苇湿地经过长期缺水退化演变为碱斑地,使湿地生态结构受到破坏,生态系统功能丧失。恢复盐碱芦苇湿地不仅可以提高湿地的面积率,还能阻止土壤盐碱化的进一步恶化。
许多研究从不同角度报道了芦苇对不同水文活动的响应和适应研究[13-29]。水文活动主要为地表积水[13]、淹水深度[14-15]、地下水埋深[16]、不同生境[17-18]等角度,研究表明芦苇对淹水和干旱条件均有一个最佳的生长水位值,分别为5~20cm的水层[19]和10cm的地下水埋深[16],超出这两个水位,对芦苇生长产生抑制作用。芦苇种群密度随着水位的增加而呈现先上升后下降趋势[20]。水文的微弱改变就可以导致湿地植被群落的明显改变[21],扎龙和向海湿地生境旱生化时,芦苇沼泽植被将向羊草(Leymuschinensis)草甸草原植被方向演替,湿生化过程中植被演替方向则相反[22]。以上研究多数集中在淡水湿地芦苇群落的分布格局、生态特征、对环境因子的响应等等[22],而关于内陆盐碱芦苇湿地的报道很少,也少有报道关于芦苇发育过程中分段补水的研究。基于松嫩平原西部盐碱湿地的气候、土壤和水文条件,本文在芦苇的不同发育期进行不同频率干湿交替,通过调查其生物量、光合生理、盐离子浓度变化来研究芦苇在不同频率干湿交替作用下的恢复生长能力和探讨退化芦苇湿地恢复的生态用水方法,寻找适当的生态补水关键期,可以达到节约用水并成功恢复芦苇种群生长的共同效果。
1 材料与方法
1.1 试验样地及材料
本研究所用芦苇选自松嫩平原西部牛心套保退化芦苇沼泽湿地。该芦苇场地理坐标为45°13′N,123°21′E,属中温带半干旱季风气候,平均降水量412.7mm,年平均蒸发量为1696.9mm,年总辐射量525.9 kJ/cm2,≥10℃年活动积温2921.3℃,无霜期平均为137d,土壤为盐化沼泽土和碱土。由于大气降水量少,蒸发量大,曾经退化为盐碱草地和碱斑地(2002年)。从2002年至2013年,该区已恢复了大面积退化的芦苇沼泽,主要通过霍林河和洮儿河引水补给。由于微地貌不同,该片湿地既有长期处于高水位的恢复芦苇湿地,也有仍旧处于长期缺水而退化的芦苇草甸。我们选择了保留在高地的退化芦苇斑块,2012年5月初,挖取20cm3见方的苇墩,以及下层的盐碱土,运回长春中国科学院东北地理与农业生态研究所,用于盆栽控制实验。
在中国科学院东北地理与农业生态研究所的实验园区的温室内,将盐碱土混匀后填入直径30cm,高35cm的硬塑桶内,在其上放置挖取的苇墩,再用盐碱土将空隙填满,最后土层厚度约为25cm。保证所有盆栽的重量一致。在所有盆栽装好后,灌地下水,帮助芦苇恢复生长。本实验持续两年,起始时间为每年的6月初至10月初。在实验结束后2012年测试了各处理的株高、地上生物量,地下的根茎及根保留过冬,第二年在芦苇返青后重复相同的实验处理,2013年测试地上和地下生物量、光合作用、株高和地上地下器官的盐离子含量。由于交替处理的影响,可能使芦苇的物候期发生改变,实验中将按照不同月份处理,来区分芦苇的生育期。
1.2 干湿交替设计
本研究设置4个试验组,共13项干湿处理,每项处理3次重复。所有处理中,湿润的标准为水位始终保持0~5cm;干旱标准为土壤含水量始终保持为田间持水量的35%~40%;淹水标准为水位始终保持高出土壤表面10cm。为避免雨水干扰,实验过程均在温室大棚内进行,并保持通风,与室外温度一致。
对照组A为无任何干湿交替作用(表1),生长季长期湿润(A1)、长期干旱(A2)、长期淹水(A3)。试验组B为1次干湿交替:在6月苗期(B1)、7月孕穗期(B2)、8月花期(B3)、9月灌浆期(B4)分别作为干旱和淹水的转换点。由干旱向淹水转换,转换后芦苇一直为淹水状态。试验组C为2次干湿交替:在苗期(C1)、孕穗期(C2)、花期(C3)、灌浆期(C4)分别淹水处理,其他生育阶段做干旱处理。试验组D为4次干湿交替:在苗期和花期淹水,孕穗期和灌浆期干旱(D1);在苗期和花期干旱,孕穗期和灌浆期淹水(D2)。在C组和D组,由于有湿向干转变的状态,我们利用针筒吸干实验桶内的水分,保证无水层积在土壤表层,而慢慢通过蒸发转变为干旱状态。

表1 干湿交替设计Table 1 Dry-wet alternation design
1.3 生长指标和生理指标测试
在生长季结束后(10月上旬),每个处理选取7~10棵芦苇个体,测量其绝对高度,即为株高。所有处理的芦苇进行收割,2012年取芦苇地上生物量,2013年取地上和地下生物量,反复用地下水冲洗地上和地下器官后于105℃杀青15min后在70℃恒温烘至恒重,并记录地上和地下的生物量。
在芦苇生长最旺盛的8月份,选取植物完全展开的新生叶片,利用L6400XT便携式光合仪(LI-6400XT,Li-Cor,Inc.,Lincoln,NE,USA)测试净光合速率、气孔导度、胞间CO2浓度和蒸腾速率等指标。每盆测3片,每个处理共测试9片。测试时间为上午9:00—11:00。本测试采用LED红蓝光源,模拟光强为1200μmol/(m2·s)。净光合速率、气孔导度、胞间CO2浓度和蒸腾速率的单位分别为μmol CO2/(m2·s),mmol H2O/(m2·s),μmol/mol和 mol H2O/(m2·s)[30]。
分别取各干样品100mg,用10mL去离子水沸水条件下浸提60min,浸提液用来测各种离子含量[30]。其中阳离子Na+、K+和 Mg2+采用原子吸收分光光度计(TAS-990,Purkinje General,北京)法测试;阴离子Cl-、H2PO4-和SO42-用离子色谱(DX-300)法测试。
1.4 统计分析
采用SPSS 13.0(SPSS Inc,Chicago,IL,USA)和Excel 2003对实验数据进行统计分析和作图,结果用平均数±标准误表示,应用单因素方差分析(ANOVA)和二因素方差分析分别对株高、生物量、光合数据和阴阳离子进行统计分析,采用最小显著差数法(LSD)和Tukey固定极差法分别进行多重比较,显著水平为0.05。
2 结果与分析
2.1 株高和生物量
干湿交替显著影响芦苇的株高(P<0.05)。在两年的测量数据中,干旱处理A2株高最低,并且在连续的干旱下,其2013年株高仅为28.82cm,比2012年降低了45.62%;A3最高,高于80cm,2013年略有降低,但不显著。由于盆栽的桶容积有限,因此各处理的芦苇生长比自然湿地条件下要低,但是不影响我们对不同干湿交替之间的芦苇生长的对比。其他B、C、D组的芦苇株高都未超过A3。B组中,补水时间随着芦苇发育阶段的推后,其株高呈现下降趋势。C组在2012年,7月份(C2)内淹水优于6月份(C1),2013年不同月份淹水则对株高没有显著影响。D组内,有D2比D1高的趋势,但不显著(图1)。
干湿交替显著影响芦苇的地上和地下器官的生物量(P<0.05)。2012年的处理中,A3地上生物量最高,但在2013年,D2的地上和地下生物量最高,地上地下生物量分别为30.8和52.8g。地上生物量为A1、A2、A3的1.8、10.3、2.4倍,地下生物量分别为A1、A2、A3的2.0、4.9、1.9倍,A2的生物量最低。B组,随着芦苇生育期发展,补水时间越滞后(图2),生物量积累越低,地上与地下趋势一致,B1的生物量高于B组其他。C组,干旱条件下,补水后生物量的积累呈先增加后降低趋势,最高值出现在7月份(C2),6、8和9月的地下生物量差别不大,8、9月地上生物量偏低。D组,D2芦苇的地上地下生物量显著高于D1。在D2处理中,6和8月份淹水处理能显著提高芦苇的生物量,高于其他各处理,分别比第二高生物量(B1)提高24.2%和28.2%。

图1 干湿交替作用下芦苇生长季末的株高Fig.1 Reed height at the end of growing season under dry-wet alternation

图2 干湿交替作用下芦苇生长季末的生物量Fig.2 Reed biomass at the end of growing season under dry-wet alternation
2.2 光合作用
由于8月份是芦苇的生长旺盛期,因此选择8月份的光合指标对比不同处理下,芦苇的光合能力差异,结果表明干湿交替显著影响芦苇的光合速率等指标(P<0.05)。
各处理间的光合速率具有显著的差异(图3)。A组中,A3具有最高的光合速率,A2最低,仅为A3的54.1%。B、C、D组的干湿交替处理,没有显著超过A3的光合速率,但是其中B2和D2的光合速率值与A3相似,具有较高的值。B组中,随着补水期延后,光合速率先增加后降低,B2即7月份补水具有最高的光合速率,比最低的B4高89.8%。我们可以推测,芦苇湿地由干旱胁迫到淹水胁迫的转换中,芦苇具有更高的光合能力,即在退化芦苇进行补水恢复后,芦苇比较容易恢复生长,其光合速率值高于单一的干旱胁迫A2。C组C2光合最高,比最低的C4高96.5%。D组光合值与株高和生物量相似,D2高于D1,约74.0%。

图3 干湿交替作用下芦苇的光合速率、气孔导度、胞间CO2浓度和蒸腾速率Fig.3 Photosynthesis(Pn),stomatal conductance(gs),intercellular CO2concentration(Ci)and transpiration rate(E)of reeds under dry-wet alternation
A、B、C、D各组气孔导度和蒸腾速率的数值与光合速率具有完全一致的变化趋势,即A组A2的值最低,B组B2最高,C组C2最高,D组D2最高。但不同的是B2、C2、D2的值高于A3。随着补水时间的推后,光合速率、气孔导度和蒸腾速率呈先增加后降低趋势,表明7月份的补水促使芦苇在生长旺盛期具有最高的光合能力。胞间CO2则无显著的规则性趋势(图3)。
2.3 离子含量
二因素方差分析结果显示,干湿交替和器官对Na+、K+和NO3-均有显著性影响,而对 Mg2+、H2PO4-和Cl-的影响无显著性(表2)。

表2 芦苇离子含量的二因素方差分析检验表Table 2 Two factors analytical study of ions in reed
A组,A2芦苇地上器官的Na+含量低于A1和A3,地上器官则相反。B组,随着淹水时间推后,地上器官Na+含量增加,B1的Na+最低,这与生物量和株高趋势相反;地下器官的Na+无显著规律性变化。C组地上器官的Na+含量也大致呈增加趋势,在生长后期补水,地上器官的Na+含量是早期补水的2倍,其中C2的Na+最低,与C组的株高和生物量变化趋势也相反。同样地下器官的Na+有增加趋势。D组,D2的Na+含量比D1高,地下器官无显著差别。4组中,D组无论地上或者地下器官其Na+含量最低,B和C组高于A和D组(表3)。
在所有干湿交替处理中,芦苇地上器官和地下器官的K+和NO3-无显著差别(D组除外)。D组的K+和NO3-含量较低,在4组处理中,1次干湿交替的B组K+含量最高,A组NO3-含量较高。
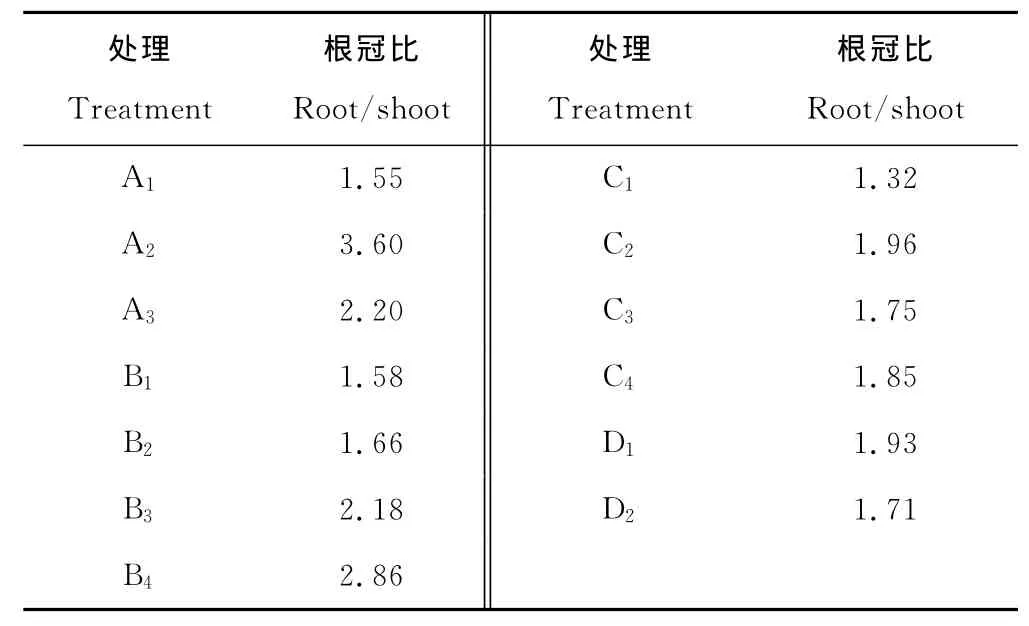
表4 各干湿交替处理下的芦苇生物量的根冠比Table 4 Root-shoot biomass ratio of reed under different dry-wet alternations
3 讨论
水位变化对植物种群生物量及其分配的影响与物种有关[24-25],各物种在其最适宜的水位下或者水文条件下生长,会获得最佳生物量。在芦苇整个生长季湿润或者淹水条件均比干旱条件下具有显著增加的株高和生物量,这一结论符合芦苇在地上水层为5~20cm区间时具有最佳生物量的结果[19]。而分段式的干湿交替补水,显著影响着芦苇的生长和生物量积累。其中芦苇生长前期(6-8月)10cm的水层可显著提高芦苇的生物量(B1、C2、D2)。其中以多频次C2和D2为佳,用水量仅为B1的1/5和2/5。这说明退化芦苇湿地恢复,补水要“靠前”(芦苇生长发育前期)。
退化盐碱芦苇湿地的恢复是一个复杂的生态和生理过程,尤其是芦苇的生长恢复。退化的芦苇种群遭受干旱胁迫以及盐碱胁迫的共同影响。湿地恢复势必要具有一定水层,使植物处于淹水状态,因此芦苇将由干旱-盐碱胁迫转为淹水胁迫。干旱胁迫致使高等植物的解剖结构、形态和生理均发生改变,使其形成一定的耐旱策略。例如增加根系的生长,提高根冠比例来适应干旱环境[23]。在芦苇生长后期补水,芦苇便遭受了更长久的干旱胁迫,根冠比值随着补水时间的推后而增加(表4,B组),即芦苇在恢复水源补给后,根冠比显著降低。
受到干旱胁迫的植物,通常叶片发生角质化,形成脂质层,降低叶片水势、渗透势和气孔导度,来减少蒸腾散失[26-27]。在不同干湿频率的补水处理中,B组和C组的光合指标均有先增加后降低趋势,说明芦苇在短期干旱胁迫后补水具有显著提高光合的作用。但随着干旱时间的延长,其光合能力显著下降(图3)。长期淹水的A3芦苇净光合速率最高。B2、C2、D2其光合能力与A3相似,气孔导度和蒸腾速率显著高于A3,表明这些频率的干湿交替处理,能显著提高芦苇的光合能力。
受到干旱胁迫的植物会积累无机离子以及小分子有机物参与渗透调节[28],有效维持细胞膨压,提高植物的耐旱性,也利于植物存活和生长[29]。盐碱芦苇湿地在干旱状态下,具有干旱和盐双重胁迫,随着干旱胁迫时间的延长,Na+积累越多。反之,在芦苇生长初期补水,解除干旱胁迫,Na+积累较少。D组是由于该组为4次干湿交替,即2次补水,2次排水处理,Na+随着排水排出,D组有盐离子流失,也有营养盐的流失,如NO3-。长时间淹水,无排水的如A3,相对NO3-含量较高。在水分条件充足下,芦苇地上器官积累的Na+多于地下器官。在干旱条件A2,其地下器官积累更多的Na+,这与多年生牧草羊草在盐碱条件的Na+分配相一致,也与作者对退化湿地芦苇的Na+分配结果一致[30],羊草与芦苇在盐碱或者干旱条件下均将Na+积累至地下器官,以减少地上器官受损[31]。而芦苇在水分补给后,单位质量地上器官的Na+含量高于地下器官,不同于作者对年际连续补水后芦苇的盐离子分布的研究结果(单位质量的地上器官和地下器官Na+含量无显著差别)[30],关于芦苇个体的盐离子代谢有待于进一步研究。
长期淹水胁迫后再暴露于干旱胁迫中,或者受到长期干旱胁迫再暴露于淹水环境中,这种水位大幅度改变对植物生长的抑制比单一的持续干旱和持续淹水影响更严重。如蒲柳(Salixgracilistyla)受到干旱和淹水周期性交替影响,这种“干湿”交替未能缓解长期淹水或者干旱胁迫的影响,相反,水位的大幅变化增加了胁迫对根的负向影响,如果干旱和淹水期足够长,淹水导致渗透调节不足,致使干旱胁迫伤害程度的增加[32]。由于退化芦苇湿地在生长季内不同时段补水,芦苇生长季内干湿交替的频率越多,芦苇受干旱或者淹水单次胁迫的时间越少。芦苇分段式的干湿交替处理,缓解了干旱胁迫对芦苇的影响。
4 结论
在芦苇干旱胁迫至其生长后期,芦苇可迅速积累盐离子,此时补水促进盐离子的进一步吸收,尤其是地上器官对盐离子的吸收。在退化的芦苇草甸,在8、9月份灌水后,收割芦苇地上生物量,反复几年,可能减少盐碱地中Na+的含量。
无论是1、2、4次干湿交替,均可有效提高芦苇的生长和生理功能。在芦苇受到干旱胁迫时,又面临水资源的短缺,那么阶段式补水便是最好的解决方式。采用干湿交替的用水方法,可以有效地节约水源,同时满足芦苇的用水需求,增加其生物量、光合能力,减少其体内盐离子含量,有利于芦苇的高产高质培育。
Reference:
[1]Mitsch W J,Gosselink J G.Wetlands[M].New York:John Wiley and Sons,2000.
[2]Zhao K Y.Chinese Marshes[M].Beijing:Science Press,1999.
[3]Liu X T.Northeast Wetlands[M].Beijing:Science Press,2005.
[4]Liu H Y,Zhang S K,Lu X G.Wetland landscape structure and the spatial-temporal changes in 50years in the Sanjiang Plain.Acta Geographica Sinica,2004,59(3):391-400.
[5]Yang F Y,Li X J,Liu X T,etal.Recovery pattern of degraded saline-alkali reed wetland in the Songnen Plain.Wetland Science,2009,7(4):306-313.
[6]Ruzi M,Velasco J.Nutrient bioaccumulation inPhragmitesaustralis:Management tool for reduction of pollution in the Mar Menor.Water,Air and Soil Pollution,2010,205:173-185.
[7]Zhang Y,Zheng X L,Wu C C,etal.Simulation experimental about transpiration characteristics ofPhragmitesaustralisleaf in Liaohe estuary wetlands.Wetland Science,2011,9(3):227-232.
[8]Baldatoni D,Altoni A,Di Tomamasi P,etal.Assessment of macro and microelement accumulation capability of two aquatic plants.Environmental Pollution,2003,130:149-156.
[9]Kiedrzynska E,Wagner I,Zalewski M.Quantification of phosphorus retention efficiency by floodplain vegetation and a management strategy for a eutrophic reservoir restoration.Ecological Engineering,2008,33:127-131.
[10]Line R,Suzanne C,Jean L B.Does prolonged flooding prevent or enhance regeneration and growth ofSphagnum.Aquatic Botany,2002,74(4):327-341.
[11]Chen M,Zhang S Q,Fu X Y,etal.Study on changes of the wetlands in west of Jilin Province.Journal of Arid Land Resources and Environment,2006,20(5):21-24.
[12]Sun F D,Wang Y,Shi Y Q,etal.Protection and development of wetlands in Heilongjiang Province.Territory and Natural Resource Study,2004,1:44-45.
[13]Li D L,Zhang J L,Pan W M,etal.Effects of surface water accumulation on morphological structure and biomass ofPhragmitesaustralis.Journal of Jiangsu Forestry Science and Technology,2009,36(3):17-20.
[14]Vretare V,Weisner S E B,Strand J A,etal.Phenotypic plasticity inPhragmitesaustralisas a functional response to water depth.Aquatic Botany,2010,69(2,4):263-274.
[15]Engloner A I.Annual growth dynamics and morphological differences of reed(Phragmitesaustralis[Cav.]Trin.ex Steudel)in relation of water supply.Flora,2004,199(3):515-523.
[16]Su F L,Zhang X Y,Guo C J,etal.The response mechanism of groundwater depth and reed growth.Journal of Irrigation and Drainage,2010,29(6):129-132.
[17]Chen G C,Zhang C L.Comparative studies on morphological character and anatomical structure of fibre in stalk of four distinct types ofPhragmitesCommunis Trin.Journal of Lanzhou University(Natural Sciences),1991,27(1):91-98.
[18]Zhang Y M,Liu X T,Sun C Z,etal.Study on ecological anatomy of vegetative organs ofPhragmitesaustralisin Sanjiang Plain.Journal of Jilin Agricultural University,2003,25(2):161-163.
[19]Zhuang Y,Sun Y X,Wang Z S,etal.Research advances in ecotypes ofPhragmitesaustralis.Acta Ecologica Sinica,2010,30(8):2173-2181.
[20]Cui B S,Zhao X S,Yang Z F,etal.The response of reed community to the environment gradient of water depth in the Yellow River delta.Acta Ecologica Sinica,2006,26(5):1533-1640.
[21]Bu Z J,Tian X.Effects of artificial water-supply on vegetation in Zhalong floodplain wetland.Wetland Science and Management,2007,3(4):44-48.
[22]Tian X,Bu Z J,Yang Y F,etal.Response of the wetland vegetation to dry-wet alternation habitat in the Songnen Plain of China.Wetland Science,2004,2(2):123-127.
[23]Nicholas S.Plant resistance to environmental stress.Current Opinion Biotechnology,1998,9:214-219.
[24]Wang L,Hu J M,Song C C,etal.Effects of water level on the rhizomatic germination and growth of typical wetland plants in Sanjiang Plain.Chinese Journal of Applied Ecology,2007,18(11):2432-2437.
[25]Wang H Y,Chen J K,Zhou J.Influence of water level gradient on plant growth,reproduction and biomass allocation of wetland plant species.Acta Phytoecologica Sinica,1999,23(3):269-274.
[26]Parolin P,Lucas C,Piedade F M T,etal.Drought responses of flood-tolerant trees in Amazonian floodplains.Annals of Botany,2010,105:129-139.
[27]Almeida-Rodriguez A M,Cooke J E K,Yeh F,etal.Functional characterization of drought-responsive aquaporins inPopulusbalsamiferaand populus simonii×balsamifera clones with different drought resistance strategies.Physiologia Plantarum,2010,140:321-333.
[28]Shao H B,Chu L Y,Jaleel C A,etal.Water-deficit stress-induced anatomical changes in higher plants.Plant Biology and Pathology,2008,331:215-225.
[29]Li C,Berninger F,Koskela J,etal.Drought responses ofEucalyptusmicrothecaF.Muell.Provenances depend on seasonality of rainfall in their place of origin.Australian Journal of Plant Physiology,2000,27:231-238.
[30]Li X Y,Liu X T,Li X J,etal.Growth and physiological response of organs ofPhragmitesaustralisto different water compensation in degraded wetlands.Wetland Science,2012,10(1):23-31.
[31]Li X Y,Lin J X,Li X J,etal.Growth adaptation and Na+and K+metabolism responses ofLeymuschinensisseedlings under salt and alkali stresses.Acta Prataculturae Sinica,2013,22(1):201-209.
[32]Nakai A,Yurugi Y,Kisanuki H.Stress response inSalixgracilistylacutting subjected to repetitive alternate flooding and drought.Trees,2010,24:1087-1095.
[2]赵魁义.中国沼泽志[M].北京:科学出版社,1999.
[3]刘兴土.东北湿地[M].北京:科学出版社,2005.
[5]杨富亿,李秀军,刘兴土,等.松嫩平原退化芦苇湿地恢复模式.湿地科学,2009,7(4):306-313.
[7]张颖,郑西来,伍成成,等.辽河口湿地芦苇叶片蒸腾及其与影响因子关系研究.湿地科学,2011,9(3):227-232.
[11]陈铭,张树清,傅晓阳,等.吉林省西部湿地资源动态变化研究.干旱区资源与环境,2006,20(5):21-24.
[12]孙法德,王勇,石义强,等.黑龙江省的湿地保护与开发利用.国土与自然资源研究,2004,1:44-45.
[13]李冬林,张纪林,潘伟明,等.地表积水状况对芦苇形态结构及生物量的影响.江苏林业科技,2009,36(3):17-20.
[16]苏芳莉,张潇予,郭成久,等.地下水埋深与芦苇生长的响应机制研究.灌溉排水学报,2010,29(6):129-132.
[17]陈国仓,张承烈.不同生境芦苇形态特征和茎秆解剖结构的比较研究.兰州大学学报(自然科学学报版),1991,27(1):91-98.
[18]张友民,刘兴土,孙长占,等.三江平原芦苇营养器官的生态解剖学研究.吉林农业大学学报,2003,25(2):161-163.
[19]庄瑶,孙一香,王中生,等.芦苇生态型研究进展.生态学报,2010,30(8):2173-2181.
[20]崔保山,赵欣胜,杨志峰,等.黄河三角洲芦苇种群特征对水深环境梯度的响应.生态学报,2006,26(5):1533-1640.
[21]卜兆君,田讯.人为补水对扎龙河漫滩湿地植被的影响.湿地科学与管理,2007,3(4):44-48.
[22]田讯,卜兆君,杨允菲,等.松嫩平原湿地植被对生境干-湿交替的响应.湿地科学,2004,2(2):123-127.
[24]王丽,胡金明,宋长春,等.水位梯度对三江平原典型湿地植物根茎萌发及生长的影响.应用生态学报,2007,18(11):2432-2437.
[25]王海洋,陈家宽,周进.水位梯度对湿地植物生长,繁殖和生物量分配的影响.生态学报,1999,23(3):269-274.
[31]李晓宇,蔺吉祥,李秀军,等.羊草苗期对盐碱胁迫的生长适应及Na+、K+代谢响应.草业学报,2013,22(1):201-209.
