一步法SYBR Green实时定量RT-PCR检测坦布苏病毒方法的建立
2015-01-01刘青涛赵冬敏刘宇卓黄欣梅韩凯凯安凤娇
刘青涛, 李 银, 赵冬敏, 刘宇卓, 黄欣梅, 杨 婧, 韩凯凯, 安凤娇
(江苏省农业科学院兽医研究所/农业部动物疫病诊断与免疫重点开放实验室/国家兽用生物制品工程技术研究中心,江苏南京210014)
坦布苏病毒(Tembusu Virus,TMUV)为单股正链RNA病毒,属于黄病毒科(Flaviviridae),黄病毒属(Flavivirus),恩塔亚病毒群(Ntaya virus group),该病毒于1955年首次分离于马来西亚吉隆坡地区的库蚊,随后又在马来西亚其他地区和泰国的库蚊中分离到[1-3]。2000年,在马来西亚霹雳州实兆远地区的患病肉鸡中分离到TMUV,这是首次发现TMUV对家禽的致病性[4]。2010年春季,在中国东部省份主要养鸭地区的鸭群中暴发了由TMUV引起的疫情,主要表现为种鸭、蛋鸭釆食量和产蛋率迅速下降,肉鸭拉稀,出现神经症状和死亡,此次疫情一直持续到2010年冬季[5-7]。2011年10月,在江苏、山东、河南等地再次出现鸭坦布苏病毒病的流行,一直持续到2012年3月。2012年9月,江苏、山东等地再次发生鸭坦布苏病毒病[8]。目前坦布苏病毒病作为鸭的一种常见病,给中国养鸭业造成了巨大经济损失。据不完全统计,鸭坦布苏病毒病仅2010年造成的经济损失就达数十亿元。此外,TMUV还可以引起鸡和鹅的感染和发病[9-10],并且在人的血清中也检测到TMUV的核酸和抗体[11],不排除TMUV有人畜共患的风险。
实时定量PCR是近年来发展起来的一种新型诊断技术,在各种疾病特别是传染性疾病的快速诊断中发挥了重要作用。常规PCR通过PCR产物的琼脂糖凝胶电泳判定结果,而实时定量PCR是通过添加的荧光染料或荧光标记探针在PCR过程中实时收集检测信号,根据机器收集的荧光信号强度进行结果的判定,减少了试验污染和环境污染。因此,与常规PCR相比,实时定量PCR的敏感性更高,检测速度更快,并且更环保。国内学者根据TMUV基因的不同区域建立了多种用于TMUV检测的实时定量RT-PCR,于春梅等建立了基于TMUV NS5、E基因的SYBR GreenⅠ实时定量RT-PCR方法[12],万春和等根据TMUV的NS5基因设计引物建立了SYBR GreenⅠ实时定量 RT-PCR 方法[13],彭珊和靳宇田等分别根据TMUV的E基因和PrM基因设计引物和探针建立了TaqMan实时定量RT-PCR方法[14-15],以上方法均具有很好的特异性和敏感性,为鸭坦布苏病毒病的临床病原学诊断提供了检测手段。但是,以上实时定量RT-PCR均采用两步法,即在提取样品的RNA后首先进行反转录,然后再以转录产物为模板进行实时定量PCR方法测定,操作比较繁琐,增加了试验过程中的操作误差和样品被污染的几率。而本研究针对TMUV基因的保守区域设计了1对特异性引物,利用体外转录的TMUV病毒的NS2A基因作为标准品制作标准曲线,建立了TMUV的一步法SYBR Green实时定量RT-PCR检测方法。与两步法相比,本方法操作简单,检测快速,减少了试验过程中的操作误差和样品被污染的几率,为TMUV的快速诊断和流行病学研究提供有效的技术手段。
1 材料与方法
1.1 试验材料
坦布苏病毒(TMUV)、新城疫病毒(NDV)、H9N2禽流感病毒(H9N2 AIV)、鸭肝炎病毒(DHV)、鸭瘟病毒(DPV)、小鹅瘟病毒(GPV)、减蛋综合征病毒(EDSV)、猪瘟病毒(CSFV)均由江苏省农业科学院兽医研究所分离并保存。1日龄樱桃谷鸭购自南京市六合区,养至21日龄用于攻毒。
1.2 仪器和试剂
RNA/DNA和质粒提取试剂盒购自康宁公司,T7体外转录试剂盒购自百奥迈科生物技术有限公司,反转录试剂盒、One Step RT-PCR Kit购自宝生物工程(大连)有限公司,ABI 7500 Real-Time PCR System购自美国Applied Biosystems公司。
1.3 引物设计与合成
根据本实验室分离的病毒株以及GenBank登录的TMUV全基因核苷酸序列,采用DNAStar软件进行同源性分析,选出高度保守并且特异的核苷酸区域,用Primer Ex-press 2.0软件设计1对检测引物,其序列为 D1:5'-GCAGCCCAGGAGATTTTGAG-3'和 D2:5'-CTAACGCAACGCCAAGCA-3',扩增片段大小为280 bp。另外,设计1对克隆引物将NS2A基因连接到pcDNA3.1(+)载体中,其序列为C1:5'-GGTCGGATCCTTTCAAGGGG-3'和C2:5'-CTGGTCTAGATCTCCGTGTCACTGG-3'。
1.4 病毒核酸的提取
按照试剂盒说明进行病毒核酸的提取,以提取的核酸为模板直接进行一步法SYBR Green实时定量RT-PCR检测。
1.5 标准品的制备
将提取的TMUV核酸按照试剂盒说明进行反转录,以转录产物为模板用引物C1和C2 PCR扩增TMUV的 NS2A基因,然后将扩增基因片断用BamH I和 Xba I进行双酶切,连接到 pcDNA3.1(+)载体中,经测序正确后用于体外转录,并命名为pcDNA-NS2A。
将质粒pcDNA-NS2A经Xba I单酶切进行线性化,然后按照试剂盒的说明进行体外转录,将体外转录产物用RNA提取试剂盒纯化后,进行浓度测定、拷贝数计算、稀释、分装,-70℃保存备用。
1.6 敏感性试验和标准曲线的建立
将体外转录制备的标准品进行10倍系列稀释(1 μl 1×100~1×107拷贝)作为模板进行实时定量RT-PCR扩增,以检测出的最低拷贝数作为该方法的灵敏度,并与常规RT-PCR检测方法进行比较,同时根据测定结果绘制标准曲线。实时定量RT-PCR的扩增体系为:2 ×Buffer 10 μl,酶 0.8 μl,引物 D1(10 μmol/L)0.8 μl,引物 D2(10 μmol/L)0.8 μl,ROX Reference DyeII 0.4 μl,RNA 1 μl,H2O 6.2 μl。扩增程序为:42℃ 5 min,95 ℃ 10 s;95 ℃ 15 s,60 ℃ 34 s,40个循环,以3~15个循环数的荧光值作为基底值。
1.7 特异性试验
用建立的一步法SYBR Green实时定量RT-PCR方法分别对 NDV、H9N2 AIV、DHV、DPV、GPV、EDSV、CSFV进行检测,以TMUV为阳性对照,以灭菌超纯水为阴性对照,评价所建立方法的特异性。
1.8 重复性试验
用建立的一步法SYBR Green实时定量RT-PCR方法对不同拷贝数的标准品进行3次定量测定,对结果进行统计分析,计算批内及批间的变异系数,验证所建立方法的重复性。
1.9 对TMUV攻毒样品的检测
取TMUV 0.2 ml[病毒含量为0.1 ml 1×105.7(鸡胚半致死量)]肌肉注射3只21日龄樱桃谷鸭,每只106[鸡胚半致死量(ELD50)],攻毒后1 d、3 d、5 d、7 d、10 d、15 d、21 d 每天采集攻毒鸭的泄殖腔拭子,反复冻融3次后提取RNA,分别用一步法SYBR Green实时定量RT-PCR方法和常规PCR方法进行检测,同时设不攻毒的鸭为对照,比较2种方法的检出率。
2 结果
2.1 敏感性试验及标准曲线的建立
标准品(1 μl 1×100~1×107拷贝)的检测结果显示,建立的一步法SYBR Green实时定量RTPCR的检测底限为1 μl 10拷贝(图1),而常规RT-PCR 的检测底限为 1 μl 1×103拷贝(图 2)。根据标准品拷贝数与Ct值进行标准曲线(图3)绘制,标准曲线的决定系数为0.997,扩增效率(Eff)为99.441%,说明所建立的标准曲线具有良好的线性关系和扩增效率。此外,由熔解曲线(图4)可见,各扩增样品均为单一峰,无非特异性产物。以上结果说明,所建立的方法可以对大于等于1 μl 10拷贝的样品进行精确定量。
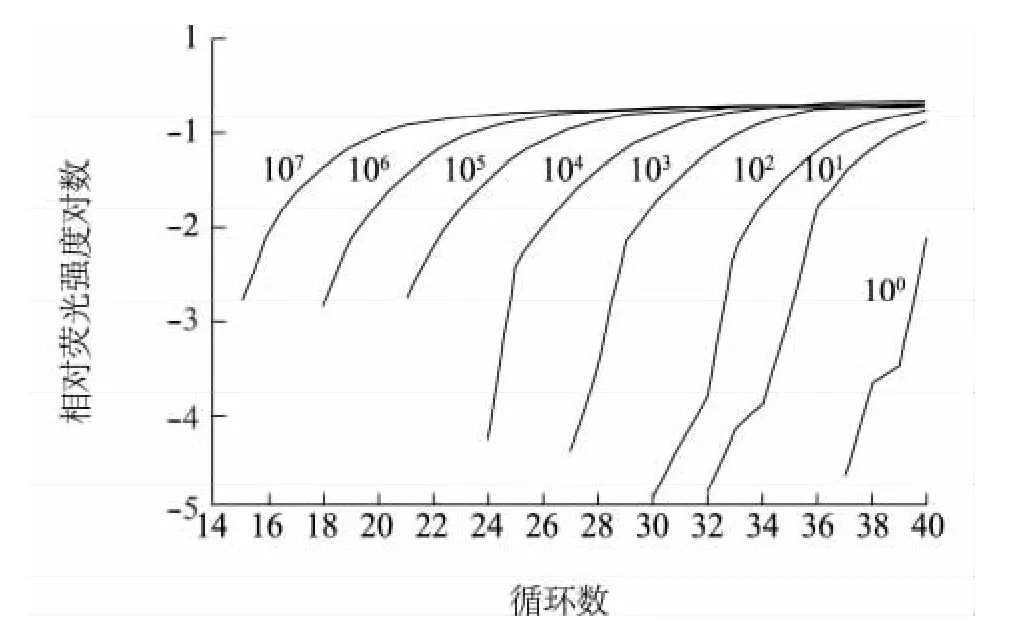
图1 扩增曲线Fig.1 Amplification plot

图2 常规PCR敏感性试验Fig.2 Sensitivity of the conventional RT-PCR
DL2000:Marker;100、101、102、103、104、105、106、107为模板稀释浓度。
2.2 特异性试验结果
一步法SYBR Green实时定量RT-PCR方法对NDV、H9N2 AIV、DHV、DPV、GPV、EDSV、CSFV 和灭菌超纯水的检测结果均为阴性,而对TMUV的检测结果为阳性(图5),这说明所建立的方法具有良好的特异性。

图3 标准曲线Fig.3 Standard curve

图4 溶解曲线Fig.4 Melt curve

图5 特异性试验Fig.5 Specificity test
2.3 重复性试验结果
由表1可知,各样品的批内变异系数为0.11%~0.30%,批间变异系数为 0.88%~1.31%,说明所建立的方法重复性良好。
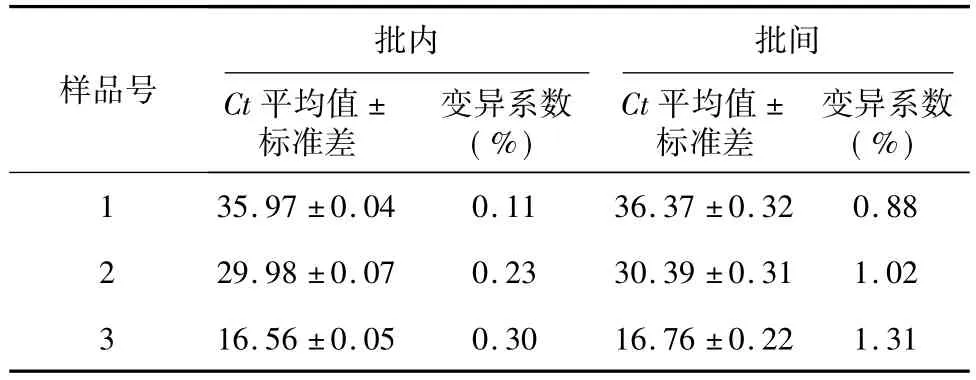
表1 重复性试验结果Table 1 Reproducibility test
2.4 对TMUV攻毒样品的检测
由TMUV攻毒鸭泄殖腔棉拭子的检测结果(表2)显示,常规RT-PCR在攻毒后1 d,只从1只鸭的拭子中检测到TMUV,21 d时已检测不出TMUV;而一步法SYBR Green实时定量RT-PCR在攻毒后1 d到21 d在所有攻毒鸭的泄殖腔拭子中均检测到了TMUV,其阳性检出率为100%,而常规RT-PCR的阳性检出率为71%。以上结果进一步说明本研究建立的TMUV检测方法的敏感性远远高于常规RTPCR检测方法。此外,2种方法对对照鸭的检测结果均为阴性。
3 讨论
由于集约化养殖模式的发展,鸭的养殖密度越来越大,发病情况也越来越复杂,往往是几种病原(包括新出现的病原)共同感染或者继发感染发病,给疾病的诊断和处置造成了困难。2010年以来,鸭坦布苏病毒病在中国已经发生了3次较大规模的流行,目前该病在中国已成为鸭的一种常见病[5-8]。鸭坦布苏病毒病作为一种新发疫病,因临床症状不特异而难以诊断,因此迫切需要建立一种快速、准确的病原检测方法来对该病进行实验室诊断。
本研究以TMUV基因的保守区为靶点设计1对特异引物,建立了一步法SYBR Green实时定量RTPCR检测方法,并且对该方法的扩增曲线、标准曲线、溶解曲线、敏感性、特异性和重复性进行了分析和验证。结果表明,所建立的实时定量RT-PCR方法标准曲线的线性关系良好;对TMUV的最低检测量达到1 μl 10拷贝,灵敏度是常规RT-PCR检测方法的100倍;溶解曲线呈单一峰,并且只能检测出TMUV,与其他病原无交叉反应,具有良好的特异性;批内和批间变异系数较小,具有良好的重复性。利用建立的荧光定量RT-PCR方法和常规RT-PCR方法对不攻毒对照鸭和TMUV感染鸭的泄殖腔棉拭子进行了检测,结果表明2种方法对于对照鸭的检测结果均为阴性;而对于攻毒鸭一步法SYBR Green实时定量RT-PCR法检测出TMUV的阳性率为100%,比常规RT-PCR方法高出29个百分点。因此,与常规RT-PCR方法相比,我们建立的一步法SYBR Green实时定量RT-PCR方法检测速度更快、更敏感,更适合于临床样品的检测。

表2 TMUV攻毒鸭泄殖腔棉拭子测定结果Table 2 Detection of TMUV in cloacal swabs from TMUV infected ducks
本研究建立的一步法SYBR Green实时定量RT-PCR方法为坦布苏病毒病的实验室诊断提供了一种快速有效的方法,也为开展坦布苏病毒病的流行病学调查提供了技术手段。
[1] PLATT G S,WAY H J,BOWEN E T,et al.Arbovirus infections in Sarawak,October 1968-February 1970 Tembusu and Sindbis virus isolations from mosquitoes [J].Ann Trop Med Parasitol,1975,69(1):65-71.
[2] 张敬峰,李 银,赵冬敏,等.鸭源坦布苏病毒株NJX-4的分离鉴定及部分生物学特性[J].江苏农业科学,2013,41(11):228-229,297.
[3] 韩凯凯,李 银,黄欣梅,等.鹅新型坦布苏病毒囊膜蛋白的二级结构与B细胞表位预测[J].江苏农业科学,2014,42(6):166-169.
[4] KONO Y,TSUKAMOTO K,ABD HAMID M,et al.Encephalitis and retarded growth of chicks caused by Sitiawan virus,a new isolate belonging to the genus Flavivirus[J].Am J Trop Med Hyg,2000,63:94-101.
[5] 曹贞贞,张 存,黄 瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010(12):3-6.
[6] LIU P P,LU H,LI S,et al.Genomic and antigenic characterization of the newly emerging Chinese duck egg-drop syndrome flavivirus:genomic comparison with Tembusu and Sitiawan viruses[J].J Gen Virol,2012,93:2158-2170.
[7] 胡旭东,路 浩,刘培培,等.我国发现的一种引起鸭产蛋下降综合征的新型黄病毒[J].中国兽医杂志,2011,47(7):43-47.
[8] 刘志刚,孙青松,姚 蓉,等.鸭坦布苏病毒研究进展[J].中国动物传染病学报,2013,21(1):81-86.
[9] 黄欣梅,李 银,赵冬敏,等.新型鹅黄病毒JS804毒株的分离与鉴定[J].江苏农业学报,2010,27(2):354-360.
[10] LIU M,CHEN S,CHEN Y,et al.Adapted tembusu-like virus in chickens and geese in China [J].J Clin Microbiol,2012,50(8):2807-2809.
[11] TANG Y,GAO X,DAO Y,et al.Tembusu virus in Human,China[J].Transboundaiy and Emerging Diseases,2013,60:193-196.
[12]于春梅,刁有祥,唐 熠,等.坦布苏病毒荧光定量RT-PCR方法的建立[J].中国农业科学,2012,45(21):4492-4500.
[13]万春和,朱海侠,施少华,等.鸭坦布苏病毒SYBR Green I实时荧光定量检测方法的建立[J].中国兽医学报,2013,33(7):973-978.
[14]彭 珊,闫丽萍,李国新,等.鸭坦布苏病毒TaqMan荧光定量PCR方法的优化[J].中国预防兽医学报,2013,35(4):294-298.
[15]靳宇田,黄显明,许秀梅,等.鸭坦布苏病毒实时荧光定量RTPCR检测方法的建立及应用[J].中国动物传染病学报,2013,21(4):46-50.
