抗猪瘟病毒单链抗体基因的构建及其推导的蛋白质三级结构的分子模拟
2015-01-01刘金凤吴健敏覃绍敏白安斌陈凤莲曹颖颖
刘金凤, 吴健敏, 覃绍敏, 白安斌, 陈凤莲, 曹颖颖
(广西壮族自治区兽医研究所,广西 南宁 530001)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种以高热、出血及高死亡率为特征的接触性烈性传染病,在世界范围内广泛流行,一旦暴发将会对当地养猪业造成毁灭性的打击,已成为危害全球养猪生产的重要经济性疫病之一[1-4]。在中国,虽然依靠兔化弱毒疫苗免疫,较好地控制了猪瘟的大规模流行,但零散发生仍然存在,并且发病特点发生了变化。为此,对猪瘟的防治依旧面临着严峻的挑战,而在猪瘟的综合防治中,如何快速、准确诊断具有非常重要意义。
免疫学检测是病原微生物诊断的主要手段,其关键技术在于获得高效的可用于检测的抗体。目前,以单链抗体为代表的基因重组抗体技术为抗体的制备提供了新途径。单链抗体(ScFv)是由免疫球蛋白质的重链可变区(VH)和轻链可变区(VL)通过一段连接肽连接形成的单一肽链重组蛋白质,它具有完全抗原结合位点的最小抗体片段,分子量小、渗透性高,特异性强,而且抗体的亲和力和特异性在制备过程中均能较为容易控制,因此在免疫学检测与医学诊断中具有重要的应用价值和广泛的应用前景[5-7]。本研究在获得分泌抗猪瘟病毒单克隆抗体的杂交瘤细胞株的基础上,利用基因工程方法扩增了抗体可变区基因VH和VL,组装成单链抗体基因(CSFV-ScFv),并进行克隆和测序鉴定,同时利用计算机软件对CSFV-ScFv基因及其所编码蛋白质的性质进行详尽分析,为进一步建立以单链抗体技术为支撑的CSFV病原快速检测方法奠定基础。
1 材料与方法
1.1 材料
抗CSFV单克隆抗体杂交瘤细胞株anti-CSFV14[8]、大肠杆菌DH5α感受态细胞由广西兽医研究所诊治中心实验室制备与保存;pMD18-T载体、DNA marker、限制性内切酶、RevertAidM-MuLV Reverse Transcriptase、pfu 聚合酶、Ex Taq DNA Master Mix、RNase抑制剂购自 TaKaRa公司,质粒提取试剂盒、DNA纯化试剂盒购自北京天根生物公司,TRIzol试剂购自Invitrogen公司,酵母抽提物及胰蛋白胨购自OXID公司,其他生化试剂均为国产分析纯级产品。
1.2 引物及Linker设计
参照文献[9]设计鼠源抗体重链及轻链可变区的扩增引物,连 接 肽Linker采用文献[10]报道的较常用的(Gly4Ser)3形式;将Linker设计在VH基因的下游引物和VL基因的上游引物,并分别在两端引入酶切位点BamH I和Not I,序列由北京博迈德基因有限公司合成,具体如表1。

表1 CSFV-ScFv基因引物序列Table 1 The primer sequences of CSFV-ScFv gene
1.3 杂交瘤细胞总RNA提取及cDNA合成
PRRSV杂交瘤细胞株anti-CSFV14复苏培养,待细胞长至对数生长期,细胞计数约8×107时,1 200 r/min离心3~5 min收集细胞,在无RNA酶的条件下按 TRIzol试剂盒操作说明书提取细胞总RNA,并取少量总RNA用紫外分光光度仪进行纯度和浓度鉴定。反转录过程按TaKaRa逆转录酶(MMuLV)产品说明书进行。
1.4 VH和VL基因的扩增
以合成cDNA第一链为模板,分别以VH基因上、下游引物(VH-B、VH-F)和VL基因上、下游引物(VL-B和VL-F)扩增VH基因和VL基因。PCR反应体系按常规比例配成50 μl(反应程序:95℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30 个循环;72℃ 10 min)。取5 μl PCR产物进行1.5%琼脂糖凝胶电泳鉴定,切胶回收获得VH和 VL基因,并直接进行DNA测序。
1.5 全长CSFV-ScFv基因的扩增
以上述的纯化产物为模板,用引物VH-F1、VH-Linker-B和 Linker-VL-F、VL-B1分别进行 VHLinker和Linker-VL序列的扩增(反应体系和反应程序同方法1.4),PCR产物经电泳鉴定后进行纯化回收。取纯化产物等摩尔混合,通过PCR反应完成VH-Linker-VL片段的预拼接(预拼接程序:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,10个循环;72℃ 10 min),再以2 μl预拼接产物为模板,用VH-F1、VL-B1引物进行VH-Linker-VL全长基因的拼接,拼接程序:95℃ 5 min;95℃ 30 s,60℃ 30 s,72 ℃ 30 s,35 个循环;72 ℃ 10 min。PCR产物经电泳鉴定后进行纯化回收,获得VHLinker-VL全长基因片段。
1.6 CSFV-ScFv基因的克隆与鉴定
将全长ScFv纯化回收后与 pMD-18T载体连接,连接体系与程序参考载体说明书。将连接产物按常规方法转化DH5a感受态细胞,挑取单菌落提取质粒,经过BamH I与Not I酶切鉴定正确的重组质粒pMD-CSFV-ScFv送至北京华大公司进行核酸序列测定分析。
1.7 CSFV-ScFv基因所编码的蛋白质的结构预测
基于CSFV-ScFv基因的核苷酸序列,利用Edit-Seq推导其氨基酸序列,利用NCBI的blasp、Igblast进行氨基酸序列的同源性分析和IgG结构域分析,利用ExPASy服务器上的ProtParam软件分析CSFVScFv分子理化性质,利用 NPSA在线服务器预测CSFV-ScFv二级结构,最后采用SWISS-Model在线服务器预测CSFV-ScFv三级结构,并进行同源建模。
2 结果
2.1 VH、VL基因片段的扩增
提取对数生长期的抗PRRSV单克隆抗体杂交瘤细胞anti-CSFV14的总RNA,测定其浓度为1 262 ng/μl。以此RNA为模板扩增VH和VL基因,扩增产物经1.5%的琼脂糖凝胶电泳分析,结果(图1)显示,获得预期的约363 bp的VH基因和约324 bp的VL基因。
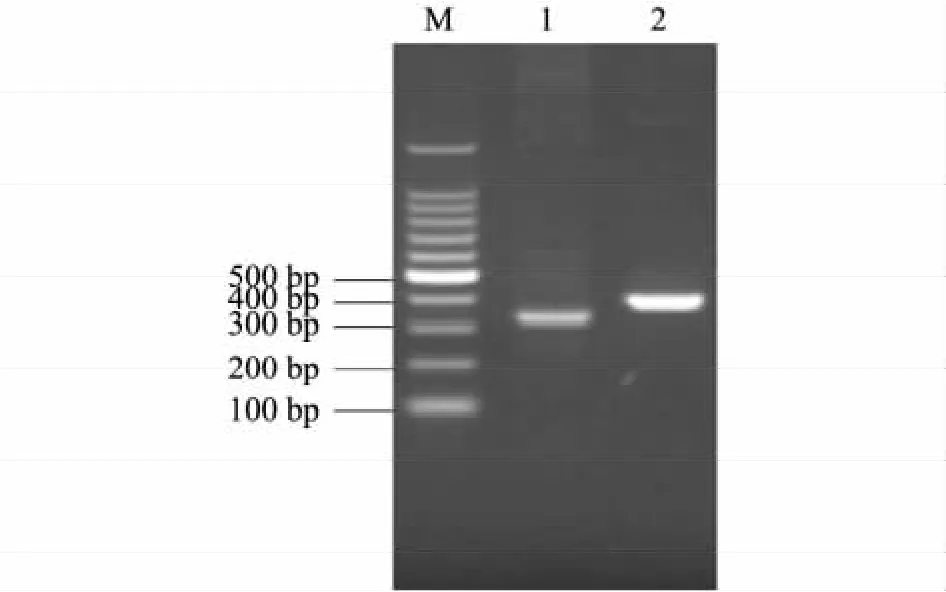
图1 CSFV VH、VL基因扩增结果Fig.1 PCR amplified products of CSFV VH and VL genes
2.2 全长CSFV-ScFv基因的扩增拼接
以纯化的VH与VL基因为模板分别扩增出长约410 bp的VH-Linker及长约369 bp的Linker-VL基因片段(图2),将 VH-Linker与 Linker-VL等量混合,在PCR反应中完成 VH-Linker-VL的预拼接,再以预拼接产物为模板进行VH-Linker-VL全基因的拼接扩增,扩增产物经琼脂糖凝胶电泳鉴定,获得预期长约730 bp的目的基因(图3)。

图2 VH-Linker、Linker-VL基因扩增结果Fig.2 PCR amplified products of VH-Linker and Linker-VL genes
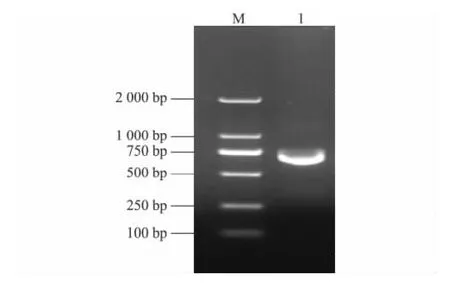
图3 全长CSFV-ScFv基因扩增结果Fig.3 PCR amplified products of full-length CSFV-ScFv gene
2.3 CSFV-ScFv基因的克隆及酶切鉴定
将纯化的CSFV-ScFv基因与pMD-18T载体进行连接,转化感受态细胞,提取单菌落质粒,经BamH I和Not I双酶切鉴定后,发现重组质粒pMDCSFV-ScFv可切出约730 bp的外源基因片段(图4)。
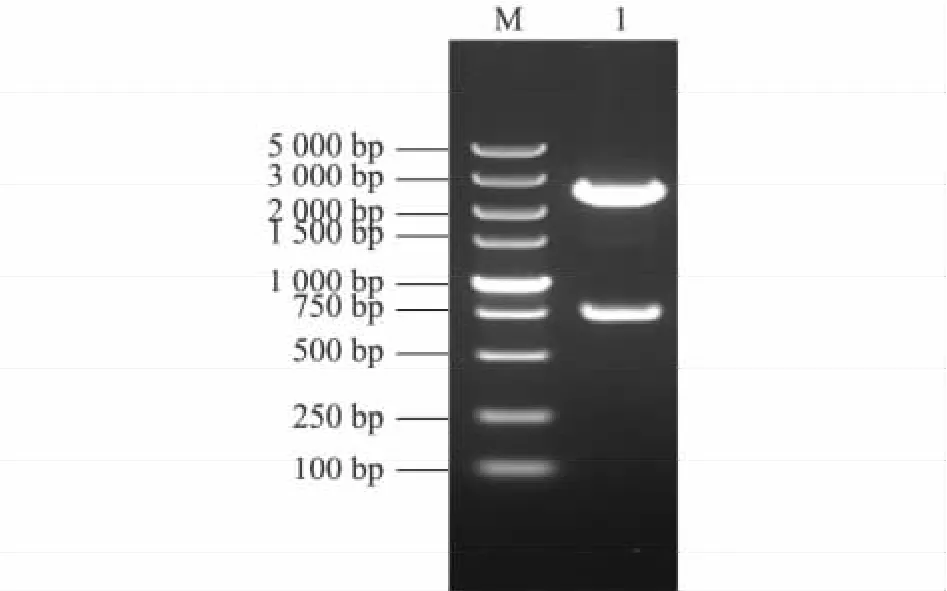
图4 pMD-CSFV-ScFv重组质粒的酶切鉴定结果Fig.4 Ⅰdentification of pMD-CSFV-ScFv recombinant plasimid
2.4 CSFV-ScFv重组质粒的测序及分析
将酶切鉴定正确的重组质粒进行序列测定,结果显示所扩增的单链抗体基因全长732 bp,由预期的VH基因、VL基因和Linker组成,其中 VH基因位于Linker的上游,大小为363 bp,为一开放阅读框,不含终止密码子,可编码121个氨基酸;序列中有明确的3个互补决定区(CDR)和4个框架区(FR),第22、96位的氨基酸残基为抗体可变区特征性的半胱氨酸残基,核苷酸序列与鼠源的重链可变区框架相似率最高达90.28%,表明VH基因所编码的氨基酸序列符合鼠抗体可变区基因特征。VL基因则位于Linker下游,长324 bp,基因内无终止密码子,编码108个氨基酸,序列中亦有明确的CDRs和FRs,抗体可变区特征性的半胱氨酸残基位于第23、88位,核苷酸序列与鼠源的轻链可变区框架相似率最高达92.83%,表明VL基因所编码的氨基酸序列符合鼠抗体可变区特征。Linker大小为45 bp,编码15个氨基酸残基。序列详见图5。
2.5 CSFV-ScFv蛋白质结构的分析预测
2.5.1 CSFV-ScFv氨基酸序列比对分析 将VH、VL及ScFv基因编码的氨基酸序列经NCBIblastp检索分析,发现了IgG典型的可变区结构域(IGV),并与多种已登录的鼠单链抗体同源性很高,与ScFv anti-White Spot Syndrome Virus(AAY88909.1)同源性最高达79%,具有鼠源单链抗体可变区的所有特征。
2.5.2 CSFV-ScFv蛋白质理化性质与二级结构预测分析 用蛋白质序列分析软件分析蛋白质理化性质,并对其二级结构进行预测分析。CSFV-ScFv基因所编码蛋白质分子式为C1164H1767N317O363S8,原子数3 619,理论相对分子质量为26 266.2,等电点为8.93,不稳定系数为35.05,为不稳定蛋白质,疏水氨基酸92个,占37.7%,亲水性评估值为-0.425,为亲水性蛋白质。二级结构预测结果显示,该蛋白质主要由β-片层和无规则卷曲组成。其中,17个氨基酸残基可形成α螺旋,占6.97%,92个氨基酸残基形成自由伸展,占37.70%,135个氨基酸残基可形成无规则卷曲,占55.33%,Linker呈无规则卷曲(图6)。
2.5.3 CSFV-ScFv蛋白质三级结构分子建模 经序列比对发现2gki.1所编码的氨基酸序列与目的基因CSFV-ScFv所编码的氨基酸序列同源性可达到72.20%,根据同源建模的思路,运用SWISS-Model软件进行同源建模,模拟CSFV-ScFv蛋白质三级结构,模拟结构可靠。结果显示,重链可变区主要由10个β片层折叠形成,轻链可变区主要由11个β片层折叠形成。三级结构中连接肽无规则卷曲形成索状结构,将VH和VL牵拉而相互靠近,形成一个口袋样形状的沟槽结构,以利于抗原结合(图7),理论上具有良好的抗原结合活性。

图5 CSFV-ScFv基因及其所推导的氨基酸序列Fig.5 The CSFV-ScFv gene and its deduced amino acid sequence

图6 CSFV-ScFv蛋白质二级结构预测Fig.6 The prediction of secondary structure of CSFV-ScFv protein

图7 CSFV-ScFv蛋白质三级结构同源建模Fig.7 The 3D structure homology modeling of CSFV-ScFv protein
3 讨论
抗体在免疫学检测的应用由来已久,早在19世纪末,人们就能通过免疫动物获得抗血清。1975年,Kohler等[11]建立的B淋巴杂交瘤细胞技术更是抗体生产的重大技术革命,不仅为医学与生物学研究开创了新纪元,也为临床疫病的诊断和治疗提供了新的工具。然而由于单克隆抗体制备过程复杂,价格昂贵,很大程度上限制了它的临床使用。随着基因工程抗体技术的发展,单链抗体技术走进了人们的视野,单链抗体由于分子量小,穿透性强,免疫原性低,体内易于清除,利于进行基因工程操作,在疾病预防、诊断和治疗中显示了巨大的应用前景。以单链抗体替代传统的IgG抗体为检测元件应用于病原微生物的检测具有明显的优势。与传统单抗比,单链抗体制备简单,成本低廉而又具有亲代抗体的全部抗原结合位点,Nimmagadda等[12]以 HAVScFv基因为基础建立的免疫捕获ELISA检测方法,与商业化单克隆抗体检测试剂盒应用效果无明显的差异,证实单链抗体具有亲本抗体相同的免疫活性。此外,单链抗体基因工程操作更简便,其N端或C端可与其他分子拼接构建双功能分子,除替代传统抗体用于建立ELISA等检测方法外,还可应用于疫病的快速检测领域,如覃绍敏等[13]以抗人红细胞单链抗体与猪瘟E2基因融合蛋白质为基础建立的红细胞凝集试验可快速、简便、准确地进行猪瘟抗体的检测。目前,国内外学者已经研制出多种单链抗体基因,并应用于临床[14-15]。
本研究在前期的试验中获得1株高亲和力的抗猪瘟E2蛋白质单克隆抗体杂交瘤细胞anti-CSFV14的基础上,通过合成通用引物,分别进行单克隆抗体的重链和轻链可变区基因的扩增,并进行测序。测序结果用IMGT数据库、NCBI数据库平台提供的在线分析工具进行验证,通过分析,证实了基因序列的正确性,并根据分析的结果重新设计了后续的引物进行VH基因、VL基因的修正以及CSFV-ScFv基因全长的拼接克隆及结构预测分析。
单链抗体的表达量及其免疫活性和其构建方法密切相关,不同的连接顺序会影响ScFv的二聚或多聚化的行为[16],进而影响单链抗体表达产量及其三维空间构象的形成,最终影响单链抗体的生物活性。很多研究结果表明,VL-Linker-VH的连接方式可表现出更强的形成高分子聚合物的趋势,在进行分泌表达时其表达量要高于VH-Linker-VL的10~20倍,但VH-Linker-VL基因表达的蛋白质要比VL-Linker-VH基因表达的蛋白质显示出更大的结合活性[17-18],因此,基于抗体活性效价考虑,我们选取了亲和力较好的VH-Linker-VL连接方式构建CSFVScFv基因。Linker的设计对保持亲本抗体的亲和力有重要影响,它必须能使VH和VL易于自由折叠,使抗原结合位点处于适当的构型,并不引起其分子动力学改变,避免对抗原结合部位造成干扰。目前报道使用最多的Linker是Huston根据X线晶体衍射分析抗体可变区结构及计算机辅助分析结果设计的15肽序列(Gly4Ser)3,该序列已经有许多成功应用的报道,因此本研究中亦选用此序列。
蛋白质同源建模是基于查询的蛋白质氨基酸序列与已知蛋白质氨基酸序列显著的相似性来预测蛋白质三维结构的方法,是一种可靠的、广泛接受的具有实用性的结构预测技术。通常蛋白质的氨基酸序列间相似度应高于30%,表示空间结构相似,低于30%时,序列比对时会搜索到大量的非相关蛋白质,难以用于同源建模[19]。我们对所得到的CSFV-ScFv基因进行同源建模分析时,搜索到的模型蛋白质与靶蛋白质的相似度为72.20%,所以对靶蛋白质的模拟结果可靠度高。从模拟结果可看出,CSFVScFv属于 β-片层结构,其相邻的两条 β-链反向平行,形成由轻链连接的β-片层结构,两个片层之间通过疏水作用和二硫键稳定。ScFv的理化性质分析可知,ScFv为不稳定蛋白质。此外,从蛋白质的三级结构还可看出,目的蛋白质的VH和VL结构域相互靠近,形成一个相对致密的分子,Linker则游离在外,使VH和VL形成一个口袋结构,这样的结构可能有利于抗体识别和结合抗原。
[1] MOENNIG V.Introduction to classical swine fever:virus,disease and control policy[J].Veterinary Microbiology,2000,73(2):93-102.
[2] 华利忠,吴文开,邵国青.发酵床与传统水冲圈模式下猪瘟、蓝耳病及口蹄疫血清抗体差异调查[J].江苏农业科学,2014,42(9):178-180.
[3] 王凤云,林 峰,陈玉霞,等.猪瘟与猪链球菌病混合感染的诊断与防治[J]. 江苏农业科学,2014,42(9):183-185.
[4] 谭 菊,李巨银,黄东璋,等.猪瘟与附红细胞体病混合感染的诊治[J]. 江苏农业科学,2013,41(9):181-182.
[5] LI A,LI Z,WANG Y,et al.Construction and expression of a single chain antibody mimicing human ovarian cancer antigen CA125[J].Cell Mol Immunol,2006,3(1):59-62.
[6] 秦丽莉,张春明.单链抗体研究进展及其在医学中的应用[J].国外医学:放射医学核医学分册,2006,29(6):255-257.
[7] 沈倍奋,陈志南,刘民培.重组抗体[M].北京:科学出版社,2005:347-351.
[8] 毛 燕.广西猪瘟病毒分子流行病学调查及单克隆抗体的制备[D].南宁:广西大学,2012.
[9] 梁国栋.最新分子生物学实验技术[M].北京:科学出版社,2001:87.
[10] HUSTON J S,LEVINSON D,MUDGETT-HUNTER M,et al.Protein engineering of antibody binding sites:recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli[J].Proceedings of the National Academy of Sciences,1988,85(16):5879-5883.
[11] KOHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975,256(5517):495-497.
[12] NIMMAGADDA S V,AAVULA S M,BIRADHAR N,et al.Development of recombinant single-chain variable fragment against hepatitis A virus and its use in quantification of hepatitis A antigen[J].Biologicals,2012,40(4):299-308.
[13]覃绍敏,白安斌,吴健敏,等.抗人红细胞单链抗体与猪瘟 E2蛋白双功能融合蛋白的构建及生物学活性检测[J].生物工程学报,2010,26(1):28-34.
[14] CLACKSON T,HOOGENBOOM H R,GRIFFITHS A D,et al.Making antibody fragments using phage display libraries[J].Nature,1991,325(6336):624-628.
[15] SUN C,WIRSCHING P,JANDA K D.Enabling ScFvs as multidrug carriers:A dendritic approach[J].Bioorganic & Medicinal Chemistry,2003,11(8):1761-1768.
[16] DOLEZAL O,PEARCE L A,LAWRENCE L J,et al.ScFv multimers of the anti-neuraminidase antibody NC10:shortening of the linker in single-chain Fv fragment assembled in VL to VH orientation drives the formation of dimers,trimers,tetramers and higher molecular mass multimers[J].Protein Engineering,2000,13(8):565-574.
[17] GENG S,FENG J,LI Y,et al.Binding activity difference of anti-CD20 ScFv-Fc fusion protein derived from variable domain exchange[J].Cell Mol Immunol,2006,3(6):439-43.
[18] PLÜCKTHUN A,PACK P.New protein engineering approaches to multivalent and bispecific antibody fragments[J].Immunotechnology,1997,3(2):83-105.
[19] JIN X.Essential bioinformatics[M].New York:Cambridge University Press,2006:173-230.
