生长素对猪孤雌激活胚胎体外发育的影响及其受体基因的表达模式
2015-01-01李运生童彬彬刘晓蕊凌英会方富贵张运海
李运生, 童彬彬, 刘晓蕊, 凌英会, 方富贵, 张运海, 刘 亚
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.安徽地方畜禽遗传资源保护与生物育种省级实验室,安徽 合肥 230036)
生长素(Ghrelin)是一种生长激素促分泌素受体的天然配基,广泛表达于动物胃、消化道、肺、心脏、乳腺等多个器官[1],调控食物摄取和促进生长激素分泌[2]。生长素在生殖器官如子宫内膜、胎盘、睾丸、卵巢和胚胎中均有表达[3-4],暗示其在生殖轴中起调控作用[5]。胚胎发育是生殖发生的重要过程,也是生殖研究的重点内容。关于生长素对哺乳动物附植前胚胎发育的作用研究较少,且结果也不一致。在小鼠[6-7]和牛[8]胚胎发育过程中添加生长素可抑制囊胚的发育效率。但在水牛[9]、绵羊[10]和猪[11]上,却发现生长素可以促进胚胎的体外发育能力。鉴于生长素在不同物种间的差异表现,有必要对其在胚胎发育过程中的作用机制进行探讨。
生长素主要通过与其特异性受体GHSR-1a结合发挥生物学效应。Kawamura[5]发现附植前胚胎发育过程中生长素受体基因GHSR-1a mRNA仅在小鼠致密化、囊胚及孵化胚阶段转录。而Du等[12]认为绵羊早期胚胎各发育时期均有GHSR-1a表达。目前在猪的胚胎上,GHSR-1a的存在情况及其表达模式未有研究,生长素在物种间的差异作用是否与其受体的表达模式相关亦未有报道。
本试验拟在猪孤雌胚培养基中添加不同浓度的生长素,研究其在猪孤雌胚早期发育中的作用及对发育速度的影响,并检测猪孤雌激活胚胎不同发育时期GHSR-1a的转录及其表达水平,以期探明生长素及其受体GHSR-1a对哺乳动物附植前胚胎发育的影响及可能机制。
1 材料与方法
1.1 试验材料
猪卵巢采自安徽合肥肥东福润屠宰场,置入38℃含青霉素及链霉素的生理盐水保温瓶中保存。
1.2 猪卵母细胞的获得及体外成熟
参照Li[13]的方法,生理盐水清洗卵巢后用18号针头抽取2~6 mm卵泡,体式显微镜下挑选卵丘包裹完整,2层以上颗粒细胞层的卵丘卵母细胞复合体(Cumulus-oocyte complex,COCs),按照每50枚左右一孔的密度将COCs移入放有400 μl成熟培养液的四孔板,38.5℃、5%CO2、100%湿度的环境中体外成熟42~44 h。
1.3 猪孤雌胚的获得
用0.1%透明质酸酶脱除卵丘细胞,显微镜下选择透明带完整、卵周隙清晰、已排出第一极体的卵母细胞,并在预热的 f2中洗涤3遍[13]。放入融合槽中用 1.56 kV/cm、80 μs、1 次直流电脉冲进行电激活。移出后用胚胎培养液(Porcine zogyte medium 3,PZM3)[14]将 卵 母 细 胞 洗 涤 3遍,转移到覆盖石蜡油的化学辅助激活液(PCC,PZM3+10 μg/ml松胞素 B+10 μg/ml环已酰亚胺)中作用4 h,最后移入PZM3胚胎培养液中培养。培养条件为38.5℃、5%CO2、饱和湿度。
1.4 间接免疫荧光染色
参考周娜汝[15]的方法,一抗孵育时在DPBS+1%BSA中加入 GHSR-1a抗体(ABcam公司生产,ab95250)(1∶200稀释),对照组用PBS代替。胚胎转移到玻片中压片并封片,置于激光共聚焦显微镜(Olympus,FV1000)下扫描拍摄。每组采用相同的曝光值采集图像并用Image J软件分析计算荧光强度。
1.5 胚胎细胞总RNA的提取及反转录
胚胎RNA提取选用Qiagen公司试剂盒RNeasy Micro Kit,No.74004,总RNA反转录采用Qiagen公司试剂盒QuantiTect Reverse Transcription Kit,No.205311。
1.6 引物设计与合成及荧光定量PCR
GenBank中查找GHSR序列(NM_032075.3),设计引物为正向:5'-AACGACTCGCTAGTGGAGGA-3',反 向:5'-GAAGCGTGACACTACCAGCA-3'。引物均由生工生物工程有限公司合成。以GAPDH为内参基因,用实时荧光定量PCR检测GHSR-1a的相对表达量。采用2-△△CT(Livak)法分析GHSR-1a的表达水平。
1.7 不同浓度生长素对猪孤雌胚早期发育的影响
在猪的孤雌激活体外培养液中添加不同浓度生长素[0 mg/L(对照)、0.1 mg/L、1.0 mg/L、10.0 mg/L、100.0 mg/L],分别于培养 30~32 h、44~48 h、80 ~82 h、104 ~108 h、146 ~148 h 时统计其 2-细胞胚胎数、4-细胞胚胎数、8-细胞胚胎数、致密桑葚胚数及囊胚发育数,计算其卵裂率、囊胚率、桑葚胚率。试验重复5次。另外,在猪的孤雌激活体外培养液中添加不同浓度生长素[0 mg/L(对照)、0.1 mg/L、1.0 mg/L、10.0 mg/L、100.0 mg/L],分别于培养 24 h、40 h、72 h、102 h、132 h 时统计其 2-细胞胚胎数、4-细胞胚胎数、8-细胞胚胎数、桑葚胚数及囊胚发育数,计算其卵裂率、囊胚率,比较不同组间发育速度。试验重复5次。
1.8 猪附植前胚胎中GHSR-1a mRNA和GHSR-1a蛋白检测
分别在2-细胞期、4-细胞期、8-细胞期、桑葚胚期、囊胚期收集胚胎[15],采用荧光定量PCR技术检测猪孤雌激活胚GHSR-1a mRNA在上述各阶段的表达水平,试验重复3次。收集2-细胞期、4-细胞期、8-细胞期、桑葚胚期与囊胚期的猪孤雌发育胚胎(每组20枚),采用间接荧光免疫法检测不同发育阶段胚胎中GHSR-1a蛋白水平。
1.9 统计分析
应用SPSS 11.5软件系统进行数据处理与统计分析。
2 结果与分析
2.1 生长素浓度对猪孤雌胚胎早期发育的影响
如表1所示,添加10.0 mg/L生长素组的猪孤雌胚胎4-细胞发育率、8-细胞发育率和桑葚胚率均显著高于对照组和0.1 mg/L组(P<0.05);添加100.0 mg/L生长素组的猪孤雌胚胎4-细胞发育率、8-细胞发育率均显著高于添加0.1 mg/L组(P<0.05)。添加0.1 mg/L和1.0 mg/L生长素组在各时期胚胎发育效率均与对照组无显著差异(P>0.05)。
如图1所示,胚胎发育24 h后,添加生长素的试验组猪孤雌胚2-细胞胚胎的发育速率与对照组无显著差异(P>0.05);胚胎发育40 h、72 h、102 h时,添加10.0 mg/L生长素组猪孤雌胚的4-细胞胚胎、8-细胞胚胎及桑葚胚发育速率明显快于对照组(P<0.05),其他组与对照组无显著差异(P>0.05);胚胎发育132 h后,添加生长素的试验组猪孤雌胚囊胚的发育速率与对照组无显著差异(P>0.05)。

表1 不同浓度生长素对猪孤雌胚胎早期发育能力的影响Table 1 Effects of different concentrations of ghrelin on the in vitro developmental competence of porcine parthenogenetic embryos
2.2 猪孤雌胚各发育时期GHSR-1a的表达
荧光定量 PCR结果(图2)显示,GHSR-1a mRNA在猪孤雌胚早期发育的各个阶段均有表达,其中在2-细胞期、4-细胞期、8-细胞期及桑葚胚期表达量无显著差异,囊胚期表达量显著下降(P<0.05)。
2.3 在猪孤雌胚早期发育过程中GHSR1a蛋白的表达量
从图3和图4可以看出,GHSR-1a蛋白在猪孤雌胚早期发育的各个时期均能检测到,囊胚期的表达量显著低于4-细胞期、8-细胞期和桑葚胚期(P<0.05)。

图1 添加生长素后猪孤雌胚早期发育速率的变化Fig.1 The dose-dependent effects of ghrelin on the early development rate of porcine parthenogenetic embryos
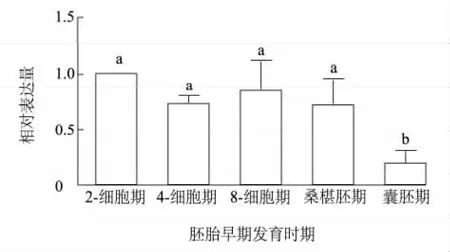
图2 猪孤雌胚胎早期发育各时期GHSR-1a mRNA的相对表达量Fig.2 Relative mRNA expression of GHSR-1a at various developmental stages ofporcineparthenogenetic embryos
3 讨论
近年来,生长素对生殖器官的作用不断被证实,但其在胚胎发育过程中的功能还存在争议。2003年,日本研究人员发现当向小鼠胚胎体外培养液中添加100 nm/L生长素时可抑制小鼠胚胎发育[5]。习海涛[7]发现在体外培养基中添加 0.1 mg/L的生长素显著降低了小鼠自然受精胚和孤雌胚的桑葚胚及囊胚发育率,但进一步提高生长素的添加浓度后,桑葚胚率和囊胚率又有一定程度的回升;而对于体外受精胚,添加1.0 mg/L生长素显著降低了其囊胚发育率,提高生长素的浓度后,囊胚率并没有明显的回升趋势。另有研究报道在培养基中添加50.0 mg/L的生长素显著提高了水牛孤雌胚的囊胚发育率[9]。本研究结果显示,胚胎培养过程中添加10.0 mg/L生长素可以显著提高猪孤雌胚的4-细胞发育率、8-细胞发育率、桑葚胚率及囊胚发育率(P<0.05),但100.0 mg/L的添加浓度降低了猪孤雌胚的囊胚发育率,这与Zhang等人[11]研究结果一致。推测生长素对哺乳动物早期胚胎发育会产生一定促进作用,但在不同物种和不同来源的胚胎及生长素的添加浓度上表现不一。

图3 GHSR1a蛋白在猪孤雌胚早期发育中的表达Fig.3 GHSR1a expression at various developmental stages of porcine parthenogenetic embryos
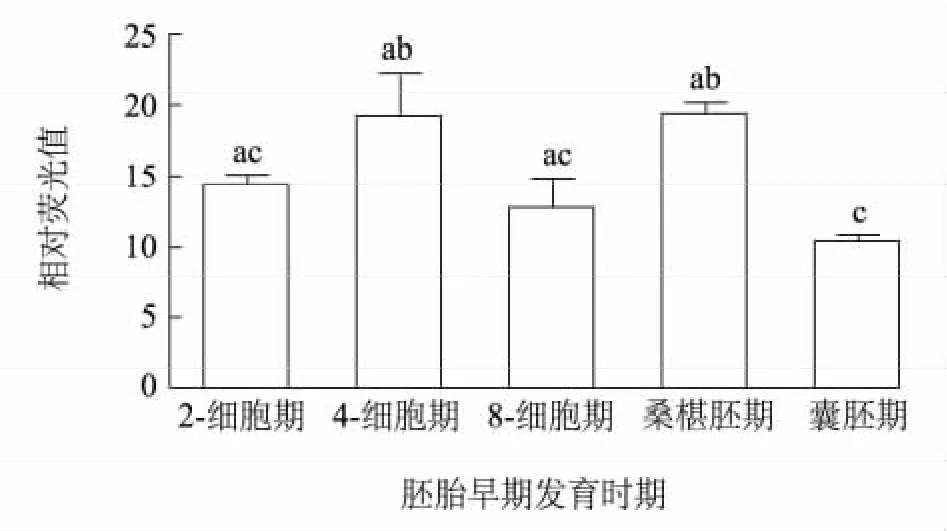
图4 猪孤雌胚胎早期发育各时期GHSR-1a的表达量Fig.4 GHSR-1a levels at various developmental stages of porcine parthenogenetic embryos
向牛体外成熟的卵母细胞中添加800 pg/ml的生长素后发现,成熟18 h后MII期卵母细胞数显著高于对照组,但成熟24 h时卵母细胞数与对照无显著差异,成熟后体外受精时,成熟18 h的卵母细胞形成的囊胚率显著高于成熟24 h组[8]。提示我们生长素可能在卵母细胞发育或胚胎发育过程中起作用。本研究结果表明,添加10.0 mg/L生长素组猪孤雌胚胎4-细胞胚胎、8-细胞胚胎及桑葚胚发育速率明显快于对照组(P<0.05),但2-细胞胚和囊胚在发育速度上与对照组无显著差异(P>0.05)。说明生长素有可能会促进胚胎的早期发育速度。从4-细胞期到桑葚胚期间其特异性受体GHSR-1a表现出的mRNA高表达模式与胚胎发育速度相一致,推测生长素通过GHSR-1a作用于胚胎发育。但生长素通过何种机制促进了胚胎发育的速度,还需要进一步研究。
2008年,Du等[12]检测了绵羊卵母细胞和不同发育时期的胚胎生长素及其受体基因GHSR-1a mRNA转录水平,发现在附植前胚胎不同发育阶段均有表达,其中GHSR-1a mRNA转录水平从GV期到MII期依次递减,在2-细胞期升高,至囊胚期保持稳定。Kawamura等[5]研究结果表明小鼠体外受精胚自桑葚胚以后的附植前胚胎均检测到生长素及其受体GHSR-1a的表达,表达从桑葚胚到囊胚呈增加趋势,而此前各时期则没有生长素 及GHSR-1a的表达。在本研究中,GHSR-1a mRNA在猪孤雌胚胎早期发育的各个时期均可被检测到,在2-细胞期转录水平较高,在4-细胞期降低,8-细胞期回升,至囊胚期迅速下降。这可能是由于在2-细胞期之前,猪胚内还存在大量母源mRNA,而在4~8-细胞期发生胚胎基因组激活,原来的母源mRNA大部分降解,导致4-细胞期GHSR-1a mRNA降低,而8-细胞期时,胚胎基因组已激活转录,因此GHSR-1a mRNA回升。GHSR-1a在这段时间的变化起何种作用,还需要进一步研究。在本研究中发现GHSR-1a mRNA与蛋白在不同发育时期相对丰度的变化趋势并不完全一致,这可能是由于从mRNA到蛋白还受诸如mRNA稳定性、翻译效率、蛋白寿命等多种因素影响所致。
[1] GUALILLO O,LAGO F,GOMEZ-REINO J,et al.Ghrelin,a widespread hormone:insights into molecular and cellular regulation of its expression and mechanism of action[J].Febs Letters,2003,552(2-3):105-109.
[2] HORVATH T L,DIANO S,SOTONYI P,et al.Minireview:Ghrelin and the regulation of energy balance-a hypothalamic perspective[J].Endocrinology,2001,142(10):4163-4169.
[3] GARCIA M C,LOPEZ M,ALVAREZ C V,et al.Role of ghrelin in reproduction[J].Reproduction,2007,133(3):531-540.
[4] HARRISON J L,ADAM C L,BROWN Y A,et al.An immunohistochemical study of the localization and developmental expression of ghrelin and its functional receptor in the ovine placenta[J].Reprod Biol Endocrin,2007,5:25.
[5] KAWAMURA K,SATO N,FUKUDA J,et al.Ghrelin inhibits the development of mouse preimplantation embryos in vitro [J].Endocrinology,2003,144(6):2623-2633.
[6] TENA-SEMPERE M.Ghrelin and reproduction:Ghrelin as novel regulator of the gonadotropic axis[J].Vitamins and Hormones,2008,77:285-300.
[7] 习海涛.Ghrelin和SCF对小鼠附植前胚胎体外发育的影响[D].合肥:安徽农业大学,2009.
[8] AMIRIDIS G S,DOVOLOU E,MESSINIS I,et al.Ghrelin accelerates in vitro maturation of bovine oocytes[J].Reprod Domest Anim,2014,49:665-672.
[9] 谢体三,农 微,张新民,等.Ghrelin对水牛体外受精和孤雌激活胚胎体外发育的影响[J].中国兽医学报,2009,29(11):1478-1480.
[10] WANG Z G,LIN P,YU S D.Effects of ghrelin on developmental competence and gene expression of in vitro fertilized ovine embryos[J].Theriogenology,2013,79(4):695-701.
[11] ZHANG K,WEI H X,ZHANG Y H,et al.Effects of ghrelin on in vitro development of porcine in vitro fertilized and parthenogenetic embryos [J].Journal of reproduction and development,2007,53(3):647-653.
[12] DU C,LI H,CAO G,et al.Expression of the orexigenic peptide ghrelin and the type 1a growth hormone secretagogue receptor in sheep oocytes and pre-implantation embryos produced in vitro[J].Reproduction In Domestic Animals,2010,45(1):92-98.
[13] LI Y S,ZHANG C B,GAO Y,et al.Effect of epigallocatechin-3-gallate on the in vitro developmental potential of porcine oocytes and embryos obtained parthenogenetically and by somatic cell nuclear transfer[J].Italian Journal of Animal Science,2014,13(1):3116.
[14] YOSHIOKA K,SUZUKI C,TANAKA A,et al.Birth of piglets derived from porcine zygotes cultured in a chemically defined medium[J].Biology of Reproduction,2002,66(1):112-119.
[15]周娜汝.猪体细胞克隆胚胎着床前发育期间H3K27乙酰化重编程规律研究[D].合肥:安徽农业大学,2013.
