运用农杆菌介导的针刺法将外源基因转入水稻
2015-01-01颜文飞张启军秦海龙廖慧敏宗寿余夏士健吕川根
颜文飞, 张启军, 秦海龙, 廖慧敏, 宗寿余, 夏士健, 吕川根
(1.南京农业大学农学院,江苏 南京 210095;2.江苏省农业科学院粮食作物研究所/江苏省优质水稻工程技术研究中心,江苏 南京210014)
转基因技术作为一种可持续发展方式,可提高农作物产量、品质和抗性等,具有良好的发展前景,将为农业发展注入新的动力[1]。目前,在水稻育种上相继开发研究的转基因技术有以农杆菌为主导的载体介导转基因技术,以基因枪、PEG等介导的基因直接导入技术和以花粉管通道转化、生殖细胞浸泡吸收为主的种质系统转化技术,其中农杆菌介导技术约占 64%[2]。
农杆菌细胞内的Ti质粒或Ri质粒具有一段T-DNA,可通过农杆菌侵染植物伤口进入细胞,并插入到植物基因组中。通过将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染,可实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株[3]。自从1978年 Chilton等[4]第1次利用农杆菌的Ti质粒为载体将T-DNA上的胭脂碱基因转入烟草细胞以来,农杆菌介导法在双子叶植物转化中得到了广泛应用。1986年,Baba等[5]通过PEG法将农杆菌原生质球与水稻原生质体融合,获得了能合成胭脂碱的水稻转化组织。之后,科学界开始对农杆菌介导的水稻转化技术进行广泛的研究,试图通过转基因技术提高水稻产量、改良品质和增强抗性[6-8]。但是,由于国内外不同实验室使用的基因型、受体植体的不同和培养条件的差异,各个转化体系得到的结果不尽相同,转化率也普遍不高。所以,研究人员分别从Ti质粒的改造、转化载体的构建和组织培养等方面入手,不断优化农杆菌介导的水稻转化方法,以期提高转化效率。
经过近20多年的发展和优化,农杆菌介导转基因技术的转化效率得到了长足的提高,但与现代农业对转基因产品的需求相比,其步伐仍然不够快,仍存在许多障碍和安全隐患,需进一步加强转化技术的研发,突破核心技术。
利用植物生长点转化的原理是外源DNA通过细胞间隙进入茎尖生长点细胞部位,并转化生长点细胞,从而产生转基因后代。近年来,已有一些关于植物生长点用于转化的报道,主要是在小麦、玉米上。1996年,杜立群等[9]用小麦的生长点作为外源基因的直接受体,利用基因枪轰击获得转基因小麦。2005年,Razzaq等[10]以小麦为材料,尝试了一种对生长点直接进行转化的方法,并初步证明了这一方法的可行性。2009年,董福双等[11]以小麦品种石4185为对象,建立了受体制备方法,初步建立了基因枪法转化小麦种子芽生长点的技术。2011年,孙传波等[12]以玉米自交系郑58的茎尖为受体,通过农杆菌介导法将抗草甘膦EPSPS基因转入玉米,初步证明外源基因已经整合到玉米基因组中,以玉米茎尖作为受体的转化系统可行、高效。在水稻上,2001年,林拥军利用农杆菌浸种法将反义Wx基因导入水稻品种珍汕 97B[13]。2005 年,Putu 等[14]利用农杆菌介导直接侵染粳稻品种越光胚芽生长点也获得转基因植株。
本研究将沾有外源基因的农杆菌菌液的接种针直接刺破侵染受体水稻的胚芽生长点,完成转基因操作,而不需诱导愈伤组织以及之后的一系列组织培养过程,为转化水稻提供一种简单、快速、高效的方法。
1 材料与方法
1.1 试验材料
1.1.1 受体水稻品种 水稻(Oryza sativa L.)品种南粳45由江苏省农业科学院粮食作物研究所仲维功研究员提供。南粳45于2009年通过江苏省品种审定委员会审定,为江苏省主栽品种,并被农业部列为超级稻推广品种。
1.1.2 载体和菌株 农杆菌菌株LBA4404含转化质粒pBI121-GUS,含GUS基因(图1),由南京晓庄学院蔡小宁教授馈赠。

图1 质粒PBⅠ121-GUS结构示意图Fig.1 Structure diagram of plasmid PBⅠ121-GUS
1.1.3 试剂 BU-Taq酶、dNTP、Taq Buffer、质粒提取试剂盒均购自南京天为生物科技有限公司,DNA分子量标准购自天根生化科技(北京)有限公司。卡那霉素(Kan)、利福平(Rif)、头孢霉素(Cef)、乙酰丁香酮(As)为Simga公司产品。X-Gluc、DMF为Biosharp公司产品。其他试剂均为国产分析纯。引物(表1)由上海英骏公司合成。
1.1.4 培养基 LB培养基(用于培养农杆菌):酵母提取物5 g/L,胰化蛋白胨10 g/L,NaCl 10 g/L,pH 7.0(固体培养基+琼脂15 g/L)。

表1 基因位点或连锁标记的引物序列Table 1 Primer sequence of gene or linkage markers
1.2 方法
1.2.1 水稻胚生长的观察 将南粳45种子浸没在含清水的培养皿里,在24℃下培养。每天分别挑取3~4粒种子,用解剖刀解剖后,在显微镜下观察胚的形态和结构,确定胚芽生长点的大体位置,共观察14 d。
1.2.2 植物表达载体农杆菌的培养与检测
1.2.2.1 植物表达载体农杆菌的培养 取农杆菌LBA4404菌液(带有转化质粒pBI121-GUS)200 μl于1.5 ml离心管中,用接种环进行平板划线(Kan,50 μg/ml;Rif,50 μg/ml),28 ℃倒置培养 48 h,挑选单菌落接种于10 ml的LB液体培养基中(含50 mg/L Rif和50 mg/L Kan),28 ℃,200 r/min振荡培养24 h。
取培养好的检测有阳性质粒的上述菌液1 ml,放至100 ml液体LB培养基(含100 μmol/L As)中扩大培养,28℃ 200 r/min振荡培养至OD600为0.3。为了便于观察和使农杆菌生长状态良好,扩大培养液里不加抗生素。
1.2.2.2 植物表达载体农杆菌阴阳性的检测 按照Biomiga Ezgene公司生产的Plasmid Miniprep Kit试剂盒的使用说明书进行质粒DNA的微量提取。PCR 扩增体系:10× PCR buffer 2.0 μl,dNTP(2 mmol/L)2.0 μl,Primer(2 mmol/L)2 μl,Taq DNA聚合酶 1 U,质粒 DNA 2.0 μl,补充超纯水至 20 μl。
PCR扩增程序为:94℃、5 min;94℃、30 s,57℃、30 s,72 ℃、50 s,35 个循环;72 ℃、10 min。扩增产物加指示剂后用1%的琼脂糖凝胶进行1 h的110 V电泳后照相。选取PCR扩增结果为阳性的菌液进行扩大培养。
1.2.3 水稻的遗传转化 以下操作均需在无菌条件下进行。
1.2.3.1 水稻种子的培养 将未去颖壳的南粳45种子先用75%的乙醇浸泡5 min,再用0.1%的升汞杀菌15~20 min,无菌水冲洗 3~4次。用无菌镊子将消毒后的种子放在铺有1层滤纸、盛有10 ml无菌水的培养皿中,每皿15粒,26~28℃培养1~2 d,直至种子微露白。
1.2.3.2 农杆菌侵染水稻种胚 用沾有扩大培养后的农杆菌菌液的接种针刺入水稻种胚,然后将种子放入植物培养瓶中(内有2 cm厚的蛭石,蛭石上铺有1张湿润的滤纸),每瓶15粒,22~24℃暗培养9~14 d,共侵染90粒。
1.2.3.3 水稻转化苗的杀菌与移苗 将暗培养后苗长为10 cm左右的转化苗浸泡在浓度为1 mg/ml的Cef溶液中1 h,之后,将苗移栽到网室中的盆钵中,盆钵直径30 cm,每盆5苗。
1.2.4 转基因苗的DNA检测 待处理后的苗长至7~8叶、株高40 cm以上时,每株取200 mg左右嫩叶进行DNA检测,以正常南粳45秧苗为阴性对照。用SDS法从水稻新鲜叶片中微量提取总DNA。以正常南粳45秧苗为阴性对照,上述质粒DNA检测为阳性的质粒DNA为阳性对照,以水稻基因组DNA为模板,以GUS基因的序列设计引物进行转基因植株的PCR分析。
PCR 扩增体系:10 × PCR buffer 2.0 μl,dNTP(2 mmol/L)2.0 μl,Primer(2 mmol/L)2.0 μl,Taq DNA 聚合酶1 U,DNA 2.0 μl,补充超纯水至20 μl。PCR 扩增程序为:94 ℃、5 min;94 ℃、30 s,57 ℃、30 s,72 ℃、54 s,35个循环;72℃、10 min。扩增产物加指示剂后用1%的琼脂糖凝胶进行1 h的110 V电泳后照相。
1.2.5 转基因苗GUS基因的组织化学检测 对上述DNA检测有GUS基因的水稻,每株取2张叶片,并取2张阴性对照水稻叶片,先用90%丙酮在-20℃浸泡至少2 h。将丙酮浸泡后的水稻叶片用无菌水冲洗后转到已过滤除菌的X-Gluc染色液中,37℃水浴10 h。水浴后弃染色液,转入 70%~100%乙醇中脱色2~3次,至阴性对照材料呈白色(室温下)。肉眼或显微镜下观察,具有GUS活性的部位或位点是否呈现蓝色或蓝色斑点。
1.2.6 T1代转基因苗的培育和基因检测 对T0代检测有GUS基因的水稻苗,待其成熟后单株收获种子,编号,包在扎有透气孔的种子袋里,45℃下烘2 d。2 d后将种子拿出,待其温度退到室温时,随机选取8个种子袋,将其泡在0.5%的升汞溶液中浸种24 h,然后经清水冲洗,包在湿布里放在白炽灯管上催芽至露白,期间勤加水,保持布处于湿润状态。将催芽后的种子按编号播种在网室里,盖上保温膜,30 d后分群体取样,进行DNA检测和GUS组织化学检测(方法同方法1.2.4和方法1.2.5)。
2 结果与分析
2.1 水稻胚的生长
经过14 d的反复观察,水稻胚的生长动态及胚芽胚根露出种孔后的大致位置如图2e:胚根位于种孔的中上部,胚芽位于种孔的中下部,二者生长后期呈45°~180°,这使我们明确了进行下一步侵染转化时针刺生长点的大致位置。
图2a:胚尚未露出种孔,胚的形态结构尚未清晰;图2b:胚已微露出种孔,胚芽胚根已可区分;图2c:胚微露出种孔,胚芽胚根形态结构分明;图2d:胚已几乎全露出种孔,胚芽胚根形态结构分明,胚芽胚根分化明显。由此我们确定,在水稻浸泡24~36 h,胚芽胚根已可区分但尚未完全分化时,进行转基因的针刺侵染最为合适。
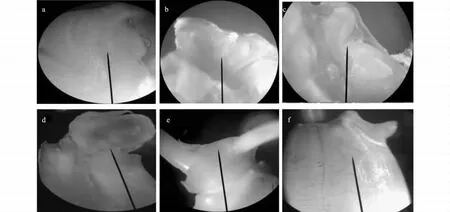
图2 水稻胚的生长Fig.2 Growth of rice embryo
2.2 侵染转化后的秧苗生长
侵染转化后的秧苗生长见图3,待转化苗长至10 cm左右,用Cef溶液进行杀菌消毒后转至网室盆栽。其中侵染了90粒南粳45种子,成苗48株,成苗率达53.3%。
2.3 转基因T0代的PCR检测
对48棵T0代转化植株进行PCR检测,凝胶电泳显像结果中,由于有些DNA扩增条带较模糊,本试验把它们归为阴性植株。保守确定,PCR检测中有16棵植株扩增条带为阳性(图4),转化率达33.3%,初步证实GUS基因已导入水稻基因组中。
2.4 转基因T0代GUS基因的组织化学检测
取未针刺转化的南粳45叶片2张作阴性对照(CK),对于上述DNA检测为阳性的水稻,每个单株取2张叶片,共34张叶片,进行GUS基因的组织化学检测。经酒精脱色后对照呈白化颜色,而32张转GUS阳性T0代叶片均有不同程度的蓝色斑点显现(图5),再次验证了GUS基因已导入南粳45基因组中,并在蛋白质水平上表达。

图3 侵染转化后水稻苗的生长Fig.3 Growth of rice after genetic transformation

图4 转基因T0代植株的PCR检测Fig.4 PCR assays of T0transgenic plants

图5 部分转基因T0代植株GUS基因的组织化学检测Fig.5 Histochemical assay of GUS gene in some T0transgenic plants
2.5 转基因T1代的PCR检测
对8个T1代转基因群体进行PCR检测,发现其中4个T1代群体中99%植株可检测到GUS基因,其群体植株总数分别为32株、37株、46株和15株。而其余4个T1代群体(植株总数分别为24株、64株、52株和66株)中,只有部分植株检测到GUS基因,呈分离现象,阳性植株与阴性植株的分离比依次为 1.0∶3.0、1.0∶1.5、1.0∶2.4、1.0∶10.0。说明 GUS基因已从 T0代传递到T1代,但后代分离并不符合孟德尔遗传分离比例。
2.6 转基因T1代GUS基因的组织化学检测
对种植的8个T1代群体均随机在4株苗上各取1张叶片,阴性对照叶片2张,共34张叶片,进行GUS基因的组织化学染色检测。结果如图6,对照CK经酒精脱色后呈白化颜色,而转GUS阳性T1代苗经酒精脱色后均显蓝色。进一步说明T1代植株中存在GUS基因,且已在蛋白质水平上表达。

图6 部分转基因T1代植株GUS基因的组织化学检测Fig.6 Histochemical assay of GUS gene in some T1transgenic plants
3 讨论
本方法中南粳45 T0代转化率保守达33.3%,即在生长成植株的48株中,16株经PCR检测和GUS基因的组织化学染色检测均为阳性,说明外源基因不仅导入水稻基因组中,且已在蛋白质水平上表达。利用愈伤进行遗传转化的转化率表示的是基因检测为阳性的抗性植株/进行共培养的愈伤总数。据不完全调查,近年来,对植株转化成功率进行统计的结果有:1994年,Hiei等[15]实现对粳稻的高频转化,转化率达到28.6%;2003年,殷丽青等[16]以15个籼稻、粳稻栽培品种为材料,粳稻遗传转化频率为3.9%~11.4%,籼稻遗传转化频率为 0.2%~8.1%;2005年,刘元凤等[17]对4个籼稻品种进行遗传转化,平均稳定转化率为23.6%;2005年,任永霞等[18]对植物遗传转化方法进行概述,统计出利用农杆菌转化粳稻和籼稻的遗传转化率分别为29.0%和22.0%;2007年,胡丽华等[19]利用农杆菌介导法将柠檬酸合成酶基因导入籼稻明恢86,获得抗性植株转化率为6.0%;2007年,宁约瑟等[7]在对农杆菌介导水稻遗传转化研究进展中提到籼稻转化较困难,多数籼稻转化率不超过10.0%;2008年,刘永巍等[20]以粳稻品种空育131、垦鉴稻7号愈伤组织为材料进行遗传转化,平均转化率仅为3.0%。
综上所述,运用常规农杆菌介导法转化水稻,粳稻的平均转化率一般在3%~29%,籼稻的平均转化率不高于10%。本研究方法获得了较高的转化效率,且导入的基因均已在蛋白质水平上表达。而且,本方法不需诱导愈伤组织以及之后的一系列组织培养过程,即不需配制各种培养基、控制各种培养条件并对其不断进行优化调整。利用传统农杆菌介导法获得转基因植株的周期至少为2~4个月,而应用本方法只需10~15 d。本方法大大缩短培养周期,节省了大量的财力物力,简化了农杆菌介导转化法的流程,提高了转化的工作效率。
对转基因T1代进行PCR检测发现,部分转基因后代群体99%的个体为GUS阳性,而有4个转基因后代群体发生基因分离,分离比并不符合孟德尔3∶1的分离比。根据前人转基因遗传研究的结果,外源基因一般作为1个显性基因传递给后代,遵循孟德尔遗传分离规律,自交结实后代表现3∶1分离比例,与非转化亲本杂交后代表现 1∶1分离比[21]。
对于后代群体发生分离但又不符合孟德尔式遗传规律的现象,猜想其原因可能有2个,一是由于转化针刺生长点的位置不够精确,使得转化受体为嵌合体,所以其后代不符合3∶1的分离比。二是TDNA多拷贝地整合到宿主染色体中或部分单株转入基因丢失等。对于这2种情况,可行的解决办法是,利用Southern印迹选择单拷贝植株,繁殖至高世代,直到获得目标基因纯合的株系。
[1] 杨长青,王凌健,毛颖波,等.植物转基因技术[J].科学,2011,63(3):21-24.
[2] JAMES C.2009年全球生物技术/转基因作物商业化发展态势[J].生物工程学报,2010,30(2):1-22.
[3] 万建民.我国转基因植物研发形势及发展战略[J].生命科学,2011,23(2):157-167.
[4] CHILTON M D,SAIKIR K.Highly conserved DNA of Ti plasmids overlaps T-DNA maintained plant tumors[J].Nature,1978,275:147-149.
[5] BABA A,HASEZAWA S,SYONO K.Cultivation of rice protoplasts and their transformation mediated by Agrobacterium protoplasts[J].Plant Cell Physio,1986,27:463-468.
[6] 郑 腾,陆承平.转基因技术对粮食生产的影响[J].生物学通报,2004,39(1):6-9.
[7] 宁约瑟,刘雄伦.根癌农杆菌介导水稻遗传转化研究进展及展望[J].中国农学通报,2007,23(3):47-51.
[8] 李 卫,郭光沁,郑 锠.根癌农杆菌介导遗传转化研究的若干新进展[J].科学通报,2000,45(8):798-807.
[9] 杜立群,李银心,麻 密,等.小麦生长点转化法初报[J].植物学报,1996,38(11):921-924.
[10]RAZZAQ A,张艳敏,杨 帆,等.小麦茎生长点转化研究初报[J].华北农学报,2005,20(1):17-22.
[11]董福双,张艳敏,杨 帆,等.小麦芽生长点的基因枪转化技术研究[J].华北农学报,2009,24(5):1-6.
[12]孙传波,李海华,郭 嘉,等.农杆菌介导法向玉米茎尖导入抗草甘膦EPSPS基因的研究[J].生物技术通报,2011(3):91-93.
[13]林拥军.农杆菌介导的水稻转基因研究[D].武汉:华中农业大学,2001.
[14] PUTU S,TSUTOMU S,HIDENARI S,et al.Development of simple and efficient in plant-a transformation method for rice(Oryza sativa L.)using Agrobacterium tumefaciens[J].Bioscience and Bioengineering,2005,100(4):391-397.
[15] HIEI Y,OHTA S,KOMARI T,et al.Efficient transformation of rice mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA [J].Plant J,1994,6(2):271-282.
[16]殷丽青,张建军,王慧梅,等.提高根癌农杆菌介导水稻遗传转化频率的研究[J].上海交通大学学报:农业科学版,2003,21(增):43-47.
[17]刘元凤,刘彦卓,王金花,等.根癌农杆菌介导籼稻遗传转化影响因素研究[J].分子植物育种,2005,3(5):737-743.
[18]任永霞,季 静,王 罡,等.植物遗传转化方法概述[J].河北北方学院学报:自然科学版,2005,21(6):38-42.
[19]胡丽华,吴慧敏,周泽民,等.利用农杆菌介导法将柠檬酸合成酶基因(CS)导入籼稻品种明恢86[J].分子植物育种,2006,4(2):160-166.
[20]刘永巍,田红刚,李玉华,等.根癌农杆菌的水稻遗传转化[J].牡丹江师范学院学报:自然科学版,2008(1):30-32.
[21]吴金平.利用离体培养技术筛选魔芋软腐病抗源材料的研究[D].武汉:华中农业大学,2004.
