石墨烯吸附材料及其在真菌毒素检测中的应用
2015-01-01李培武丁小霞张兆威张良晓
喻 理,李培武 ,张 奇,丁小霞,张 文,张兆威,张良晓,毛 劲
(1.中国农业科学院 油料作物研究所,湖北 武汉 430062;2.农业部 油料作物生物学与遗传育种重点实验室,湖北 武汉 430062;3.农业部 生物毒素检测重点实验室,湖北 武汉 430062;4.农业部 油料产品质量安全风险评估实验室,湖北 武汉 430062;5.农业部 油料及制品质量监督检验测试中心,湖北 武汉 430062)
真菌在自然界分布广泛,种类繁多、数量庞大,与人类关系密切。许多真菌对人类有益,而有些真菌对人类有害。真菌毒素是由真菌侵染食品、饲料及农产品产生的有毒次生代谢产物,对人和动物的健康危害极大,由其引发的中毒事件最早可追溯到11世纪欧洲的麦角中毒,这种有毒的生物碱能引起人和动物的肌肉痉挛和幻觉,进而发展为四肢动脉的持续性变窄和坏死[1]。20世纪以来,造成较大社会影响的真菌毒素中毒事件有1913年俄罗斯东西伯利亚的食物中毒,1952年美国佐治亚州发生的动物急性致死性肝炎和1960年英国发生的火鸡X病[2]等。这些中毒事件的频频发生,引起了人们对真菌毒素防治的关注。真菌的生物学特性导致其污染范围广,预防难度高。为保障人民食品安全,真菌毒素的检测分析成为其防治研究的重要环节。我国在2011年发布的国家标准GB 2761-2011中对食品中的黄曲霉毒素B1(AFB1)、黄曲霉毒素M1(ATM1)、脱氧雪腐镰刀菌烯醇、展青霉素、赭曲霉毒素A(OTA)及玉米赤霉烯酮含量设定了最新的限量[3]。该标准较修订前增加了真菌毒素的限量指标,扩大了毒素限量的适用范围,意味着要在多种样品中高灵敏检测多种真菌毒素,对真菌毒素的检测方法提出了更高要求。目前,在真菌毒素的众多检测方法中,不论是主导仲裁判定依据的实验室大型精密仪器分析方法[4],还是便携式可视化的快速免疫分析方法[5-8],均普遍存在被测目标物含量低,受基质干扰严重的样品前处理问题。如何能高效、快速地分离富集目标物,减少和消除样品中的干扰物成为目前真菌毒素检测方法研究的关键。
石墨烯是一种由碳原子构成的二维纳米材料,其独特的碳六元环晶体结构和良好的化学稳定性,使之在微量或痕量目标物的检测分析研究中有着巨大的应用前景[9-12]。近年来,石墨烯类纳米材料层出不穷,对其吸附性能的研究热度也持续升温,为其在各种复杂样品前处理(特别是在分离和富集环节)中的应用提供了强大的理论支撑。目前,基于石墨烯吸附材料的检测分析研究开始从环境污染物检测延伸到食品有毒有害物质及农产品质量安全检测领域。本文综述了近5年来用于分离富集的石墨烯类纳米材料的种类和结构,对应用此类吸附材料的前处理方法进行了归纳,并在此基础上,对其在真菌毒素检测中的应用进展做了详细介绍。
1 石墨烯类纳米材料的结构及吸附性能
碳纳米材料是一种常见的吸附材料,有不少文献报道了不同形态的碳纳米材料(如活性炭、介孔碳、碳纳米管和富勒烯等)的优越吸附性能[13]。自2004年石墨烯被发现以来,作为碳纳米材料中的明星成员,其吸附特性被视为重要性能而受到科研工作者的广泛关注[14]。同时随着石墨烯、氧化石墨烯、还原氧化石墨烯和各种石墨烯复合材料的陆续制备,其吸附性能也逐渐被人们认识和研究。目前的石墨烯类吸附材料主要有以下3大类。
1.1 石墨烯
石墨烯(Graphene,G)作为构建其它维度碳质材料(如零维结构的富勒烯、一维结构的碳纳米管和三维结构的石墨)基本单元的二维纳米材料,最初只是物理学家研究的理论模型(如图1所示)。物理学家认为这类材料热动力的稳定性不够,不可能存在于自然界中。因此,当2004年Geim等[14]用最普通的微机械分离法成功制备出单原子层石墨晶体薄片(石墨烯)后,轰动了整个物理界。但科学界对石墨烯的研究热情并不仅限于理论物理的范畴,对石墨烯材料在化学、生物学和材料学方面的研究结果表明,石墨烯具有优于其它碳纳米材料的电学、光学、力学和化学特性,这些特性使其成为目前碳纳米材料中的明星材料。
石墨烯的吸附能力主要来自于其独特的晶体结构(由sp2杂化的碳原子组成的六角形蜂窝结构)和单原子层的高比表面积(理论值为2 630 m2/g)。高比表面积使其可通过物理吸附富集和移除各种重金属[15];而独特的晶体结构使其可通过π-π堆叠效应吸附含苯环类的多种有机物[16]、农药[17]、兽药[18]和毒素。Shen等[19]将石墨烯作为吸附剂用于贝肉中海洋毒素的分离与富集,并成功与超高效液相色谱-质谱/质谱(UPLC-MS/MS)联用检测了贝类中的7种亲脂类海洋毒素。

图1 石墨烯结构的示意图[14]Fig.1 Schematic illustration of graphene structure[14]
1.2 官能化石墨烯
官能化石墨烯是在石墨烯的表面进行官能团修饰而制备出的一类石墨烯衍生物,主要有氧化石墨烯(Graphene oxide,GO)、还原氧化石墨烯(Reduce graphene oxide,rGO)和其他官能团修饰的石墨烯。氧化石墨烯是一类含有多种含氧官能团的石墨烯纳米材料,与石墨烯具有相似的二维结构,主要由未被氧化的芳香区(sp2碳区域)和氧化后形成的脂肪六元环区(sp3碳区域)组成,sp3碳区域以羟基、环氧、羰基和羧基等氧化官能团形式存在,其中羟基、环氧和羰基随机分布在层间,而羧基一般存在于片层的边缘[20]。氧化石墨烯因氧化的程度不同,含氧官能团的数量不同,呈现出比石墨烯更多的性能。与石墨烯相比,GO具有更强的亲水性,更易溶于极性溶剂[21],因此,GO多作为吸附材料用于吸附液体样品中的目标物。Gao等[22]研究了GO对水中四环素抗菌剂的吸附性能,认为其吸附能力主要来自GO的π电子体系。这种丰富的π电子体系,使得GO可以通过π-π堆叠和cation-π作用将四环素牢牢吸附在片层表面,且GO对四环素的理论吸附量可达到313 mg/g。本课题组[23]研究了GO对黄曲霉毒素B1的吸附特性,结果表明,GO对黄曲霉毒素B1的最大吸附量为62.5 ng/mg,且吸附容量不受黄曲霉毒素B2的影响。还原氧化石墨烯是由GO作为前驱物还原制备而成的一类介于G和GO中间的碳二维纳米材料。其片层结构上的含氧基团在一定程度上被还原,但由于还原不完全,会残留部分含氧官能团。还原氧化石墨烯的吸附性质与石墨烯类似,其因制备成本低、产量高,而被广泛用于吸附材料。此外,将氧化石墨烯的含氧基团进一步修饰偶联氨基、磺酸基或其它基团等,可以得到其它官能化石墨烯材料。对于这类材料而言,虽然其表面的官能基团发生了改变,但其片层主体结构并未变化,故仍对芳香环物质有吸附能力。Fang等[24]制备了一种氨基氧化石墨烯,这种材料的比表面积达320 m2/g,能在5 min内吸附0.3 g/L钴溶液中90%的钴离子。另一方面,针对吸附的目标物的分子结构特性、极性,对石墨烯进行特殊的官能化修饰,还能大大提高其对目标物的吸附能力。Gao等[25]将硫醇基修饰的氧化石墨纳米片与未修饰的氧化石墨纳米片做比较,发现其对液体中汞离子的吸附能力提高了6倍之多。
1.3 石墨烯类复合材料
仅对石墨烯的表面基团进行改性不能满足当前分析检测的需求,因此,科学家将石墨烯与其它纳米材料复合,制备出石墨烯类复合材料。按复合材料的类型,石墨烯类复合材料可分成3大类:石墨烯-无机纳米复合材料、石墨烯-金属及其氧化物复合材料、石墨烯-高分子复合材料。
石墨烯-无机纳米复合材料中最具代表性的是石墨烯-二氧化硅复合材料和石墨烯-碳纳米管复合材料。江桂斌院士的研究团队[26]在2011年首次将石墨烯-二氧化硅复合材料作为吸附剂用于固相萃取前处理,并研究了该材料作为正相和反相色谱柱填料的可行性。随后,本课题组[27]也制备了一种氧化石墨烯-二氧化硅复合材料,并成功用于植物油中黄曲霉毒素的移除。Dichiara等[28]制备了单层碳纳米管和石墨烯复合的薄膜,通过对复合前后材料吸附芳香族化合物实验结果的比对,证明复合材料较单独的碳纳米管或石墨烯在吸附效率和容量上均提高了25%。其他无机盐与氧化石墨烯复合的纳米材料也能作为吸附剂用于染料移除和重金属检测。卞战强等[29]将麦饭石和氧化石墨烯的复合材料用于镉元素检测,而焦磷酸酯和石墨烯的复合材料对亚甲基蓝的吸附量也高达200 mg/g[30]。
目前,石墨烯-金属及其氧化物复合材料中应用最广泛的是磁性石墨烯,即石墨烯与铁基氧化物的复合材料。因为铁氧化物一般具有磁性,与石墨烯复合能作为磁固相萃取的吸附剂,达到高效富集和快速分离一步式进行的萃取效果。Es'haghi等[31]以磁性石墨烯吸附成功分离了大米、小麦和芝麻样品中的黄曲霉毒素 B1、B2、G1和 G2。除了真菌毒素,磁性石墨烯还可用于重金属[32-33]、除草剂[34-35]、农药[36]、兽药[37]、孔雀石绿[38]等非法添加物的富集和移除。其它用于吸附剂的石墨烯 - 金属及其氧化物复合材料还有铁掺杂石墨烯[39]、石墨烯-二氧化钛复合材料[40-41]、石墨烯-层状双氢氧化物[42-43],GO@ZnO[44],rGO - ZrP[45],SnS2/rGO[46]和 G/MnO2[47]等。
石墨烯-高分子复合材料近年来也被广泛用作样品前处理的吸附材料。Kumar等[48]证实了三辛胺-氧化石墨烯复合纳米材料作为吸附剂对重金属铬的吸附和移除作用,其吸附量可达232.55 mg/g。石墨烯和分子印迹的高分子材料复合使目标物的吸附和分离更加高效和有针对性。Ye等[49]将石墨烯和多巴胺的分子印迹材料复合,成功用于血清中多巴胺的检测。石墨烯-壳聚糖复合材料是近年来研究较多的一类吸附材料,广泛用于金属离子[50]、染料[51]和农药[52]的吸附、移除和检测。
总之,无论是石墨烯、官能化石墨烯,还是石墨烯类复合材料,均存在高比表面积和碳六元环结构的共性,故对重金属、农兽药、生物毒素及食品和农产品中的非法添加物具有良好的吸附能力。在此基础上,官能化石墨烯和石墨烯类复合材料因其修饰的基团和复合物的独特性能,对目标物的吸附能力更强,更易应用于样品前处理技术中。
2 石墨烯类纳米材料在真菌毒素检测样品前处理中的应用
2.1 基于石墨烯类纳米材料的样品前处理技术
石墨烯类纳米材料在样品前处理技术中的应用,按样品前处理方法大致可分成以下几类。
2.1.1 固相萃取(Solid-phase extraction,SPE)SPE是基于液-固相色谱理论的样品前处理技术。石墨烯的疏水特性及高比表面积,使得其在固相萃取有机农药、重金属和真菌毒素方面展现出良好的应用前景。Han等[53]将石墨烯作为吸附剂与气相色谱-质谱(GC-MS)联用检测苹果汁中的有机磷农药,实验结果表明,制备的SPE净化柱在果汁样品的前处理中可反复使用。氧化石墨烯虽然有强亲水性,但与固相材料复合后,同样可用于固相萃取中。Pourjavid等[54]以乙酰氨基硫苯酚为螯合剂制备了氧化石墨烯的SPE柱,该柱对重金属铅和镉的富集率可高达250倍,与火焰原子吸收光谱仪联用后对水、草本和鱼类样品中的铅和镉进行定量测定,回收率为99.4%~103.5%。本课题组用GO-SiO2复合材料作为SPE吸附剂,通过优化条件建立最佳SPE萃取方法,成功与液相色谱(HPLC)联用检测了植物油中的黄曲霉毒素B1和B[55]2。当前的固相萃取方法正朝着微型化方向发展,通过使用少量有机溶剂和样液而实现高效快速分离已成为SPE技术研究的新趋势。Yan等[56]率先报道了石墨烯类纳米材料在微型化固相萃取中的应用。以3 mg石墨烯为吸附剂,将1个100 μL和1 mL的枪头组装成一微型固相萃取柱(M-G-PTE柱),通过优化实验条件,建立了石墨烯微型化固相萃取方法(如图2A),并成功与HPLC联用实现了牛奶样品中磺胺类药物残留的精确定量。Zhang等[57]将丙烯酰胺修饰的石墨烯作为吸附剂制备SPE微柱(如图2B),将微柱用于在线μ-SPE-HPLC检测系统中,成功建立了食品中杂环胺的分析方法。

图2 石墨烯及其衍生物用于微型化固相萃取示意图Fig.2 Schematic illustration of μSPE using G and its derivatives
2.1.2 磁固相萃取(Magnetic solid phase extraction,MSPE)MSPE是在固相萃取基础上发展的一种利用磁性纳米材料实现快速磁分离的样品前处理方法。磁性石墨烯材料作为磁固相萃取的吸附剂,在农产品质量安全检测研究中有着广泛应用。Ma等[58]在以Fe3O4为核,SiO2为壳的核壳纳米材料Fe3O4@SiO2外包覆上石墨烯作为吸附剂,建立MSPE方法对梨和西红柿样品中的4种烟碱类农药进行同时萃取,回收率可达93.1%~107.4%。Es'haghi等[31]将Fe3O4颗粒沉积在石墨烯上,制备出磁性石墨烯吸附材料,并成功用于食品样品中黄曲霉毒素B1,B2,G1和G2的吸附分离。
2.1.3 分散固相萃取(Dispersive solid phase extraction,dSPE) dSPE也是一种常用的萃取方法,该方法使用分散的萃取吸附剂提取和净化样品中的目标物,由于其操作简便而正日趋普及。近年来,石墨烯类纳米材料也被作为dSPE的吸附剂。Sereshti等[59]将水溶性的氧化石墨烯分散在样品溶液中,然后采用超声辅助其吸附和脱附目标物,成功地实现了对茶饮中可可碱、咖啡因和茶碱的定量检测。Liu等[60]用一种类似QuEChERS的前处理方法,将石墨烯、仲胺(PSA)和石墨炭黑作为dSPE的萃取材料净化样品,通过与液相色谱-质谱仪联用快速检测了茶叶中的25种农药残留。本课题组[61]将GO溶液分散到花生样品的提取液中,萃取花生中的黄曲霉毒素B1,B2,G1和G2,通过优化萃取条件,建立了基于氧化石墨烯萃取的花生中黄曲霉毒素的高效液相色谱分析方法。
2.1.4 固相微萃取(Solid phase micro-extraction,SPME)SPME是20世纪90年代开发的一种非溶剂型选择性萃取方法,通常用于各类挥发或半挥发性物质的检测。SPME的萃取过程一般通过一根石英纤维完成。石墨烯及其衍生物作为涂层材料涂于纤维表面,能快速、有选择性地吸附待测目标物。Wang等[62]用一种亲水的磺酸化石墨烯作为SPME材料涂镀在电极上,然后通过构建的鲁米诺电化学发光传感器精确测定了被石墨烯选择性吸附的敌草胺,检出限达1.0 μg/L。搅拌棒吸附萃取(Stir bar sorptive extraction,SBSE)是一种新发展的固相微萃取方法,因研究发展年限短,石墨烯在此技术上的应用鲜有报道。2014年,Zhang等[63]首次将仿生的聚多巴胺修饰到一种很好的搅拌棒吸附萃取基材——不锈钢丝上,然后通过将氧化石墨烯的羟基与聚多巴胺的氨基偶联,使氧化石墨烯附着在不锈钢丝表面,制备出SBSE萃取搅拌棒。为增加目标物的萃取量,石墨烯可以多次涂覆,然后通过优化SBSE的萃取条件,实现对环境和食品样品中多环芳烃的检测。这种石墨烯材料的搅拌棒在SBSE萃取过程中具有良好的稳定性和易于有机溶剂超声解脱附的特性。
2.1.5 基质固相分散萃取(Matrix solid phase dispersion,MSPD)MSPD是一种兴起20多年的快速样品处理技术,适用于固体、半固体或粘稠样品的萃取。一般的萃取过程是将吸附剂和样品充分混合碾磨,然后将研磨好的样品放入空的SPE柱或注射针筒中,选择合适溶剂进行洗脱,最后收集滤液进行分析。石墨烯作为吸附剂早在2011年就被Liu等[64]用于基质固相分散萃取土壤、树皮和鱼肉中的多溴联苯醚及其甲基化和羟基化的类似物。目前,基于石墨烯类纳米材料的MSPD技术在毒素检测中的应用尚未见报道。
2.2 基于石墨烯前处理方法的真菌毒素检测的研究进展
目前已知的真菌毒素有300多种,对人和动物健康危害较大,对粮油食品污染严重的真菌毒素主要有十几种,包括黄曲霉毒素、赭曲霉毒素、玉米赤霉烯酮和呕吐毒素等。真菌毒素检测的前处理方法主要有液-液萃取、固相萃取及免疫亲和柱净化。液-液萃取对人员危害大,目前已被淘汰。固相萃取及免疫亲和柱法则各有优缺点。随着石墨烯吸附材料的发展,基于石墨烯类纳米材料前处理方法的真菌毒素检测研究已成为目前毒素检测研究领域的热点(见表1)。

表1 石墨烯类纳米材料样品前处理方法在真菌毒素检测中的应用Table 1 Applications of graphene-based sample preparation methods in the analysis of mycotoxins

(续表1)
黄曲霉毒素是目前发现的真菌毒素中毒性最强的一类,对其检测方法的研究一直是真菌毒素检测研究的重点。黄曲霉毒素的基本化学结构为1个双呋喃环和1个氧杂萘邻酮[67]。石墨烯类纳米材料的碳六元环结构与黄曲霉毒素分子相似,基于π-π共轭作用可以使黄曲霉毒素小分子很容易地吸附到石墨烯类纳米材料上。本课题组研究结果印证了上述理论[23],氧化石墨烯对黄曲霉毒素B1的最大吸附量可达到62.5 ng/mg,并且吸附容量不受黄曲霉毒素B2的影响。在此基础上,本课题组采用优选片层的氧化石墨烯作为有效吸附剂用于吸附4种花生样液中常见的黄曲霉毒素,并与高效液相色谱联用实现了对花生中黄曲霉毒素的定量检测[61],4种黄曲霉毒素的检出限为0.08~0.65 ng/g,样品的加标回收率为85.1%~100.8%。为解决氧化石墨烯分离困难和碎片残留的问题,本课题组[55]随后又制备出氧化石墨烯-二氧化硅复合材料(SiO2-GO),并用于植物油中黄曲霉毒素B1和B2的吸附,该复合材料具有分离快速,可重复使用的特性。通过优化SPE条件,建立了基于SiO2-GO的黄曲霉毒素SPE/HPLC检测方法,在油脂的实际样品检测中,其加标回收率可达到80%以上。除了GO和SiO2-GO,磁性石墨烯也作为一个重要的吸附剂被用于黄曲霉毒素的检测。Gan等[65]最先将氧化石墨烯和磁性四氧化三铁的复合材料用于吸附黄曲霉毒素。实验结果表明,这种吸附剂可在pH 3.0~8.0的溶液环境中快速(10 min)、有选择性地吸附黄曲霉毒素M1(ATM1),吸附率达到95%。随之建立的基于“三明治”式免疫反应的电化学发光免疫传感器,可利用具有荧光特性的量子点标记的毒素抗体与吸附剂上的ATM1发生免疫反应,形成“三明治”免疫复合体,再以电化学发光免疫分析法(ECLIA)定量检测牛奶样品中ATM1,检出限可达0.3 pg/mL,检测示意图如图3所示。Es'haghi等[31]通过在二价铁和三价铁的碱性溶液中加入石墨烯制备出磁性石墨烯材料G-Fe3O4,并用于MSPE实现液体中黄曲霉毒素的萃取。基于该材料的MSPE方法比使用免疫亲和柱净化的方法更简便快速:10 mg吸附材料与含有黄曲霉毒素的样液混合,在15 min内达到吸附平衡,通过磁铁可在3 min内实现快速分离,最终用2 mL乙腈-水溶液(1∶1)混合2 min完成洗脱,进入HPLC进行检测。这种MSPE/HPLC方法已成功用于多种实际样品(如大米、芝麻和小麦)中黄曲霉毒素的检测。比较上述黄曲霉毒素检测方法,不难发现,较GO或其它石墨烯类固相萃取材料,磁性石墨烯纳米材料在萃取毒素方面更高效,另一方面,在相同的前处理条件下,相比传统的仪器检测方法(如HPLC),新兴的免疫检测方法(如ECLIA)在毒素检测的灵敏度上则更有优势。
赭曲霉毒素A(Ochratoxin A,OTA)是青霉属和曲霉属菌株产生的一种有毒的真菌次级代谢产物,具有肾脏毒性、肝脏毒性,可致癌、致突变,被国际癌症研究机构列为Ⅱ类致癌物。丁俭[66]将羟基化四氧化三铁和氧化石墨烯溶于二甲基亚砜中,在室温下超声得到可吸附OTA的石墨烯纳米材料。将上述材料与二氯甲烷稀释的食用油混合,待OTA被吸附到磁性氧化石墨烯的表面后,通过外加磁场收集吸附材料。最后,以甲醇溶液解吸,收集上清液进行HPLC分析。将这种可用于食用油中OTA定量检测的新方法和SN/T 1746-2006中的免疫亲和柱层析液相色谱法进行比对,新方法的重复稳定性优于标准方法。
目前已报道的能被石墨烯类纳米材料吸附的真菌毒素类型只有黄曲霉毒素和OTA。科学界普遍认为石墨烯片层的碳六元环与真菌毒素分子中共有的芳香环形成π-π共轭是其能吸附真菌毒素的主要原因。而基于修饰石墨烯纳米材料检测真菌毒素,目前还只停留在以磁分离手段将毒素从复杂基质中快速萃取的阶段,针对特定种类的真菌毒素的分子结构,修饰石墨烯类纳米材料以提高其吸附萃取能力的研究还未见报道。
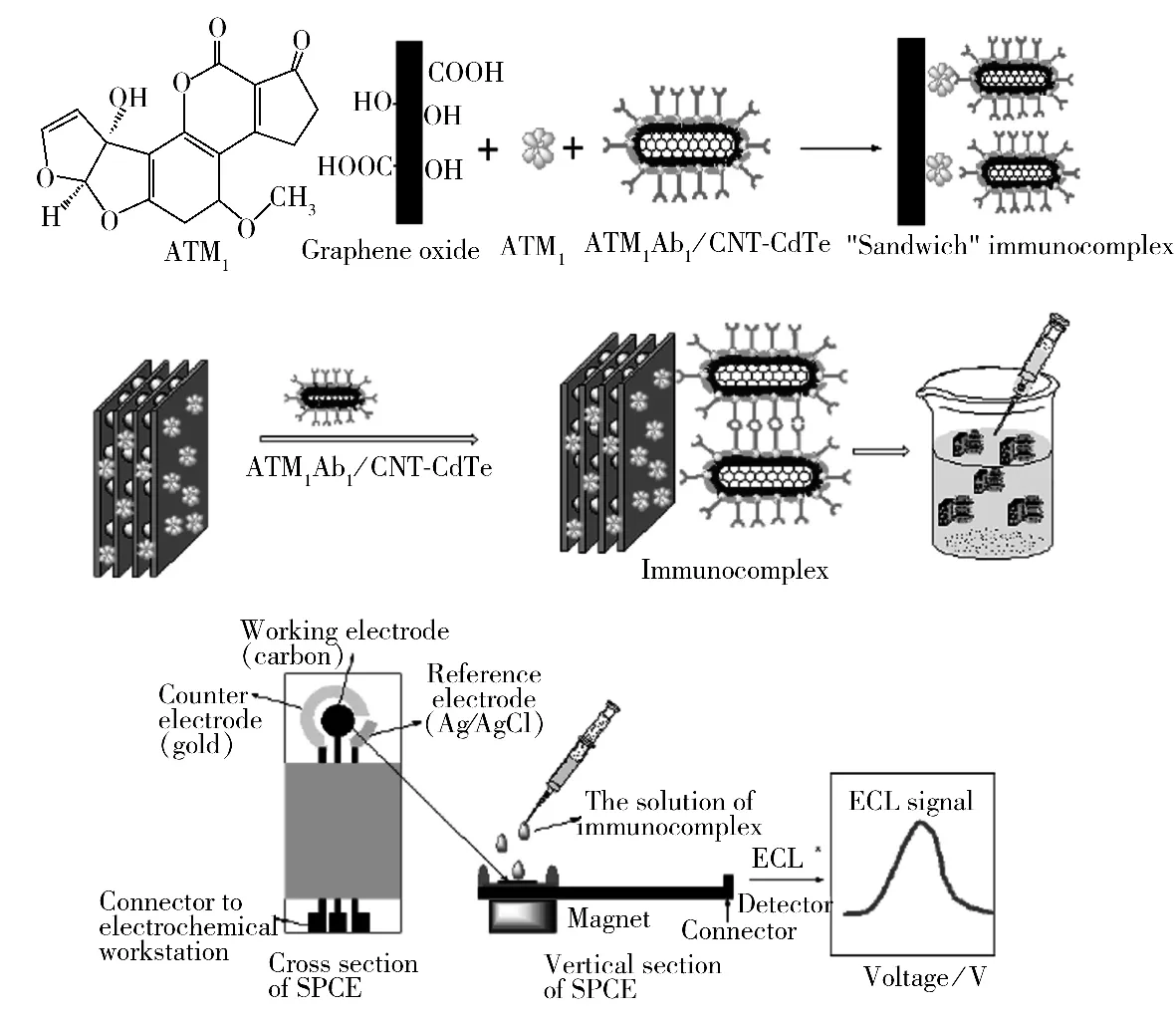
图3 三明治式免疫法检测ATM1示意图[65]Fig.3 Schematic illustration for detection of ATM1by the sandwich immunoassay[65]
3 问题与展望
近年来,石墨烯类纳米材料作为吸附剂被广泛用于样品前处理方法研究,经过优化的相关前处理方法在真菌毒素检测中也有了一定应用,这大大丰富了真菌毒素检测技术体系,对农产品质量安全监管起到了积极作用。但是,因为石墨烯材料制备至今仅十年时间,所以其应用研究还处于方兴未艾的阶段。就目前的发展状况而言,其可能的发展趋势和方向有以下3个方面:
(1)石墨烯类吸附材料体系将不断丰富,其分类的界限将越来越模糊。为了满足不同前处理方法的应用需求,石墨烯类吸附材料正向多元化方向发展,例如作为吸附剂的磁性壳聚糖-氧化石墨烯复合材料[68]已经无法归类为石墨烯-金属及其氧化物复合材料或石墨烯-高分子复合材料中的任何一类。越来越多的石墨烯复合材料被制备出,以满足其吸附特定目标物和样品前处理方法的应用需求。
(2)石墨烯类纳米材料在先进样品前处理技术中的应用将继续拓宽。搅拌棒吸附萃取(SBSE)作为在固相微萃取基础上发展的一种新的前处理方法与石墨烯类纳米材料的结合应用还不多见。而类似的其他先进样品前处理技术,如纤维针式固相微萃取(Fiber SPME)、管内固相微萃取(In-tube SPME)等,采用石墨烯类纳米材料作为吸附剂的应用研究更是凤毛麟角。但随着前处理方法的不断推陈出新,加上石墨烯类吸附材料的多元化发展,两者的结合必将成为未来分析研究领域的新热点。
(3)前处理方法在真菌毒素检测中的应用将朝着开发多种检测方式和检测多种毒素的方向发展。目前基于石墨烯类纳米材料前处理方法的真菌毒素的检测对象仅局限于黄曲霉毒素和赭曲霉毒素,对于其他毒素的应用研究未见报道。因此,未来的发展方向是探讨这类吸附材料对其他毒素的吸附特性和前处理方法,以实现更多毒素的检测。在此基础上,还可探索基于石墨烯类纳米材料前处理方法的多种毒素同步检测的方法研究。
[1]Battin J.Hist.Sci.Med.,2010,44(4):373 -382.
[2]Nesbitt B F,O'Kelly J,Sargeant K,Sheridan A.Nature,1962,195:1062 -1063.
[3]GB 2761-2011.Mycotoxin Detection Limits in Food.National Standards of the People's Republic of China(食品中真菌毒素限量.中华人民共和国国家标准).
[4]Wang X P,Li P W,Yang Y,Zhang W,Zhang Q,Fan S F,Yu L,Wang L,Chen X M,Li Y,Jiang J.Chin.J.Chromatogr.(王秀嫔,李培武,杨杨,张文,张奇,范素芳,喻理,王琳,陈小媚,李英,姜俊.色谱),2011,29:517-522.
[5]Zhang D H,Li P W,Zhang Q,Zhang W,Huang Y L,Ding X X,Jiang J.Anal.Chim.Acta,2009,636:63-69.
[6]Zhang D H,Li P W,Zhang Q,Zhang W.Biosens.Bioelectron.,2011,26:2877-2882.
[7]Li X,Li P W,Zhang Q,Li Y Y,Zhang W,Ding X X.Anal.Chem.,2012,84:5229-5235.
[8]Wang Y R,Wang H,Li P W,Zhang Q,Kim H J,Gee S J,Hammock B D.J.Agric.Food Chem.,2013,61:2426-2433.
[9]Cui Y H,Yao W X,Zhang S L,Wang H D,Zhong F F.J.Instrum.Anal.(崔艳华,姚伟宣,张素玲,王海栋,钟芳芳.分析测试学报),2015,34(4):375-380.
[10]Wang S H,Niu H Y,Cai Y Q.J.Instrum.Anal.(王赛花,牛红云,蔡亚岐.分析测试学报),2015,34(2):127-133.
[11]Yang J,Liu Z M,Zhan H J,Wang Z L.J.Instrum.Anal.(杨君,刘志敏,展海军,王珍玲.分析测试学报),2014,33(4):403-408.
[12]Li C L,Zhu X,Xu M T.J.Instrum.Anal.(李春兰,朱旭,徐茂田.分析测试学报),2013,32(12):1497-1501.
[13]Zhang B T,Zheng X,Li H F,Lin J M.Anal.Chim.Acta,2013,784:1-17.
[14]Geim A K,Novoselov K S.Nat.Mater.,2007,6:183 -191.
[15]Kocot K,Sitko R.Spectrochim.Acta B,2014,94/95:7-13.
[16]Apul O G,Wang Q L,Zhou Y,Karanfil T.Water Res.,2013,47:1648 -1654.
[17]Han Q,Wang Z H,Xia J F,Xia L H,Chen S,Zhang X Q,Ding M Y.J.Sep.Sci.,2013,36:3586 -3591.
[18]Chen L Y,Zhou T,Zhang Y P,Lu Y B.Anal.Methods,2013,5:4363 -4370.
[19]Shen Q,Gong L K,Baibado J T,Dong W,Wang Y X,Dai Z Y,Cheung H Y.Talanta,2013,116:770-775.
[20]Dreyer D R,Park S,Bielawski C W,Ruoff R S.Chem.Soc.Rev.,2010,39:228 -240.
[21]Cote L J,Kim F,Huang J X.J.Am.Chem.Soc.,2008,131(3):1043 -1049.
[22]Gao Y,Li Y,Zhang L,Huang H,Hu J J,Shah S M,Su X G.J.Colloid Interface Sci.,2012,368:540-546.
[23]Yu L,Li P W,Chen X M,Hu X F,Wang X F.Chin.J.Oilcrop Sci.(喻理,李培武,陈小媚,胡小风,汪雪芳.中国油料作物学报),2013,35:432-435.
[24]Fang F,Kong L T,Huang J R,Wu S B,Zhang K S,Wang X L,Sun B,Jin Z,Wang J,Huang X J,Liu J H.J.Hazard.Mater.,2014,270:1 -10.
[25]Gao W,Majumder M,Alemany L B,Narayanan T N,Ibarra M A,Pradhan B K,Ajayan P M.ACS Appl.Mater.Interfaces,2011,3:1821-1826.
[26]Liu Q,Shi J B,Sun J T,Wang T,Zeng L X,Jiang G B.Angew.Chem.Int.Ed.,2011,50:5913-5917.
[27]Li P W,Yu L,Zhang Q,Ding X X,Zhang W,Ma F,Zhang Z W.China Patent(李培武,喻理,张奇,丁小霞,张文,马飞,张兆威.中国专利),ZL 201210502692.0.2013.
[28]Dichiara A B,Sherwood T J,Benton -Smith J,Wilson J C,Weinstein S J,Rogers R E.Nanoscale,2014,6:6322 -6327.
[29]Bian Z Q,Fan W,Tian X H,Luo Q,Zhang J.J.Anal.Sci.(卞战强,樊伟,田向红,罗庆,张娟.分析科学学报),2013,29:535-538.
[30]Wang C B,Zhou J W,Ni J,Cheng Y L,Li H.Chem.Eng.J.,2014,253:130 -137.
[31]Es'haghi Z,Beheshti H R,Feizy J.J.Sep.Sci.,2014,37:2566 -2573.
[32]Li J,Zhang S W,Chen C L,Zhao G X,Yang X,Li J X,Wang X K.ACS Appl.Mater.Interfaces,2012,4:4991-5000.
[33]Chandra V,Park J,Chun Y,Lee J W,Hwang I C,Kim K S.ACS Nano,2010,4:3979-3986.
[34]Zhao G Y,Song S J,Wang C,Wu Q H,Wang Z.Anal.Chim.Acta,2011,708:155-159.
[35]Li Z,Bai S S,Hou M Y,Wang C,Wang Z.Anal.Lett.,2013,46:1012 -1024.
[36]Hao L,Wang C H,Ma X X,Wu Q H,Wang C,Wang Z.Anal.Methods,2014,6:5659-5665.
[37]Shi P Z,Ye N S.Anal.Methods,2014,6:9725 -9730.
[38]Sergi A,Shemirani F,Alvand M,Tajbakhshian A.Anal.Methods,2014,6:7744-7751.
[39]Aguiar A L,Fagan S B,da Silva L B,Mendes Filho J,Souza Filho A G.J.Phys.Chem.C,2010,114:10790-10795.
[40]Xu C,Cui A J,Xu Y L,Fu X Z.Carbon,2013,62:465 -471.
[41]Gu X W,Lü X J,Jia Q,Zhou W H,Liu Y L.Chin.J.Anal.Chem.(谷晓稳,吕学举,贾琼,周伟红,刘云凌.分析化学),2013,41:417-421.
[42]Yuan X Y,Wang Y F,Wang J,Zhou C,Tang Q,Rao X B.Chem.Eng.J.,2013,221:204 -213.
[43]Yang Z,Ji S S,Gao W,Zhang C,Ren L L,Tjiu W W,Zhang Z,Pan J S,Liu T X.J.Colloid Interface Sci.,2013,408:25-32.
[44]Wang J F,Tsuzuki T,Tang B,Sun L,Dai X J,Rajmohan G D,Li J L,Wang X G.Aust.J.Chem.,2014,67:71-77.
[45]Wu Z M,Zhang L,Guan Q,Ning P,Ye D Q.Chem.Eng.J.,2014,258:77-84.
[46]Bian X J,Lu X F,Xue Y P,Zhang C C,Kong L R,Wang C.J.Colloid Interface Sci.,2013,406:37 -43.
[47]Ren Y M,Yan N,Feng J,Ma J,Wen Q,Li N,Dong Q.Mater.Chem.Phys.,2012,136:538 -544.
[48]Kumar A S K,Kakan S S,Rajesh N.Chem.Eng.J.,2013,230:328 -337.
[49]Ye N S,Gao T,Li J.Anal.Methods,2014,6:7518 -7524.
[50]He Y Q,Zhang N N,Wang X D.Chin.Chem.Lett.,2011,22:859 -862.
[51]Fan L L,Luo C N,Sun M,Qiu H M,Li X J.Colloids Surf.B,2013,103:601-607.
[52]Yang S L,Luo S L,Liu C B,Wei W Z.Colloids Surf.B,2012,96:75-79.
[53]Han Q,Wang Z H,Xia J F,Zhang X Q,Wang H W,Ding M Y.J.Sep.Sci.,2014,37:99-105.
[54]Pourjavid M R,Arabieh M,Sehat A A,Rezaee M,Hosseini M H,Yousefi S R,Jamali M R.J.Brazilian Chem.Soc.,2014,25:2063-2072.
[55]Wang H L,Yu L,Li P W,Li M,Zhang Q,Zhang W.Chin.J.Anal.Chem.(王恒玲,喻理,李培武,李敏,张奇,张文.分析化学),2014,42:1338-1342.
[56]Yan H Y,Sun N,Liu S J,Row K H,Song Y X.Food Chem.,2014,158:239-244.
[57]Zhang Q C,Li G K,Xiao X H.Talanta,2015,131:127-135.
[58]Ma X X,Wang J T,Sun M,Wang W N,Wu Q H,Wang C,Wang Z.Anal.Methods,2013,5:2809-2815.
[59]Sereshti H,Khosraviani M,Samadi S,Amini-Fazl M S.RSC Adv.,2014,4:47114 -47120.
[60]Liu X,Guan W B,Hao X H,Wu X L,Ma Y Q,Pan C P.Chromatographia,2014,77:31-37.
[61]Yu L,Li P W,Zhang Q,Zhang W,Ding X X,Wang X P.J.Chromatogr.A,2013,1318:27-34.
[62]Wang S R,Wang S,Guo Z Y.Electroanalysis,2014,26:849-855.
[63]Zhang W P,Zhang Z X,Zhang J,Meng J W,Bao T,Chen Z L.J.Chromatogr.A,2014,1351:12-20.
[64]Liu Q,Shi J B,Sun J T,Wang T,Zeng L X,Zhu N L,Jiang G B.Anal.Chim.Acta,2011,708:61-68.
[65]Gan N,Zhou J,Xiong P,Hu F T,Cao Y T,Li T H,Jiang Q L.Toxins,2013,5:865 -883.
[66]Ding J.Study on the Determination of Aflatoxin M1in Milk and Ochratoxin A in Vegetable Oils.Beijing:Chinese Academy of Agricultural Sciences(丁俭.牛奶中黄曲霉毒素M1和食用植物油中赭曲霉毒素A检测技术研究.北京:中国农业科学院),2013.
[67]Ayres J L,Lee D J,Wales J H,Sinnhuber R O.J.Natl.Cancer Inst.,1971,46:561 -564.
[68]Fan L L,Luo C N,Sun M,Li X J,Lu F G,Qiu H M.Bioresour.Technol.,2012,114:703-706.
