HZSM-5催化乙酸环己酯水解反应
2014-12-31靳敬敬杨丽红张东升王延吉
靳敬敬,李 芳,杨丽红,张东升,薛 伟,王延吉
(河北工业大学 化工学院 河北省绿色化工与高效节能重点实验室,天津 300130)
环己醇是生产己二酸、己内酰胺等重要化工产品的中间原料,目前工业上主要采用环己烷氧化法进行生产。该工艺中采用的氧化剂是空气,易与原料形成爆炸混合物,存在安全隐患;该工艺还有选择性差、转化率低、能耗高等缺点[1]。日本Asahi公司开发了以苯为原料,经选择加氢制备环己烯,再经环己烯水合制备环己醇的工艺[2]。该方法所涉及的反应均属于原子经济反应,在物耗、能耗、安全等方面具有明显的优势。但是,由于环己烯与水相互溶解性能较差,水合反应速率较慢,并且受到热力学限制,环己烯单程转化率仅为12%左右[3]。
将环己烯与羧酸(如甲酸、乙酸等)反应生成相应的环己基羧酸酯,再经水解反应制备环己醇,可以克服环己烯直接水合过程的缺点,获得较高的环己醇收率[4]。该过程可称之为环己烯间接水合反应,如式(1)所示。
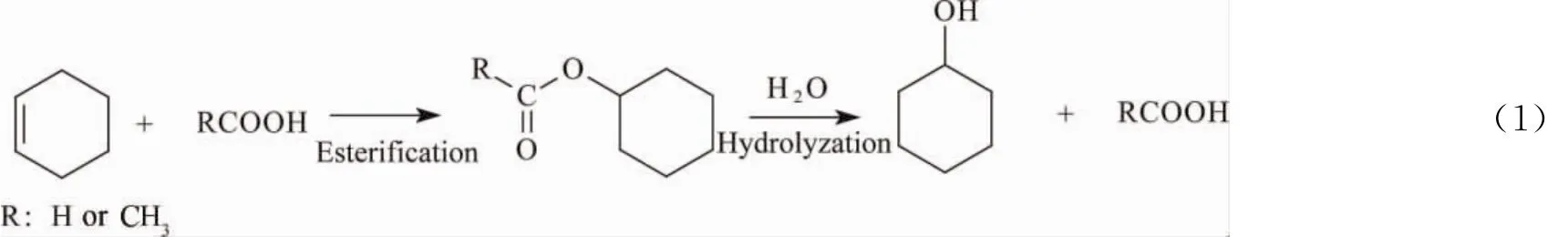
Steyer等[5-7]在塔式反应器中使用离子交换树脂催化剂,研究了由环己烯经甲酸环己酯间接水合制备环己醇过程。经过模拟认为,可以将环己烯接近100%的转化为环己醇。杜文明等[8]采用间歇釜式反应器研究了由环己烯经甲酸环己酯制备环己醇的催化反应,分别考察了环己烯与甲酸酯化反应和甲酸环己酯水解反应的影响因素,优化了反应条件;由环己烯经甲酸环己酯“一锅法”制备环己醇催化反应,环己醇收率最高可达40%,远高于环己烯直接水合反应。Imam等[4]对经由甲酸环己酯的环己烯间接水合过程进行了评估,认为该过程的能耗远低于Asahi的环己烯直接水合工艺,非常有发展前景。此外,Chakrabarti等[9]开发了以环己烯为原料,经由乙酸环己酯制备环己醇的方法。他们使用乙酸与环己烯反应生成乙酸环己酯,然后再将乙酸环己酯与正丁醇发生酯交换反应生成环己醇,同时还得到副产物乙酸丁酯。杨丽红[10]考察了由环己烯经乙酸环己酯间接水合制备环己醇反应,发现HZSM-5可以高效地催化环己烯与乙酸的酯化反应,在优化的条件下,环己烯转化率为69.1%,乙酸环己酯选择性可达98.3%。但是,在第二步反应,即乙酸环己酯水解反应中主要产物是环己烯,环己醇选择性仅为30.4%。此外,杨丽红还发现,使用酸性离子液体[HSO3bmim]HSO4作为催化剂时,乙酸环己酯的热分解反应得到抑制,环己醇的选择性可达65.1%,但离子液体的用量较大。目前,关于乙酸环己酯水解反应的研究较少,并且大都作为模型反应来考察催化剂的性能,对于反应的影响因素,特别是对于副反应几乎没有相关报道。
笔者以HZSM-5分子筛为催化剂,采用间歇釜式反应器进行乙酸环己酯水解反应,考察了反应温度的影响,分析了产物中环己烯的来源;采用离子液体[HSO3bmim]HSO4作为助催化剂,考察了其对乙酸环己酯水解反应的影响,并考察了催化剂的稳定性。
1 实验部分
1.1 试剂及催化剂
乙酸环己酯,Acros产品;N-甲基咪唑,临海市凯乐化工有限公司产品;1,4-丁烷磺内酯,武汉风帆化工有限公司产品;甲苯、乙醚、浓硫酸,天津科瑞思精细化工有限公司产品。
HZSM-5,南开大学催化剂厂产品,n(SiO2)/n(Al2O3)=25。
1.2 离子液体1-(丁基-4-磺酸基)-3-甲基咪唑硫酸氢盐([HSO3bmim]HSO4)的合成[11]
1.2.1 1-(丁基-4-磺酸基)咪唑盐的制备
在无溶剂条件下,将等摩尔的N-甲基咪唑和1,4-丁烷磺内酯在三口烧瓶中混合,40℃搅拌反应12h,制得1-(丁基-4-磺酸基)咪唑盐,将生成物用甲苯、乙醚分别洗涤3次提纯,并进行真空干燥。
1.2.2 [HSO3bmim]HSO4的制备
将制得的1-(丁基-4-磺酸基)咪唑盐与等摩尔的浓硫酸混合,搅拌反应直至1-(丁基-4-磺酸基)咪唑盐全部溶解。生成的粗产品用甲苯、乙醚分别洗涤3次,并真空干燥,得到[HSO3bmim]HSO4。
所得样品经1H NMR(300MHz,DMSO-d6,TMS)鉴定。其δ值分别为1.567(m,2H,—CH2—)、1.997(m,2H,—CH2—)、2.599(t,2H,—CH2—)、3.871(s,3H,—CH3—)、4.202(t,2H,—CH2—)、7.735(s,1H,N═HC C)、7.793(s,1H,═C CH—N)、9.194(s,1H,N═CH N)。
1.3 催化剂活性评价及产物分析
将一定量的乙酸环己酯、去离子水和HZSM-5催化剂及[HSO3bmim]HSO4置入反应釜中,密封后用N2置换体系中的空气。然后搅拌同时升温至设定温度。反应一定时间后停止加热,并用冰水浴冷却反应釜至室温,泄压。过滤除去反应体系中的催化剂,并取上层油相进行气相色谱分析。
相对与初中,小学数学课堂。教师讲得慢、细,练得多。直观性强;而初中教师讲得精,练得少,抽象性也比较强。小学生是以机械记忆、直观形象思维为主。因此,进入初中后,我们必须结合学生的特点,从学生的认知规律出发,快速地改进教法,搞好教学方法上的过渡。
使用北京北分瑞利分析仪器有限公司SP-3420型气相色谱对产物进行定性定量分析。PEG-20M毛细管色谱柱(30m×0.25mm),程序升温,初始温度 80℃,以 10℃/min 升 温 至 200℃,保 持20min;氢火焰离子检测器(FID),检测器温度200℃,汽化室温度200℃,载气+补充气流速30mL/min,进样量0.2μL,分流比1/20。
1.4 催化剂的FT-IR表征
采用NICOLET公司NEXUS 470型傅里叶变换红外光谱仪,测定反应前后HZSM-5催化剂的FT-IR谱。KBr压片制样,扫描范围4000~400cm-1。
2 结果与讨论
2.1 HZSM-5催化乙酸环己酯水解反应
考察了不同反应条件下不同量HZSM-5催化乙酸环己酯水解反应的转化率和产物选择性,结果列于表1。
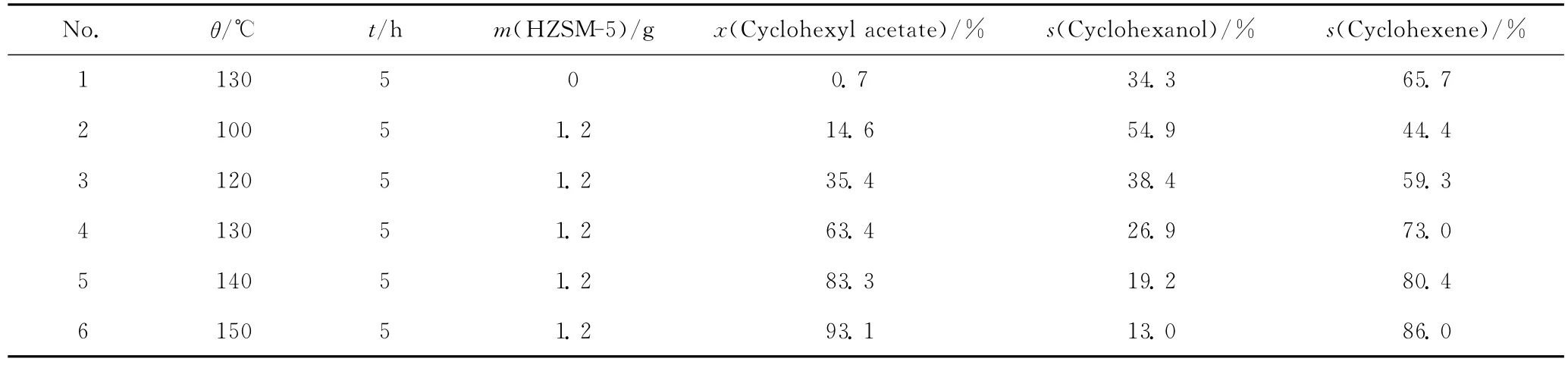
表1 不同反应条件下不同量HZSM-5催化乙酸环己酯水解反应的转化率和产物选择性Table 1 Conversion and product selectivity of cyclohexyl acetate hydrolyzation over HZSM-5catalyst at different reaction conditions
由表1可知,当不使用催化剂时,乙酸环己酯水解反应转化率仅为0.7%,并且产物中环己醇选择性也仅为34.3%,大部分转化的乙酸环己酯生成了环己烯。HZSM-5质量为1.2g(表1中No.4)时,乙酸环己酯转化率大幅度增加至63.4%,但产物中环己醇选择性较不使用催化剂时反而有所降低,说明HZSM-5更有利于促进环己烯的生成。
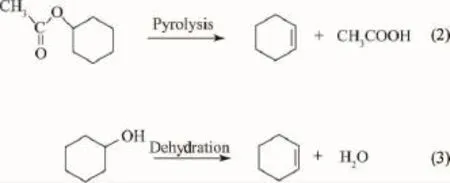
由式(1)可知,乙酸环己酯水解反应仅能得到环己醇。上述反应产物中的环己烯可能有2个来源,一是乙酸环己酯的热分解,另一个是生成的环己醇脱水,反应如式(2)和(3)所示。为了验证环己烯的来源,考察了HZSM-5催化环己醇脱水反应,结果是,在相近反应条件下(130℃,5h,环己醇15mL,HZSM-5 1.2g),环己烯收率仅为5.8%。在本实验的富水环境中,环己醇发生脱水反应的几率更小。Adams等[12]研究了环己基酯在催化剂作用下生成环己烯的反应过程,认为环己基酯的顺式热解比环己醇的反式脱水更有利。因此,乙酸环己酯水解反应副产物环己烯主要来自乙酸环己酯的热分解反应。
由表1还看到,较高的反应温度有利于乙酸环己酯的转化。当反应温度为150℃时,乙酸环己酯转化率可达93.1%,但环己醇选择性仅为13.0%,大部分乙酸环己酯发生了热分解反应生成了环己烯;反应温度为100℃时,环己醇选择性为54.9%,但此时乙酸环己酯转化率仅为14.6%,也不利于反应的进行。因此,应选择合适的反应温度,以得到适宜的反应速率,同时采取其他措施来抑制乙酸环己酯热分解反应,提高环己醇的选择性。
2.2 HZSM-5+ [HSO3bmim]HSO4 催化乙酸环己酯水解反应
根据杨丽红[10]的研究结果,在乙酸环己酯水解反应中可使用酸性离子液体[HSO3bmim]HSO4作为催化剂,但用量较大。而且离子液体的制备过程复杂,成本较高,因此拟将其作为助催化剂,与HZSM-5一起用于乙酸环己酯水解反应,希望能同时得到较高的转化率和环己醇选择性。图1为离子液体[HSO3bmim]HSO4用量对乙酸环己酯水解反应转化率和环己醇选择性的影响。由图1可知,反应体系中加入[HSO3bmim]HSO4后,乙酸环己酯转化率和环己醇选择性都明显提高。当[HSO3bmim]HSO4加入量为1g时,乙酸环己酯转化率为81.6%,此时环己醇选择性达79.7%,较二者单独使用时均有所提高。继续增加[HSO3bmim]HSO4用量,乙酸环己酯转化率基本不变,而环己醇选择性则先小幅度增加后下降,但变化幅度不大。由于[HSO3bmim]HSO4加入量较少,并且其用量的多少对乙酸环己酯转化率影响不明显,因此推测,[HSO3bmim]HSO4主要起到了抑制乙酸环己酯热分解反应的作用,从而提高了环己醇的选择性。

图1 离子液体[HSO3bmim]HSO4用量对HZSM-5催化乙酸环己酯水解反应转化率和环己醇选择性的影响Fig.1 Effect of[HSO3bmim]HSO4dosage on conversion and cyclohexanol selectivity of cyclohexyl acetate hydrolyzation over HZSM-5catalyst
2.3 HZSM-5催化乙酸环己酯水解反应的重复使用性能
为了考察HZSM-5催化剂体系的重复使用性能,将其过滤、干燥后,再次用于催化乙酸环己酯水解反应,结果如图2所示。由图2可知,当HZSM-5重复第6次使用时,乙酸环己酯转化率和环己醇选择性分别为81.2%和85.4%,与新鲜催化剂性能几乎没有差别。杜文明等[8]在考察HZSM-5催化环己烯经甲酸环己酯制备环己醇反应时发现,由于积炭作用,HZSM-5催化剂活性随着使用次数的增加逐渐下降;第4次循环使用时,催化活性仅为新鲜催化剂的一半左右。本研究中HZSM-5催化剂优异的稳定性则可能是由于离子液体助剂所具有的良好溶解性能,可以在反应过程中将覆盖在催化剂活性中心上的有机物溶解,从而保持了其催化性能。
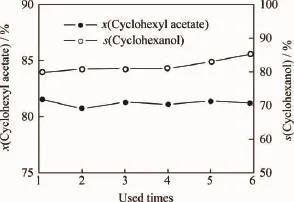
图2 HZSM-5催化乙酸环己酯水解反应的重复使用性能Fig.2 Catalytic stability of HZSM-5in repeated uses for cyclohexyl acetate hydrolyzation
图3为HZSM-5催化剂在使用前和使用6次后的FT-IR谱。由图3可知,HZSM-5的主要骨架振动峰(1200~400cm-1)未发生明显变化,表明其骨架结构完整,说明催化剂具有较好的水热稳定性。除此之外,与新鲜 HZSM-5相比,使用6次后HZSM-5的 FT-IR 谱 中 出 现 了 分 别 位 于3176、2964、2876、1512和1460cm-1的新的红外吸收峰。王松林等[14]研究了环己烯水合反应中的HZSM-5催化剂的积炭失活,根据其研究结果,位于2964和2876cm-1处的吸收峰可归属于—CH3和—CH2的反对称和对称伸缩振动;而1512和1460cm-1处的红外吸收峰则可归属为链烯烃或芳环化合物的骨架伸缩振动。但他们并未提及3176cm-1处的红外吸收峰。Feller等[15]研究分子筛表面失活时也没有发现在此处有沉积有机物的红外吸收峰。由于本实验使用了离子液体助剂[HSO3bmim]HSO4,其分子结构中的咪唑环上的C—H伸缩振动的红外吸收峰即在该处出现[16];并且,2964和2876cm-1处红外吸收峰可归属于咪唑环上取代基中的—CH3和—CH2的反对称和对称伸缩振动,而1512和1460cm-1红外吸收则可归属于咪唑环上C—C键和C—N键的伸缩振动。因此,重复使用的HZSM-5表面残留的是离子液体,而不是沉积的大分子有机物。这说明前述离子液体在高稳定性催化剂体系中所起作用的推测合理。
3 结 论
(1)采用HZSM-5催化乙酸环己酯水解反应制备得到了环己醇。同时,乙酸环己酯可以发生热分解反应得到环己烯,并且,高温有利于环己烯的生成。向反应体系中加入酸性离子液体[HSO3bmim]HSO4有利于乙酸环己酯水解生成环己醇的反应。在适宜条件下,乙酸环己酯转化率为81.6%,环己醇选择性为79.7%。
(2)[HSO3bmim]HSO4的加入提高了反应体系的极性,不利于乙酸环己酯热分解反应过渡态的电荷分散,使该反应所需的活化能变大,从而抑制了环己烯的生成,提高了乙酸环己酯水解生成环己醇的选择性。并且,离子液体的存在抑制了HZSM-5催化剂表面积炭的产生,提高了HZSM-5催化剂的重复使用性能。
[1]王碧玉,葛秀秀,吴方棣,等.环己烯催化水合制环己醇的研究进展[J].化工进展,2010,29(5):861-865.(WANG Biyu,GE Xiuxiu,WU Fangdi,et al.Progress in cyclohexanol preparation by catalytic hydration of cyclohexene[J].Chemical Industry and Engineering Progress,2010,29(5):861-865.)
[2]MAKOTO M, TOMOYUKI I. New catalytic technologies in Japan[J].Catal Today,1999,51(3-4):369-375.
[3]娄舒洁,肖超贤,孙耿,等.由苯制备环己醇新途径[J].催化学报,2013,34(1):251-256.(LOU Shujie,XIAO Chaoxian,SUN Geng,et al.A new method for preparation of cyclohexanol from benzene[J].Chinese Journal of Catalysis,2013,34(1):251-256.)
[4]IMAM R A,FREUND H,GUIT R P M,et al.Evaluation of different process concepts for the indirect hydration of cyclohexene to cyclohexanol[J].Org Process Res Dev,2013,17(3):343-358.
[5]STEYER F,SUNDMACHER K.VLE and LLE data set for the system cyclohexane+cyclohexene+water+cyclohexanol+formic acid+formic acid cyclohexyl ester[J].J Chem Eng Data,2005,50(4):1277-1282.
[6]STEYER F, SUNDMACHER K. Cyclohexanol production via esterification of cyclohexene with formic acid and subsequent hydration of the esters reaction kinetics[J].Ind Eng Chem Res,2007,46(4):1099-1104.
[7]STEYER F,FREUND H,SUNDMACHER K.A novel reactive distillation process for the indirect hydration of cyclohexene to cyclohexanol using a reactive entrainer[J].Ind Eng Chem Res,2008,47(23):9581-9587.
[8]杜文明,薛伟,李芳,等.由环己烯经甲酸环己酯制备环己醇催化反应研究[J].河北工业大学学报,2012,41(4):34-39.(DU Wenming,XUE Wei,LI Fang,et al.Study on the catalytic synthesis of cyclohexanol from cyclohexene via cyclohexyl formate[J].Journal of Hebei University of Technology,2012,41(4):34-39.)
[9]CHAKRABARTI A,SHARMA M M.Cyclohexanol from cyclohexene via cyclohexyl acetate:Catalysis by ion-exchange resin and acid-treated clay[J].Reactive Polymer,1992,18(2):107-115.
[10]杨丽红.B酸离子液体催化环己烯水合反应[D].天津:河北工业大学,2013.
[11]GENG Y L,HU L Y,ZHAO X Q,et al.Synthesis of 4,4′-MDC in the presence of sulfonic aid-functionalized ionic liquids[J].Chin J Chem Eng,2009,17(5):756-760.
[12]ADAMS J M,DVIES S E,GRAHAM S H,et al.Catalyzed reactions of organic molecules at clay surfaces:Ester breakdown,dimerizations,and lactonizations[J].J Catal,1982,78(1):197-208.
[13]徐寿昌.有机化学[M].第二版.北京:高等教育出版社,1993.
[14]王松林,汤瑛,王向宇,等.环己烯水合反应HZSM-5催化剂失活和再生研究[J].石油炼制与化工,2012,43(1):49-53.(WANG Songlin,TANG Ying,WANG Xiangyu,et al. Study on the deactivation and regeneration of HZSM-5catalyst in hydration of cyclohexene [J]. Petroleum Processing and Petrochemicals,2012,43(1):49-53.)
[15]FELLER A,BARTH J O,GUZMAN A,et al.Deactivation pathways in zeolite-catalyzed isobutane/butene alkylation[J].J Catal,2003,220(1):192-206.
[16]高金森,王鹏,董坤,等.氯化烷基咪唑离子液体分子结构和红外光谱的模拟计算[J].石油学报(石油加工),2006,22(1):72-76.(GAO Jinsen,WANG Peng,DONG Kun,et al.The simulation calculation of molecular structure and IR spectrum of alkyllimidazolium chloride ionic liquid[J].Acta Petrolei Sinica(Petroleum Processing Section),2006,22(1):72-76.)
