生物钟与消化系统疾病
2014-12-31肖文琴殷国建王兴鹏
肖文琴,殷国建,王兴鹏,万 荣
1.上海市第十人民医院消化内科,上海200072;2.苏州大学附属第二人民医院消化内科;3.上海市第一人民医院消化内科
昼夜节律是自然界中从简单的单细胞生物到各种动物直至复杂的人类最普遍存在的一种自然现象。它的存在使生物体的生理、生化、行为等生命现象表现为以近似24 h 为周期的振荡,是机体为了更好地适应环境,在进化过程中自然选择作用下获得的。昼夜节律发生的物质基础是分子计时器,即生物钟(circadian clock)。它是身体内部的时钟,通过控制能量、生长、情绪和衰老来调节器官和活动以及休息的周期。现代生活方式的改变使得昼夜节律被打乱,这种昼夜节律的功能障碍被认为是造成许多临床症状包括睡眠障碍、代谢综合征、感染、消化性溃疡、炎症性肠病、肠易激综合征等胃肠道疾病,甚至癌症发生的一个重要促进因素。下面就生物钟的分子机制、调节和在消化系统疾病中的作用作一概述。
1 生物钟的分子机制
生物钟系统很复杂,其内源性机制主要由以下三个部分组成:一是以下丘脑的视交叉上核(suprachiasmatic nucleus,SCN)为核心的节律起搏器,二是以光信号感受系统为代表的环境同步信号输入系统,三是协调全身节律性活动的输出系统。机体表现为自由运行的昼夜节律,且这种自由节律是内在固有的,具有内源性特征,即当外界环境的节律信号消失时,机体自身的昼夜节律仍然存在。一般它的周期不正好是24 h,而是近似24 h,生物节律系统能够接受外界环境的信号,通过时相重置效应,调整内源性的生物节律,使之适应外界环境的变化。
昼夜节律发生的物质基础是分子计时器,即生物钟。它由一组核心元件组成,包括Clock、Bmal1、Pers、Crys、Tim 等基因及其编码的蛋白质产物。在高等的多细胞生物中,生物钟可以分为中枢钟(母钟)和外周生物钟(子钟)。哺乳动物的母钟已经被定位于SCN[1-3],它控制着机体的行为和生理节律,包括运动、睡眠、体温和激素分泌等全身节律活动[4];子钟位于外周组织(如肝脏、肾脏、心脏等)细胞内,调控效应器的节律。
生物节律的自律振荡系统由多个负反馈环组成,在昼夜振荡反馈回路中,正性成分启动生物钟基因,使之进行表达,包括Clock/Bmal1 等蛋白因子;负性成分阻断正性成分的作用,使表达减弱或停止[5],包括CRY、PER 等蛋白因子。其中有两个环路是最主要的:(1)转录因子Clock 和Bmal1 通过碱性螺旋-环-螺旋-PAS(bHLH-PAS)结构域形成异二聚体[6],结合到节律基因Per1、Per2、Per3 和Cry1、Cry2 上游启动子的E 盒序列,从而激活基因转录[7],其表达产物PER 和CRY 系列蛋白从胞浆转移至核内,而且作为负反馈系统的负性元件,与Clock 和/或Bmal1 直接作用,抑制Clock-Bmal1 的活性,从而抑制Per1、Per2、Per3 和Cry1、Cry2 的转录[8];(2)Clock 和Bmal1 异二聚体在激活Per 和Cry 系列基因转录的同时,也激活孤儿核受体Rev-Erbα 基因转录,其表达蛋白REV-ERBα 可与Bmal1 启动子结合,阻遏Bmal1 的转录(见图1)。由于基因转录和蛋白入核需一定时间,使生物节律分子振荡的周期正好维持在24 h 左右。这种分子振荡不但使许多节律基因如Per1、Per2、Per3 和Cry1、Cry2等的表达呈生物节律性,而且使Clock 和Bmal1 异二聚体的转录活性也具有生物节律的特征。总的来说,反馈环之间相互联系,通过24 h 周期结构来相互控制,且能被光和其他环境因素重置[9]。
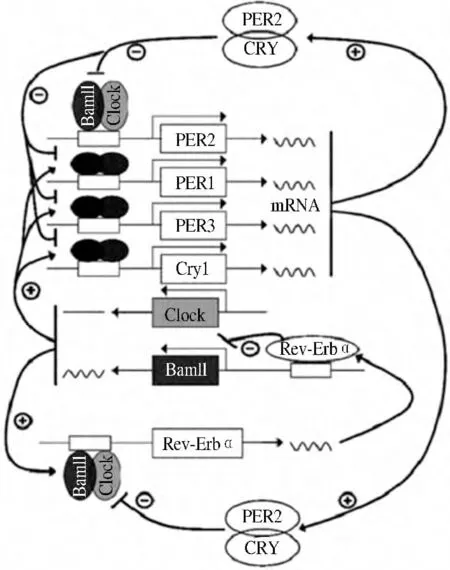
图1 生物钟负反馈调控机制Fig 1 The feedback regulation of circadian clock system
2 生物钟的调节
SCN 自身节律具有内源性的遗传基础,同时又受到光信号以及一些化学物质的影响[10]。外界环境光-暗变化投射于视网膜上,再由视网膜光感神经节细胞将信息通过视网膜下丘脑束传递至SCN 腹外侧部,SCN 由大量单细胞生物钟组成,它们的同步运行时间可产生协调的昼夜节律输出信号,切除后可导致昼夜节律的消失。SCN 同时存在许多的钟控基因,也受到反馈环路的调控,可周期性的产生神经肽,并可通过神经元间信息传递体液途径将信息输布于全身[11]。母钟对光-暗变化反应比较敏感,许多非光因子并不影响母钟的基因表达。子钟的调节,则是外源光信号的强弱变化通过视网膜-SCN-松果体之间的相互联系形成一个统一协调的昼夜节律振荡系统,它对光-暗反应不甚敏感,而对食物信号的反应比较强烈。正常情况下,母钟可以通过各种神经信号和体液信号控制子钟,使两者的时相与外周环境保持同步,即母钟与子钟是偶联的。当然,子钟也可以与母钟解偶联,例如在肝脏和胃中,食物的摄入就可以调节它们振荡子的节律。因此外周生物钟显示出了一定的独立性,但不同的是:在体外培养的外周器官和(或)组织的生物钟基因的表达在几天后就下调了;在体外培养的SCN 组织却不同,它可以长期维持生物钟的持续表达。目前的研究对这一表达的差异没有得到明确的机制[12],同时这也为我们将来在外周器官和组织的生物钟表达的研究提出了更多的急需解决的难题,当然也为临床上疾病的诊断、治疗、预后等方面提供了很好的研究方向和平台。
在几乎所有的哺乳动物中观察到,哺乳动物的子钟对光-暗变化不敏感,而更容易受到食物信号的影响,这些动物在预期提供食物的时候出现了中枢神经系统的觉醒-活动节律的波动,即称为食物预期行为,这种行为依赖于内源性昼夜节律定时系统,称为FEO(food entrainable oscillators),FEO 的激活先于进食时间,它可促进进食行为[13]。泌酸腺细胞同时表达ghrelin(胃饥饿素,一种可促进食欲的肽)和昼夜节律蛋白(例如Per1 和Per2),随意进食的时候,Per1 和Per2以及Ghrelin 的表达在光-暗周期中呈节律性,但在黑暗中却保持不变;在无Per1 和Per2 的情况下,Ghrelin不再呈节律性表达。由此可以表明:食物的调节与生物钟密不可分。
褪黑素是SCN 通过交感神经系统控制合成并由松果体产生的一种调节睡眠-觉醒周期的激素,它广泛存在于自然界中,且在光-暗循环的黑暗条件下的分泌达到高峰,通常也被称为“黑暗荷尔蒙”,通过观察得知:褪黑素在血浆浓度中存在昼夜节律。也有研究表明褪黑素不仅在重新同步母钟和子钟中起着重要的作用,而且具有强烈的抗氧化作用[14]。这同样说明了生物钟调节对人类的重要性,也为疾病治疗,包括给药时间、延缓衰老、抑制癌症等方面提供了很好的研究前景。
3 生物钟与消化系统疾病
近年来的研究表明昼夜节律系统的破坏对于很多的病理状态都是一个重要的促进因素,包括:睡眠障碍、胃肠道和肝脏疾病、代谢综合征,甚至是癌症。已有证据表明生物钟的慢性破坏影响的是脑-肠轴,它会促成一些胃肠道疾病的发生,包括胃食管反流病(GERD)、消化不良、消化性溃疡、炎症性肠病(IBD)、肠易激综合征(IBS)、非酒精性脂肪肝和其他一些功能性疾病,甚至是胃肠道肿瘤(结直肠癌)等[15]。这几年也有相关报道表明了生物钟紊乱对肝硬化和胰腺癌等相关消化系统疾病的作用。
3.1 生物钟与胃肠道功能性疾病关系 昼夜节律的振荡系统会影响胃肠道的动力、屏障的维持和更换、免疫力和消化酶的产生等方面。通过分析表明:倒班工作和跨时区的飞行导致的昼夜节律改变引起了腹痛、便秘或腹泻的胃肠道症状,而所有这些症状与肠功能紊乱(IBS、消化性不良)的患者所具有的症状相似。
Knutsson 等[16]分析了倒班工作导致的昼夜节律慢性破坏与胃肠道功能障碍的流行病学关联,说明了倒班工作人员发生胃肠道症状的危险增加,但是并不是所有的研究都认可这种关联性。所以是否真正存在这种关联还需更多的实验研究进一步阐明。
Nojkov 等[17]调查了从事护理工作的399 名护士(214 名白班轮换、110 名夜班轮换和75 名日-夜倒班轮换),研究结果表明:日- 夜倒班轮换工作的护士IBS 的发生率明显高于其他两种,特别是对腹痛的影响,而且所发生的腹痛与睡眠质量无关。由此说明:昼夜节律的紊乱可能在IBS 和腹痛的发病机理中发挥着重要作用。
Thor 等[18]研究表明褪黑素对致敏的或者发炎的肠道神经系统有许多积极的影响,它可能被作为一个治疗IBS 的候选药物。在动物研究中证明了褪黑素对胃肠道运动的调节作用;在临床上也有充分的证据表明褪黑素对胃肠道运动的调节作用,而且许多人都研究和证实了褪黑素对IBS 患者有益。Lu 等[19]证明口服褪黑素对改善女性IBS 患者症状有效,其作用在于减轻腹痛、腹胀和排便期间的腹部不适感。
Swanson 等[20]研究表明昼夜节律的改变导致具有结肠炎的动物模型的情况明显恶化,同时对人类的研究也初步表明IBD 使得睡眠模式(生物钟)改变的风险增加。
3.2 生物钟与胃肠道黏膜和胃酸分泌的关系 肠道昼夜节律生物钟的改变可能对胃肠道黏膜的完整性有影响。Brzozowska 等[21]指出昼夜节律振荡系统的破坏对肠道黏膜保护和细胞增殖有直接或间接的影响。Pietroiusti 等[22]的研究显示:相对于白班轮换工作的人群,倒班工作人群更易发生十二指肠溃疡。这一现象发生的主要原因是倒班工作人员夜间褪黑素合成的减少,因为褪黑素在对胃的保护中起核心作用,它的不足是消化性溃疡发生的一个重要的促进因子[23]。Konturek 等[24]的动物实验表明褪黑素和它的前体对胃溃疡形成具有强大的愈合作用。Ceranowicz 等[25]也指出:除褪黑素之外,Ghrelin 也可促进大鼠胃/十二指肠溃疡的愈合。
昼夜节律同样能影响胃酸的分泌,近些年来,许多学者在动物研究的实验中发现:促胆囊收缩素、胃肠肽、促胃液素等参与胃酸分泌调节的下丘脑肽类物质均在夜间活动期的昼夜节律周期中呈现高峰时相[26]。
GERD 是与胃酸分泌过多有关的最常见疾病之一,GERD 患者诉有频繁的夜间反流症状,而且Dean等[27]也指出这种夜间的GERD 可由于疼痛和睡眠障碍严重影响生活质量,从而干扰第二天的精神和机体功能。至今为止,GERD 导致夜间反流症状的具体机制还未明确阐述,这为将来在这方面的研究提出了挑战。
3.3 生物钟与癌症的关系 昼夜节律系统的破坏对肿瘤的发生也有重要的影响。根据大量关于夜间持续光暴露的致癌性的实验动物研究以及人类少量样本的研究,国际癌症研究机最近发布了“轮班工作导致的生理节律紊乱对于人类来说可能是致癌因素”的推论[28]。有研究证明分子钟机制和一些致癌作用如血管发生、细胞增殖、细胞凋亡和DNA 修复等有关,这些致癌作用可能受昼夜节律系统的控制[29]。
生物钟基因可能通过影响其自身蛋白质的翻译过程参与肿瘤的侵袭和转移。在人类大肠癌组织中发现hPer2 基因和蛋白的表达被抑制,且hPer 的表达在结直肠癌的发生、进展和转移中可能失调[30]。生物钟基因也可能通过其他蛋白质的翻译过程参与肿瘤的发生和发展。Zub-Pokrowiecka 等[31]的研究表明:在健康研究对象中禁食和进餐后的Ghrelin 和促胃液素的血浆水平呈负相关,但是进行全胃或胃大部切除后的胃癌患者进食后血浆Ghrelin 水平不再表现出有意义的增长,而是表现出禁食和进餐后的高促胃液素水平。此研究说明在行胃切除术后的早期胃癌患者中,血浆Ghrelin 和促胃液素水平的反馈关系不再存在,同时也说明胃癌患者的昼夜节律生物钟被打乱。
Oda 等[32]研究证明mPer2(mouse PER2)基因与hPer2(human PER2)基因是同源的,mPer2 基因的高效表达在抑制小鼠肿瘤细胞生长的方面起了非常重要的作用。将mPer2 基因转导入人类的癌细胞中,观察到mPer2 基因同样在人类胰腺癌细胞中发挥重要功能,即mPer2 基因与hPer2 基因一样,在人类体内表达了mPER2 蛋白和激活了Bmal1 基因和Clock 基因的转录。由此说明mPer2 生物钟基因在治疗胰腺癌方面具有重要的意义,但具体机制仍需更多的实验进一步阐明。
Yu 等[33]研究表明Bmal1 基因在调节细胞活动中起着重要的作用,它表达的紊乱(即节律的破坏)可能导致异常的细胞增长,甚至造成癌症的发生;Cry 基因表达的下调或功能的阻断可能在治疗某些癌症方面有着重要的作用。
随着科学技术的进步,对生物钟的研究也越来越深入,但是由于其分子机制相当复杂,完全阐明其调控机制还有待于更进一步的研究,而且生物钟对全身各系统的功能都会产生影响,但是其影响方式及途径尚不十分清楚。现代生活方式的转变和节奏的加快,使得胃肠道功能性疾病及肝脏疾病和癌症等相关消化系统疾病的发生率明显增加。许多行业(如护士和航空人员)不可避免的需要倒班工作,那么如何使得这些人群保持生物钟的正常调节呢?如何利用生物钟调节GERD 患者夜间反流的症状?如何利用生物钟基因在癌症等方面发挥治疗意义?这些急需解决的问题促使我们要加快在这些方面专研的脚步,未来的研究应集中于生物钟基因在消化系统疾病中病理生理方面的具体机制的阐述,以及昼夜节律调节在消化系统疾病诊治中的实际临床应用。
[1] Caldelas I,Poirel VJ,Sicard B,et al. Circadian profile and photic regulation of clock genes in the suprachiasmatic nucleus of a diurnal mammal Arvicanthis ansorgei [J]. Neuroscience,2003,116(2):583-591.
[2] Honma S,Kawamoto T,Takagi Y,et al. Dec1 and Dec2 are regulators of the mammalian molecular clock[J]. Nature,2002,419(6909):841-844.
[3] Wang GQ,Tong J. Advances in study on molecular mechanism of circadian clock in pineal gland[J]. Progress in Physiological Sciences,2004,35(3):210-214.王国卿,童建. 松果体昼夜节律生物钟分子机制的研究进展[J].生理科学进展,2004,35(3):210-214.
[4] Wang YH,Wen YL,Qi SRN,et al. Biologial clock gene model in mammals and its research development[J]. Sichuan Journal of Physiological Sciences,2006,28(1):33-35.王艳红,文勇立,齐莎日娜,等. 哺乳动物生物钟模型及研究进展[J].四川生理科学杂志,2006,28(1):33-35.
[5] Hou BK,Yu HM. Recent developments in molecular mechanisms of biological clock[J]. Hereditas (Beijing),1996,18(4):42-44.侯丙凯,于惠敏. 生物钟的分子机制研究进展[J]. 遗传,1996,18(4):42-44.
[6] Bunger MK,Wilsbacher LD,Moran SM,et al. Mop3 is an essential component of the master circadian pacemaker in mammals[J]. Cell,2000,103(7):1009-1017.
[7] Gekakis N,Staknis D,Nguyen HB,et al. Role of the CLOCK protein in the mammalian circadian mechanism [J]. Science,1998,280(5369):1564-1569.
[8] Li JC,Yu D,Wang F,et al. Advances in studies of biological clock gene[J]. Hereditas (Beijing),2004,26(1):89-96.李经才,于多,王芳,等. 生物钟基因研究新进展[J]. 遗传,2004,26(1):89-96.
[9] Ni YH,Wu T,Wang L,et al. Advances in interactions between glucocorticoid hormones and circadian gene expression [J]. Hereditas(Beijing),2008,30(2):135-141.倪银华,吴涛,王露,等. 肾上腺糖皮质激素与生物钟基因表达调控的相关研究进展[J]. 遗传,2008,30(2):135-141.
[10] Starkey SJ. Melatonin and 5-hydroxytryptamine phase-advance the rat circadian clock by activation of nitric oxide synthesis[J]. Neurosci Lett,1996,211(3):199-202.
[11] Bao NR,Yu YQ,Zhang HP. The molecular mechanisms of circadian biological clock[J]. Foreign Medical Sciences·Section of Pathophysiology and Clinical Medicine,2003,23(4):416-418.包娜仁,于艳秋,张海鹏. 昼夜节律性生物钟的分子调节机制[J].国外医学(生理、病理科学与临床分册),2003,23(4):416-418.
[12] Yagita K,Tamanini F,van Der Horst GT,et al. Molecular mechanisms of the biological clock in cultured fibroblasts [J]. Science,2001,292(5515):278-281.
[13] Mistlberger RE. Circadian food-anticipatory activity:formal models and physiological mechanisms[J]. Neurosci Biobehav Rev,1994,18(2):171-195.
[14] Abbas A,Raju J,Milles J,et al. A circadian rhythm sleep disorder:melatonin resets the biological clock[J]. J R Coll Physicians Edinb,2010,40(4):311-313.
[15] Hoogerwerf WA. Role of biological rhythms in gastrointestinal health and disease [J]. Rev Endocr Metab Disord,2009,10 (4):293-300.
[16] Knutsson A,Bφggild H. Gastrointestinal disorders among shift workers[J]. Scand J Work Environ Health,2010,36(2):85-95.
[17] Nojkov B,Rubenstein JH,Chey WD,et al. The impact of rotating shift work on the prevalence of irritable bowel syndrome in nurses[J].Am J Gastroenterol,2010,105(4):842-847.
[18] Thor PJ,Krolczyk G,Gil K,et al. Melatonin and serotonin effects on gastrointestinal motility[J]. J Physiol Pharmacol,2007,58 Suppl 6:97-103.
[19] Lu WZ,Gwee KA,Moochhalla S,et al. Melatonin improves bowel symptoms in female patients with irritable bowel syndrome:a doubleblind placebo-controlled study[J]. Aliment Pharmacol Ther,2005,22(10):927-934.
[20] Swanson GR,Burgess HJ,Keshavarzian A. Sleep disturbances and inflammatory bowel disease:a potential trigger for disease flare?[J].Expert Rev Clin Immunol,2011,7(1):29-36.
[21] Brzozowska I,Ptak-Belowska A,Pawlik M,et al. Mucosal strengthening activity of central and peripheral melatonin in the mechanism of gastric defense[J]. J Physiol Pharmacol,2009,60 Suppl 7:47-56.
[22] Pietroiusti A,Forlini A,Magrini A,et al. Shift work increases the frequency of duodenal ulcer in H.pylori infected workers[J]. Occup Environ Med,2006,63(11):773-775.
[23] Konturek SJ,Konturek PC,Brzozowski T,et al. Role of melatonin in upper gastrointestinal tract[J]. J Physiol Pharmacol,2007,58 Suppl 6:23-52.
[24] Konturek PC,Konturek SJ,Burnat G,et al. Dynamic physiological and molecular changes in gastric ulcer healing achieved by melatonin and its precursor L-tryptophan in rats[J]. J Pineal Res,2008,45(2):180-190.
[25] Ceranowicz P,Warzecha Z,Dembinski A,et al. Treatment with ghrelin accelerates the healing of acetic acid-induced gastrin and duodenal ulcers in rats[J]. J Physiol Pharmacol,2009,60(1):87-98.
[26] Tian AH. Relationship between the clock gene and gastrointestinal tract[J]. Journal of New Medicine,2012,22(3):193-195.田爱花.生物钟基因与胃肠道的关系[J]. 医学新知杂志,2012,22(3):193-195.
[27] Dean BB,Aguilar D,Johnson LF,et al. The relationship between the prevalence of nighttime gastroesophageal reflux disease and disease severity[J]. Dig Dis Sci,2010,55(4):952-959.
[28] Kantermann T,Roenneberg T. Is night-at-light a health risk factor or a health risk predictor?[J]. Chronobiol Int,2009,26 (6):1069-1074.
[29] Qandeel HG,Alonso F,Hernandez DJ,et al. Role of vagal innervation in diurnal rhythm of intestinal peptide transporter 1 (PEPT1)[J]. J Gastrointest Surg,2009,13(11):1976-1985.
[30] Wang Y,Hua L,Lu C,et al. Expression of circadian clock gene human Period2 (hPer2)in human colorectal carcinoma[J]. World J Surg Oncol,2011,9:166.
[31] Zub-Pokrowiecka A,Rembiasz K,Konturek PC,et al. Ghrelin and gastrin in advanced gastric cancer before and after gastrectomy[J].World J Gastroenterol,2011,17(4):449-458.
[32] Oda A,Katayose Y,Yabuuchi S,et al. Clock gene mouse period2 overexpression inhibits growth of human pancreatic cancer cells and has synergistic effect with cisplatin[J]. Anticancer Res,2009,29(4):1201-1209.
[33] Yu EA,Weaver DR. Disrupting the circadian clock:gene-specific effects on aging,cancer,and other phenotypes[J]. Aging (Albany NY),2011,3(5):479-493.
