水稻秸秆降解菌BCM-9的分解特性及微生物群落动态研究
2014-12-28葛长明李海粟张本月赵洪颜
李 雪,葛长明,李海粟,刘 双,陈 迪,张本月,赵洪颜
(延边大学农学院,吉林延吉133002)
木质纤维素是地球上最为丰富的生物资源,约占植物总干重的1/3~1/2,它能够被微生物降解[1]。秸秆是籽粒收获后耕地上重要的农业废弃物资源,吉林省每年有超过0.6亿t的秸秆废弃物资源。由于秸秆等农业废弃物资源在自然状态下极难分解,只能就地丢弃或焚烧,不能归还土壤。大量待分解的秸秆不仅占用耕地还限制营养元素归还土壤,而且焚烧产生的烟尘影响生态环境和人类健康。因此,如何将秸秆变废为宝是实现环境保护和农业可持续发展的重要课题[2]。
崔宗均等突破传统的微生物纯培养分离方法,在不破坏自然界中微生物之间协同关系的前提下,将酸碱反应不同的菌群优化组合,筛选和驯化了高效而稳定的纤维素分解复合菌系 MC1、XCD-2、WDC-2 等复合系[1,3-4]。此复合系的降解能力远远高于纯培养的单个菌株,在8 d内可完全降解水稻秸秆[5]。而且这些复合系对在厌氧发酵产甲烷过程中有显著的优势,但是这些复合系都是从畜禽粪便堆肥环境中筛选出来的。因此,该研究是从沼液厌氧环境中筛选出BCM-9复合系,为秸秆厌氧发酵产沼气的酸化处理提供基础。
1 材料与方法
1.1 材料 以笔者实验室构建的木质纤维素分解复合菌系BCM-9作为菌种,培养基为蛋白胨纤维素培养液(PCS),其成分为5 g蛋白胨,5 g NaCl,2 g CaCO3,1 g 酵母粉及1 L 的去离子水。配制800 ml PCS培养基于1 L的三角瓶中,添加8 g水稻秸秆,121℃灭菌15 min。水稻秸秆经1.5%NaOH碱液浸泡48 h后,用自来水冲洗到pH为7.0左右,105℃烘干后,将其剪到合适的长度以便放入300 ml的三角瓶中。调节pH试验中,需配制1%、2%、3%NaOH溶液用于调节培养液的pH。更换培养基试验中需配制新鲜的PCS培养基。
1.2 培养条件 每个300 ml的三角瓶中装入238 ml PCS培养基,稻秆的添加量分别为培养基体积的5%(W/V)。培养基在121℃下灭菌15 min后备用。将培养3 d的BCM-9菌种按照5%体积的接种量接种到新鲜培养基中,60℃下静置培养。
1.3 水稻秸秆分解过程中pH的测定 pH的测定方法:取0.2 ml培养液,滴于HORIBA微型pH计(model B-212,HORIBA,Japan)中进行测定。
1.4 BCM-9分解后秸秆各成分测定 将烘干后的秸秆残渣粉碎并过1 mm的筛子,称取0.5 g装入滤袋,3个重复,按照ANKOM220纤维分析仪操作规程及技术资料测定秸秆的纤维素、半纤维素、木质素含量。
1.5 BCM-9发酵液中有机酸含量测定 发酵液样品经8 000 r/min离心10 min,上清液过0.22μm 滤膜,在 -40℃冰冻下保存,待样品收集全后,用岛津QP2010型气相色谱-质谱(GC-MS)测定,测定分析柱为CP-Chirasil-Dex CB(25 m×0.25 mm)毛细管柱;柱箱温度50℃(1 min)→100℃(1 min),7℃ /min→195℃(2 min),18 ℃ /min,共14 min;进样口温度190℃;检测器温度200℃;载气He(60 kPa),流量34 ml/min;分流比1/22;监测器电压115 kV;进样量1μl。对测定的数据,利用NIST数据库进行定性分析。根据出峰物的定性分析结果,配制相应标准样品的稀释液作为标准物进样,用于该物质的定量分析[4]。
1.6 纤维素酶和木聚糖酶活力的测定 纤维素酶活力测定和木聚糖酶活力测定参见[2-3]等方法。其中纤维素酶活力单位定义为:酶液在1 min内消耗纤维素产生1 mmol葡萄糖作为1 U;木聚糖酶活力单位(IU)定义为1 min水解木聚糖底物生成1μg木糖所需的酶量为1个酶活力单位。
1.7 微生物动态群落动态分析 培养液经8 000 r/min离心15 min,弃上清收集菌体细胞,按照 Benzyl chloride方法[6]提取微生物的总DNA。16SrDNA的PCR扩增使用AmpliTaq GoldTM(Perkin Elmer,Japan),引物为 357F-GC(GC clamp-5'-CCTACGGGAGGCAGCAG-3')和517R(5'-GTGCCAGC(A/C)GCCGCGG-3')。用 PCR 扩增产物进行 DGGE 分析[7-8]。从胶上回收DNA条带,测定其序列,GenBank数据库检索,进行相似性分析。
2 结果与分析
2.1 水稻秸秆降解过程中p H的变化 据报道,纤维素降解pH 范围为5.9 ~8.5[6]。由图1 可知,水稻秸秆降解过程中2 d内发酵液的pH迅速地从7.4下降到6.2,随着培养时间的增加,pH逐渐上升,第12天时达到8.3。
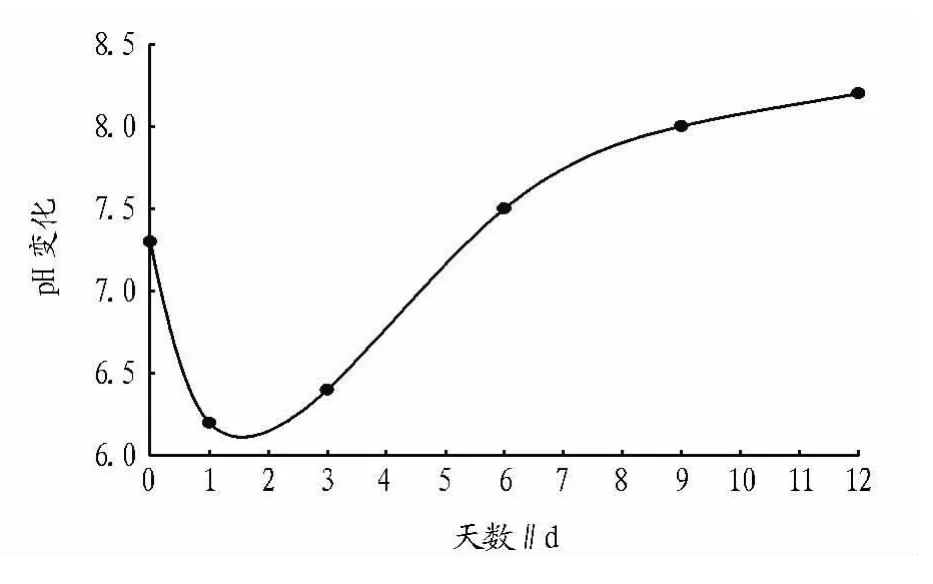
图1 水稻秸秆降解过程中pH的变化
2.2 BCM-9分解后秸秆各成分测定结果 由图2可知,水稻秸秆的生物量总干重12 d后下降了75%。纤维素、半纤维素和木质素组成成分的质量分别降低了97.11%、74.70%和48.00%。前期研究报道的MC1的降解率为:生物量总干重减少81%,纤维素含量减少99%,半纤维素减少74%,木质素减少24%。比较表明,BMC-9和MC1对水稻秸秆的木质纤维素具有很强的分解能力。这为BMC-9降解木质纤维素沼气发酵酸化阶段的机制研究提供了理论基础。
2.3 纤维素酶和木聚糖酶活力的测定结果 为检测BMC-9对水稻秸秆的降解能力,测定了12 d内纤维素酶活性和木聚糖酶活性的变化。结果表明,木聚糖酶的活性逐渐上升,在第9天时呈现峰值,为1.79 U/ml。纤维素酶活性在第9天达到最大值,0.37 U/ml(图3)。酶活性的分析表明,BMC-9对水稻秸秆分解能力最强的是在第9天。
2.4 水稻秸秆降解产物分析 BCM-9降解水稻秸秆过程中产生的挥发性有机酸分析结果表明:在第9天挥发性有机酸的总量达到最高值。在水稻秸秆降解过程中主要的成分是甲酸、乙酸、丙酸和乳酸。第9天时乳酸为0.291 mg/L,甲酸为0.31 mg/L,乙酸为 1.93 mg/L,丙酸为 0.73 mg/L(图 4),与酶活性分析的结果相类似。

图2 BCM-9分解后秸秆各成分测定结果
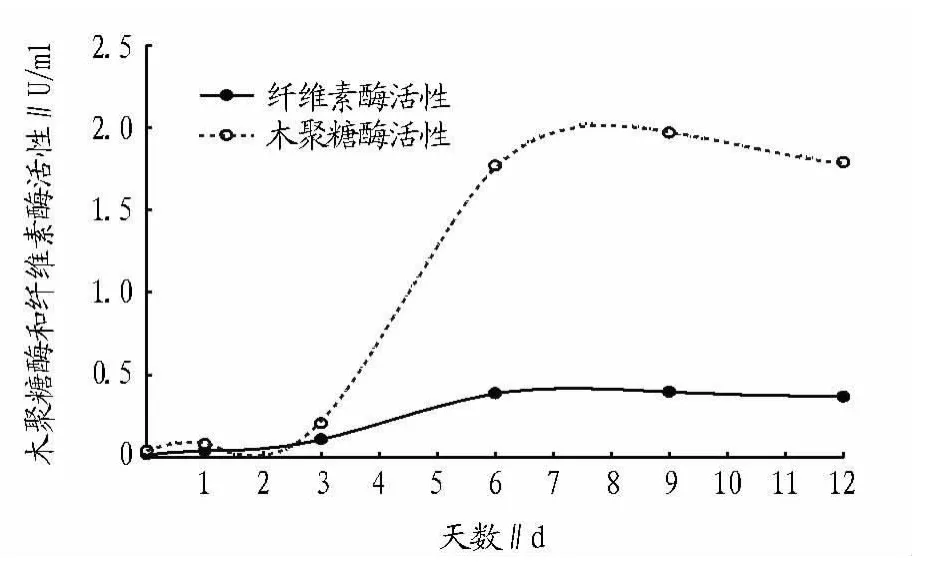
图3 BCM-9降解水稻秸秆过程中纤维素酶和木聚糖酶活性变化
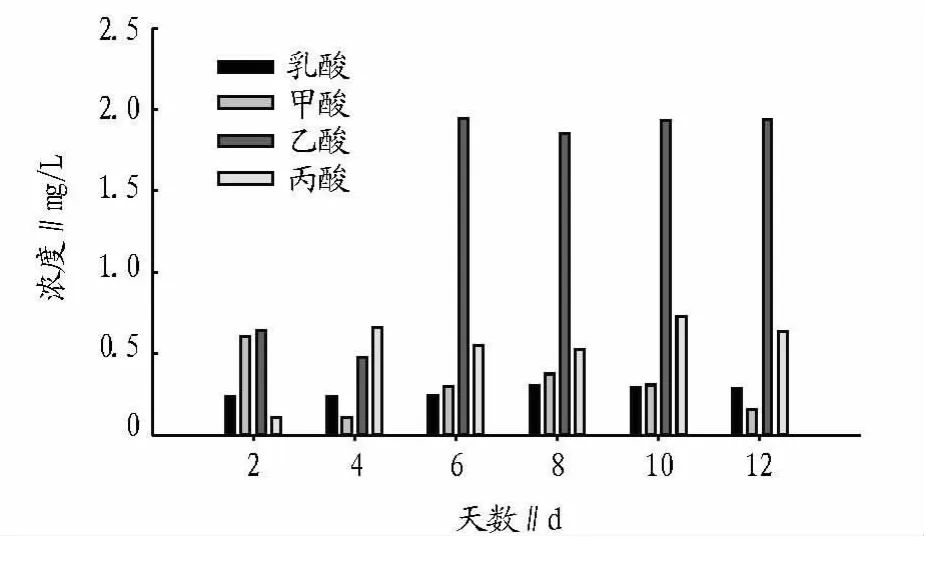
图4 水稻秸秆发酵液中挥发性有机酸含量分析
2.5 细菌DGGE图谱分析 在第38代培养过程中的第0、1、3、6、9和12天收集培养液,测定细菌菌群的多样性。由图5可知,在DGGE图中谱条带的出现和消失表明该种群中的微生物群落结构发生了变化。随着培养时间的延长,它们的频带发生了显著变化。DGGE图谱共出现了16条带。条带1、5、14、15和16是第1天到第12 天一直存在的,条带1、14和15 分别在第1、3、6 和 9 天亮度最高。条带 2、3、5、6、8 和10出现在整个监测过程中。条带2、5、8的强度逐渐增强,而条带3、6、10的强度逐渐降低。条带11和12 在第1、3、9、12天可见,条带13和占主导地位的微生物种群在第3~12天时以恒定强度出现。根据这些条带的出现、消失和强度,可以知道微生物群体的组合物,在发酵过程中会发生很大改变[14]。
为了更加清晰地了解微生物群之间的关系,对条带切除、纯化,并通过PCR扩增、测序。通过NCBI网站进行比对,结果见表1。16个条带对应3个属:Bacillus sp.、Clostridium sp.和 Geobacillus sp.,其中条带12 对应于 Geobacillus sp.,它是在微生物群体中最常见的菌株。该属通常是需氧或兼性厌氧菌,生长在45~70℃的高温环境中[5]。条带1、8、15对应的是Bacillus sp.。以前的研究已经表明,Bacillus sp.是一种芽孢杆菌属,可以简单地将有机化合物分解为无机物。它能够降解木质素生产生物表面剂,促进难降解有机物的微生物分解,提高堆肥效率,缩短堆肥周期。条带 2、3、4、5、6、7、9、10、11、13、14、16 是 Clostridium sp.,据报道在堆肥环境中导致堆体温度的快速上升,并具备能力降解纤维素[3]。
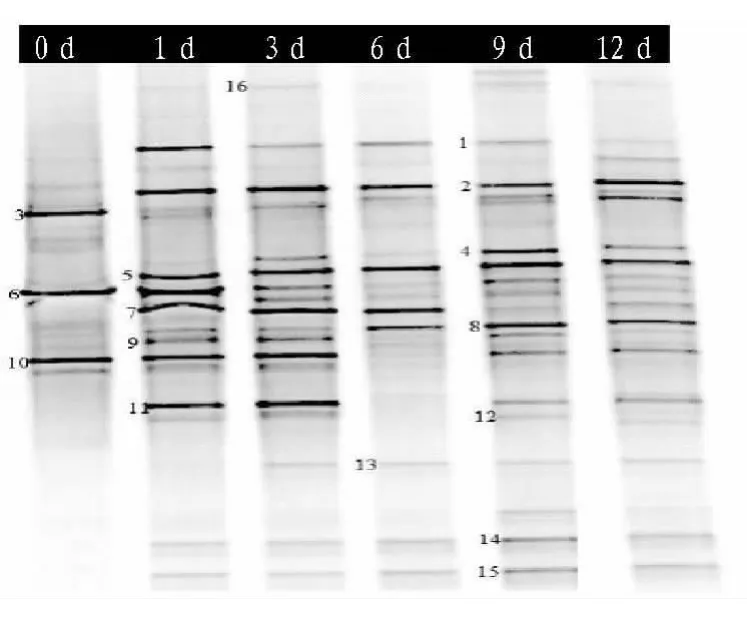
图5 细菌DGGE图谱分析
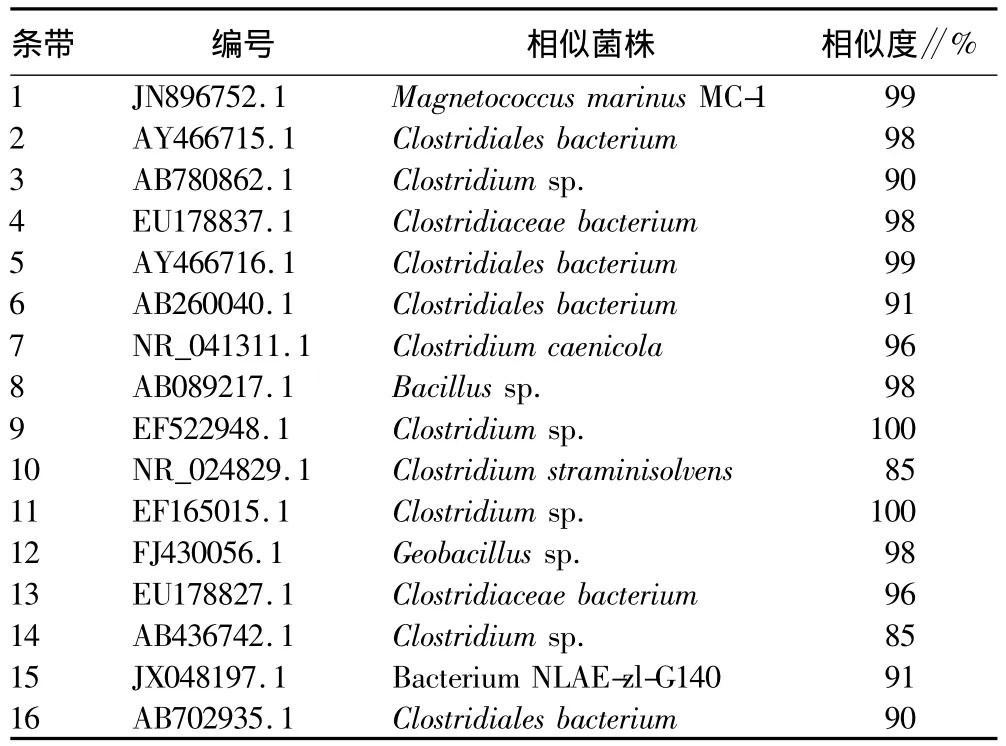
表1 细菌DGGE条带16S r RNA序列分析
3 结论
(1)水稻秸秆降解菌在降解过程中,发酵液pH先降低后升高,趋于稳定。
(2)降解后水稻秸秆的总生物量降低了75%,纤维素降低了97.11%,半纤维素降低了74.70%,木质素降低了48.00%。
(3)降解过程中挥发性脂肪酸、木聚糖酶活、纤维素酶活在第9天时数值最高。
(4)第9天时,发酵液中细菌微生物群落最为丰富,分别是 Bacillus sp.、Clostridium sp.和 Geobacillus sp.属菌株。
[1]崔宗均,朴哲,王伟东,等.一组高效稳定纤维素分解菌复合系MC1的产酶条件[J].农业环境科学学报,2004,23(2):296 -299.
[2]刘长莉,王小芬,郭鹏,等.常温秸秆还田菌群的筛选及分解稻秆特性研究[J].中国农业科学,2010,43(1):105 -111.
[3]吕育财,朱万斌,崔宗均,等.纤维素分解菌复合系WDC2分解小麦秸秆的特性及菌群多样性[J].中国农业大学学报,2009,14(5):40 -46.
[4]PENGG,ZHU W,WANGH,et al.Functional characteristics and diversity of a novel lignocelluloses degrading composite microbial system with high xylanase activity[J].Journal of Microbiology and Biotechnology,2010,20:254-264.
[5]崔宗均,李美丹,朴哲,等.一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J].环境科学,2002,23(3):36 -39.
[6]ZHUH,QUF,ZHUL H.Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J].Nucleic Acids Research,1993,21:52 -79.
[7]MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59:695 -700.
[8]WANG X,HARUTA S,WANG P,et al.Diversity of a stable enrichment culture which is useful for silage inoculant and its succession in alfalfa silage[J].FEMSMicrobiology Ecology,2006,57:106 -115.
