紫椴花多糖的微波提取及体外抗氧化活性
2014-12-25王婧杰陈玉霞穆立蔷
王婧杰, 陈玉霞, 穆立蔷*
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.哈尔滨市园林科学研究所,黑龙江 哈尔滨150040)
紫椴(Tilia amurensis Rupr.)是我国东北地区重要的经济树种,是优质的蜜源和木材[1]。《中华本草》记载,紫椴花具有清热解表的药效[2]。椴树属植物是传统的药用植物,可以作为镇静剂、利尿剂、祛痰剂和发汗剂[3-4]。紫椴花中含有较多的多糖、黄酮类化合物、酚类、香豆素等多种天然活性物质[5]。紫椴花乙醇提取物具有较好的抗急性炎症及镇痛作用[6],紫椴树皮提取物中的黄烷和脂肪酸能够抑制DNA拓扑异构酶的活性[7]。紫椴花中多糖含量丰富,盛花期可达到约163.21 mg/g[8-9],是一种理想的植物多糖原料。国内外学者采用热水浸提[10]、微波辅助[11]、超声波辅助[12]、酶法辅助[13]等诸多方法提取植物中的多糖并对多种植物多糖进行了抗氧化活性评价。目前尚未发现对紫椴花多糖生物活性进行研究的相关文献报道。作者采用响应面法优化了紫椴花多糖的微波提取工艺,并对其体外抗氧化活性进行了研究,旨在为紫椴资源的合理开发和深度利用提供科学的参考依据。
1 材料与方法
1.1 材料与设备
紫椴花,采于东北林业大学校园,经东北林业大学穆立蔷教授鉴定为紫椴花,自然风干,粉碎后过60目筛;市售鲜鸡蛋;1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司产品;其他试剂均为国产分析纯。
756PC紫外可见分光光度计,北京通用仪器有限公司制造;WD800LG微波炉,天津乐津电子有限公司制造;NKTHZ-A空气恒温摇床,常州诺基仪器有限公司制造;TDL-40B-W台式低速大容量离心机,湖南星科科学仪器有限公司制造;FW-100型高速万能粉碎机,天津市泰斯特仪器有限公司制造;TGL-16G高速离心机,北京佳源兴业科技有限公司制造;TDA-8002型恒温水浴锅,上海博迅实业有限公司制造;ALC-110型电子天平,北京赛多利斯仪器系统有限公司制造;RE-52A旋转蒸发器,上海亚荣生化仪器厂制造;LGJ-10台式冷冻干燥机,北京松源华兴科技发展有限公司制造;Magna-IR560型傅里叶变换红外光谱仪,美国尼高力(Nicolet)公司制造。
1.2 实验方法
1.2.1 紫椴花多糖提取工艺流程 紫椴花干粉→石油醚脱脂→微波提取→离心→提取液浓缩→Sevage法除蛋白质→体积分数95%乙醇沉淀→洗涤沉淀→冷冻干燥→紫椴花粗多糖。
1.2.2 葡萄糖标准曲线的绘制 采用苯酚-硫酸比色法[14],得到葡萄糖标准曲线回归方程:
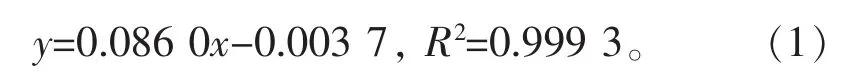
式(1)中,y为反应液在490 nm处的吸光值;x为反应液中的葡萄糖质量浓度,μg/mL。
1.2.3 提取液中多糖得率计算方法 多糖提取液定容至100 mL,再吸取1.0 mL定容至25 mL。取定容液2.0 mL,按标准曲线的步骤操作测定吸光度,根据标准曲线回归方程计算多糖得率。
1.2.4 单因素实验 考察微波时间(min)、微波功率(W)和料液比(g/mL)3个因素对紫椴花多糖得率的影响,每个处理实验重复3次。
1.2.5 响应面法优化紫椴花多糖提取工艺 在单因素实验基础上利用Minitab16.0软件,以紫椴花多糖得率为响应值,设计微波时间、微波功率和料液比三因素三水平Box-Benhnken中心组合实验,建立二次回归方程模型,优化微波提取紫椴花多糖工艺参数,并进行验证实验。Box-Benhnken实验设计因素水平见表1。
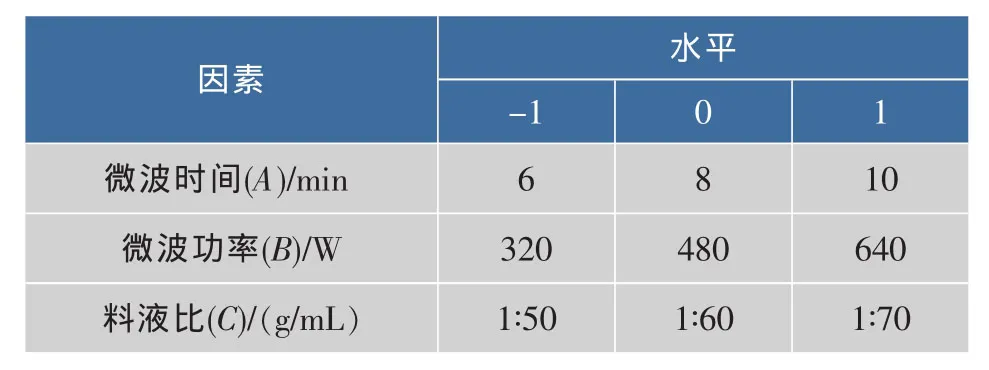
表1 Box-Benhnken实验设计因素水平表Table 1 Factors and levels of Box-Benhnken experiment design
1.2.6 紫椴花粗多糖定性分析及红外光谱分析
观察紫椴花粗多糖的颜色、状态及其在水、甲醇、无水乙醇、丙酮等试剂中的溶解性。配制1 mg/mL紫椴花粗多糖溶液,分别通过硫酸-咔唑反应、碘化反应、斐林试剂和班氏试剂反应、考马斯亮蓝反应和三氯化铁反应,检测紫椴花粗多糖中是否含有糖醛酸、淀粉、还原糖、蛋白质和酚类化合物。精确称取紫椴花粗多糖粉末2 mg,在远红外灯照射下与干燥的KBr研磨混合压片后,以KBr为本底,用红外光谱仪在4 000~400 cm-1红外波数范围内进行扫描。
1.2.7 紫椴花粗多糖体外抗氧化活性研究
1)紫椴花粗多糖清除DPPH自由基能力的测定:参照文献[15]方法,以VC作阳性对照。抗氧化剂清除DPPH自由基的能力(E0)由式(2)计算:

式(2)中,A0为2 mL DPPH甲醇溶液+2 mL溶剂的吸光度值;A1为2 mL甲醇+2 mL多糖溶液的吸光度值;A2为2 mL DPPH甲醇溶液+2 mL多糖溶液的吸光度值。
2)紫椴花粗多糖总还原能力的测定:参照文献[16]的方法,略做修改,以VC作阳性对照。
3)紫椴花粗多糖清除羟自由基能力的测定:参照文献[17]的测定方法,略做调整,以VC作阳性对照。羟自由基清除率(E1)计算公式如下式(3):

式 (3)中,A为不同多糖质量浓度下的吸光度;Aj为用水代替水杨酸时测得某质量浓度多糖的本底吸光度;A0为用水代替抗氧化剂时测得的空白对照吸光度。
4)紫椴花粗多糖抗脂质过氧化能力的测定:参照文献[18]的方法,略做修改,以VC作阳性对照。抑制率(E2)计算公式为
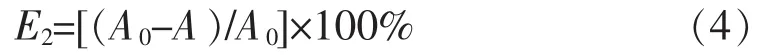
式(4)中,A0为空白对照组吸光度值,A为不同质量浓度抗氧化剂作用体系的吸光度值。
2 结果与分析
2.1 单因素实验结果分析
2.1.1 微波时间对多糖得率的影响 由图1(a)可知,紫椴花多糖得率随着微波作用时间的延长而提高,微波作用时间达到8 min时,紫椴花多糖得率达到最大,而后有下降的趋势。出现这种趋势的原因可能是较短时间内,微波对植物细胞壁及细胞膜的破坏作用大,导致细胞内物质大量溶出,多糖得率显著提高;另一方面,随着细胞破碎程度越来越大,细胞中其他杂质的溶出也增加,多糖得率反而下降[19]。因此,8 min为较优的微波作用时间,选择6 min、8 min、10 min作为响应面实验的3个水平。
2.1.2 微波功率对多糖得率的影响 由图1(b)可知,紫椴花多糖得率随着微波功率的提高呈现先升高而后略有下降的趋势,微波功率为480 W时,多糖得率最大。出现这种趋势的原因可能是在一定范围内,微波功率升高时,物料吸收的微波热能随之增加,有效促进植物细胞的破碎,溶出物质增加;当微波功率达到一定水平后,会引起多糖降解,多糖得率稍有下降[20]。因此,480 W为较优的微波输出功率,选择320 W、480 W、640 W作为响应面实验的3个水平。
2.1.3 料液比对多糖得率的影响 由图1(c)可知,紫椴花多糖得率随着料液比的增加呈现先升高而后下降的趋势,料液比为 1∶60(g/mL)时,多糖得率达到最大值。出现这种趋势的原因可能是在一定范围内,水量的增加使得原料与水边界层浓度差增大,有利于多糖的溶出和扩散,传质速率提高;随着水量进一步增加,温度上升趋于缓慢,能耗效率下降,同时杂质溶出增加,相当于多糖被稀释,得率反而降低[21]。 因此,1∶60(g/mL)为较优的料液比,选择1∶50、1∶60、1∶70(g/mL)作为响应面实验的 3 个水平。
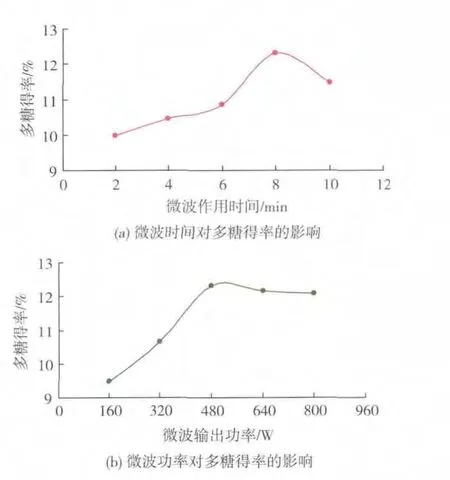
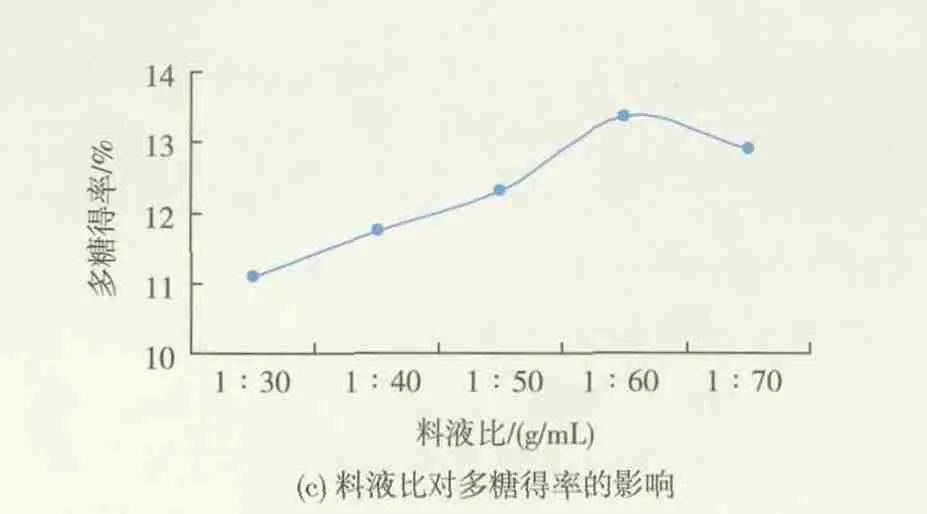
图1 微波时间、微波功率和料液比对多糖得率的影响Fig.1 Effect of microwave time,microwave power and ratio of raw material to liquid on the extraction rate of polysaccharides
2.2 响应面实验结果分析
2.2.1 工艺优化实验设计方案及结果 Box-Benhnken实验设计方案及结果见表2。
2.2.2 数学二次回归模型的建立及方差分析 根据实验结果进行多元拟合分析,得到的二次多项回归方程模型为

式(5)中,Y代表多糖得率,A、B、C分别代表微波时间、微波功率和料液比。
对上述模型进行方差分析,结果见表3。回归方程F检验P<0.01,差异极显著;失拟检验P=0.310>0.05,不显著;相关系数R2=98.13%。综上所述,响应值的变化有98.13%来源于所选变量,模型对实验实际情况拟合较好,可用来预测不同提取条件下的紫椴花多糖理论得率。

表2 Box-Benhnken实验设计方案及结果Table 2 Program and resultofBox-Benhnken experiment design
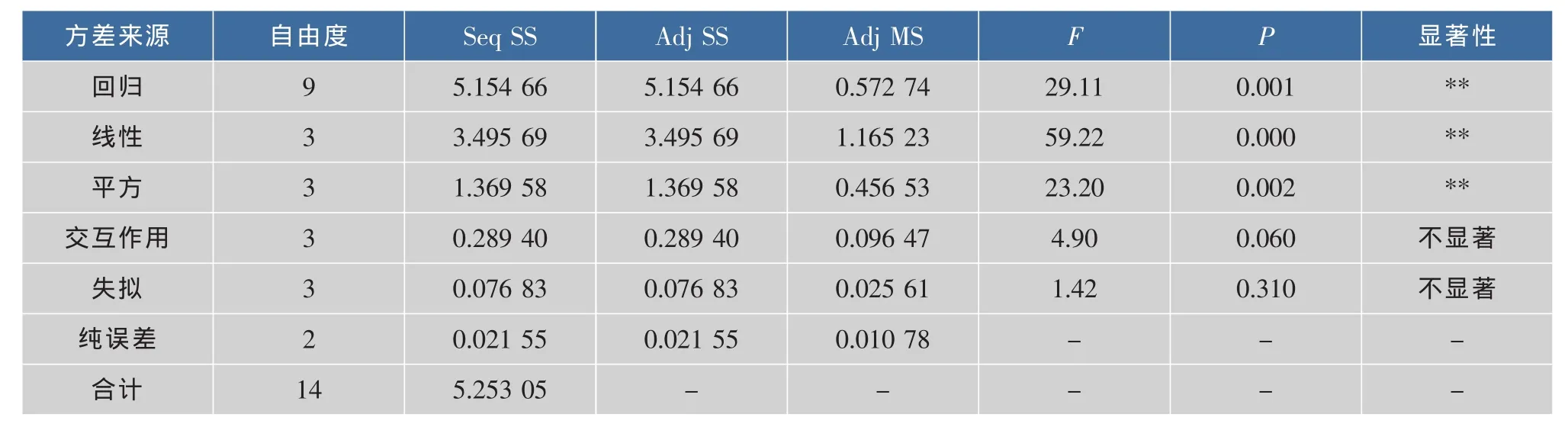
表3 Box-Benhnken设计二次模型方差分析Table 3 Variance analysis of the regression quadmtic model of Box-Benhnken design
回归方程系数显著性检验见表4。可知,对多糖得率的影响达到极显著水平的项为A、B、A2和B2;达到显著水平的项为C、AC和C2。其中微波功率对多糖得率影响最大,微波时间次之。图2为根据回归方程模型做出的3个因素之间交互作用的三维曲面图。自变量的改变对响应值的影响可以通过三维曲面图直观地反映出来。
2.2.3 提取工艺的优化结果与验证实验 根据二次回归方程,将得率Y设定为最大值,计算相应的变量值,得到提取工艺的优化结果:微波时间9.14 min,微波功率 585 W,料液比 1∶67(g/mL),多糖得率模型理论预测值为12.57%。由于实验所用微波炉功率设定的局限性,选择微波时间9 min,微波功率 640 W,料液比 1∶67(g/mL)的工艺条件进行验证实验,在此条件下实际多糖得率为12.05%,模型理论预测值为12.11%,实际值与理论值接近,说明可以通过该模型对实际操作条件下的理论多糖得率进行相对准确的预测。
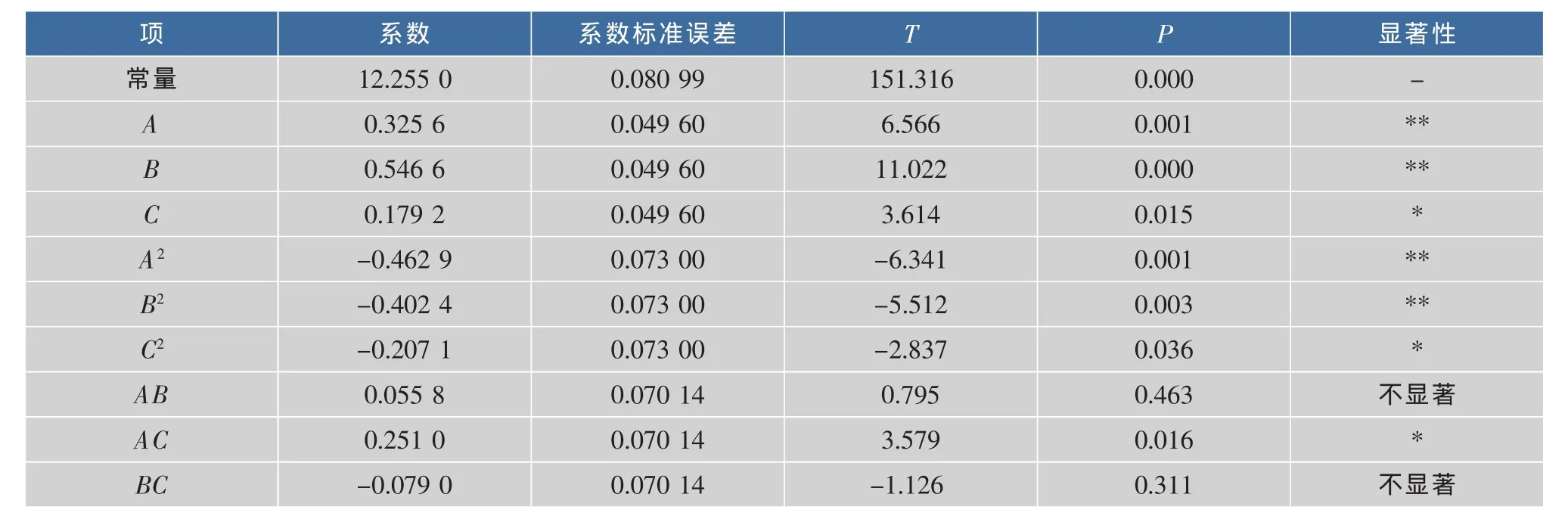
表4 二次模型回归方程系数显著性检验Table 4 Coefficient estimates of regression quadratic model


图2 微波时间、微波功率和料液比交互作用影响的三维曲面图Fig.2 Response surface plot of mutual-influence for microwave time,microwave power and solidliquid ratio on yield
2.3 紫椴花多糖的定性分析及红外光谱分析结果
2.3.1 物化性质分析结果 紫椴花粗多糖为淡黄色纤维状固体,溶于水和甲醇,不溶于无水乙醇和丙酮。碘化反应、斐林试剂反应、班氏试剂反应及三氯化铁反应呈阴性,说明紫椴花粗多糖中不含淀粉、还原糖及酚类化合物;硫酸-咔唑反应和考马斯亮蓝反应呈阳性,说明紫椴花粗多糖中含有糖醛酸和蛋白质。
2.3.2 红外光谱分析结果 由图3可见,3 418 cm-1处的吸收峰是很强的O—H键的伸缩振动吸收峰;2 926 cm-1处的吸收峰是 CH3、CH2和 CH的 C—H键的伸缩振动吸收峰;1 727 cm-1处的吸收峰为羰基吸收峰,说明含有糖醛酸[22];1 419 cm-1和1 378 cm-1处的多重吸收峰是C—H的伸缩和变角振动吸收峰[23];1 323 cm-1处是C—H弯曲振动吸收峰;1 043 cm-1处的则是醇羟基—OH的变角振动吸收峰;1 150 cm-1处的吸收峰是环上碳—氧(C—O)吸收峰;909 cm-1处的小吸收峰是β-糖苷键吸收峰,说明存在β-糖苷键;813 cm-1处的吸收峰是甘露糖的特征吸收峰,表明多糖的糖基中含有甘露糖[24];在 1 616 cm-1处有 NH2和—NH3+的特征吸收峰,说明紫椴花粗多糖中有蛋白多糖。
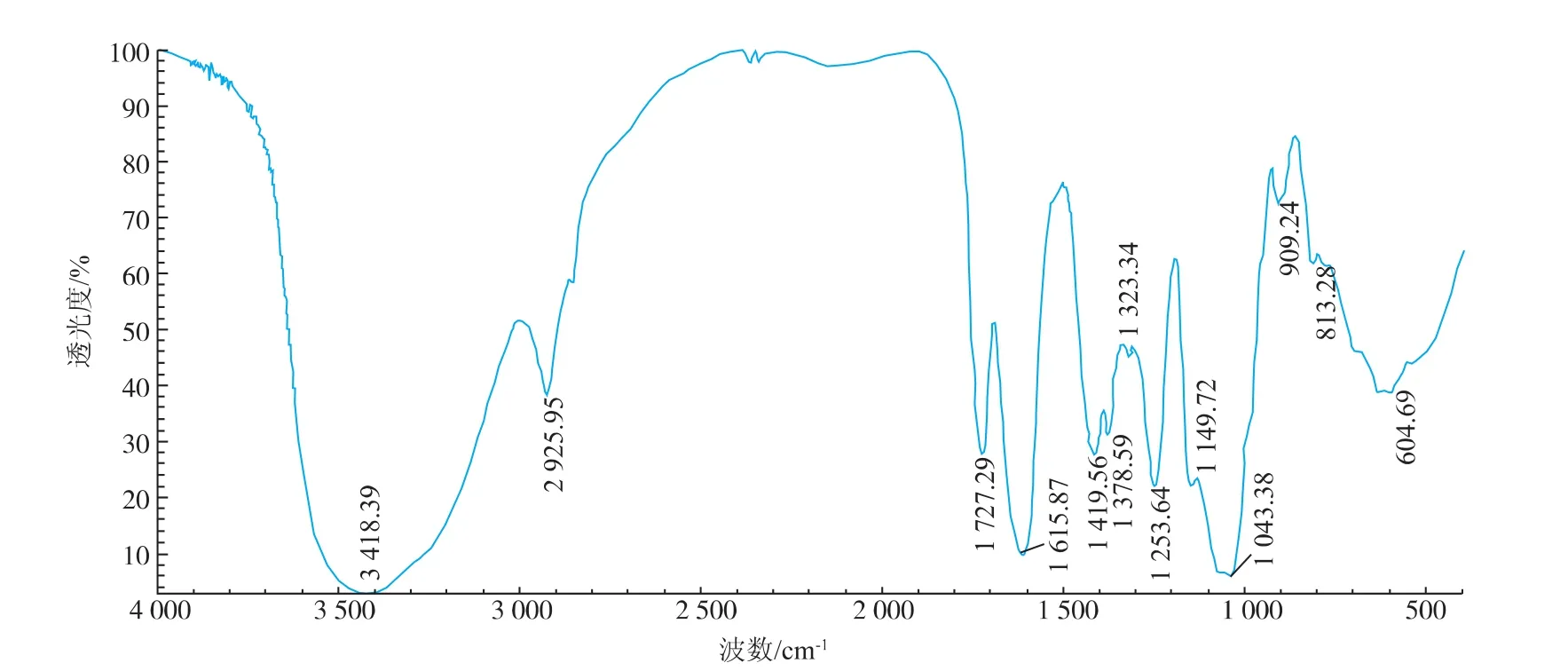
图3 紫椴花多糖红外光谱扫描图Fig.3 Infra-red spectrogram of polysaccharides of Tilia amurensis Rupr
2.4 紫椴花多糖体外抗氧化活性的测定结果分析
2.4.1 紫椴花粗多糖清除DPPH自由基能力的测定结果分析 DPPH自由基在有机溶剂中是一种稳定的自由基,溶液在波长517 nm处有特征吸收峰,呈紫红色。自由基清除剂可与其单电子配对而使其吸收减弱,减弱程度与其所接受的电子数成定量关系,因此可用分光光度法评价自由基的清除情况[25]。如图4(a)所示,一定质量浓度范围内的VC和紫椴花多糖对DPPH自由基都具有一定的清除效果,随着质量浓度的增加,VC对DPPH的清除率基本保持在50%左右,没有显著的量效关系。大多数研究植物多糖清除DPPH自由基活性的文献报道中,VC对DPPH自由基的清除率基本上能达到100%,本实验中未出现这一现象的原因可能是由于DPPH的溶剂不同造成的,因为紫椴花多糖遇乙醇沉淀,故选择用甲醇溶解DPPH;紫椴花多糖对DPPH的清除效果在较低质量浓度范围内时呈现较好的量效关系,质量浓度达到600 μg/mL后,逐渐趋于稳定;且同质量浓度的VC对DPPH的清除效果优于紫椴花多糖的。
2.4.2 紫椴花粗多糖总还原能力的测定结果分析抗氧化剂的抗氧化能力与其还原力有关,还原力越大,抗氧化能力越强。抗氧化剂能够在一定的条件下将Fe3+还原为Fe2+。根据1.2.7之2)的方法,反应后的生成物在700 nm处的吸光度的大小即反映了其抗氧化能力的大小,值越大则样品的还原能力越强[26]。 如图 4(b)所示,不同质量浓度(8~80 μg/mL)的紫椴花多糖溶液具有一定的总还原能力,且随着质量浓度增加呈现线性升高趋势,与同质量浓度的VC相比,紫椴花多糖的总还原能力相对较弱。
2.4.3 紫椴花粗多糖清除羟自由基能力的测定结果分析 H2O2与FeSO4反应(Fenton反应)会产生羟自由基,羟自由基具有很强的氧化能力,通过攻击水杨酸分子中的苯环使其发生氧化反应,生成的有色物质在510 nm处的吸光值与羟自由基的量成正比[27]。若在反应体系中加入抗氧化剂,羟自由基受到抑制,有色物质生成量将会减少。如图4(c)所示,不同质量浓度(200~1800 μg/mL)的紫椴花多糖对羟自由基具有明显的清除作用,且清除率随着质量浓度的增加而升高,当其质量浓度为1 800 μg/mL时,对羟自由基的清除率高达88.19%。VC对羟自由基的清除能力强于同质量浓度的紫椴花多糖,当VC质量浓度为1 800 μg/mL时,羟自由基清除率达到100%。
2.4.4 紫椴花粗多糖抑制脂质过氧化能力的测定结果分析 Fe2+能诱导卵黄中磷脂C-2位上所含的多不饱和脂肪酸(PUFA)发生脂质过氧化反应,生成的过氧化产物丙二醛(MDA)等在加热条件下可与硫代巴比妥酸(TBA)反应生成粉红色的化合物,在波长532 nm处有特征吸收峰,抗氧化剂可在一定程度上延缓或抑制脂质过氧化过程[28-29]。如图4(d)所示,不同质量浓度(400~2000 μg/mL)的紫椴花多糖对Fe2+诱发的脂质过氧化具有显著的抑制作用,且质量浓度越大,抑制作用越强。当紫椴花多糖质量浓度为1 600 μg/mL时,其对脂质过氧化的抑制作用已接近于同质量浓度的VC;当紫椴花多糖质量浓度为2 000 μg/mL时,对脂质过氧化的抑制率已达到75.42%,高于相同质量浓度的VC。
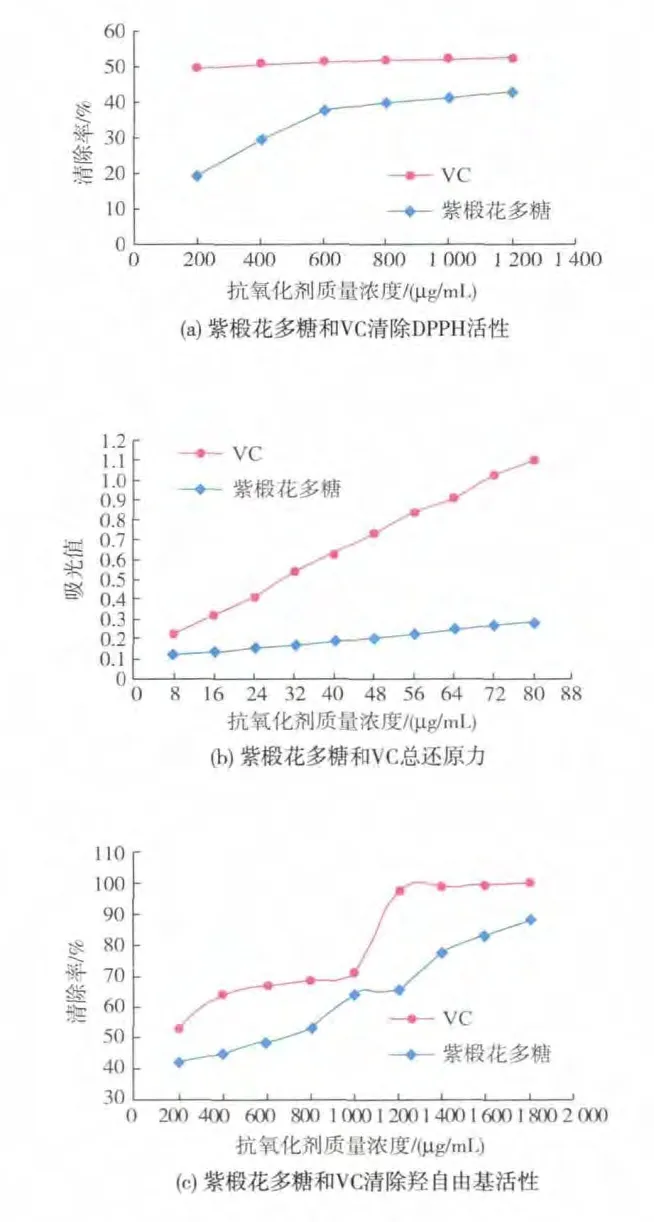
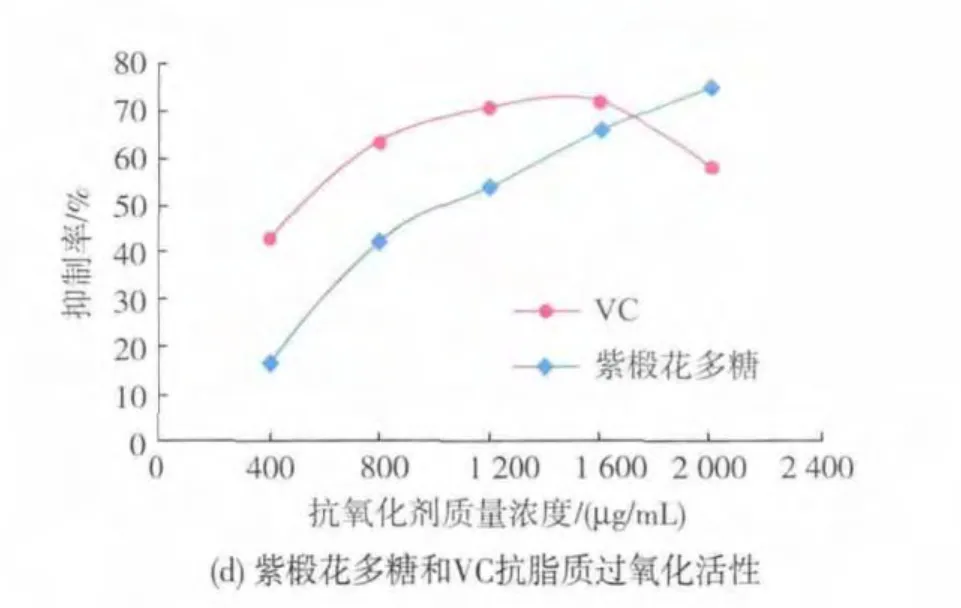
图4 紫椴花多糖和VC的体外抗氧化活性Fig.4 Antioxidant activity in vitro of Tilia amurensis Rupr.polysaccharides and VC
3 结语
微波辅助提取技术具有时间短、效率高、节能等特点。采用微波法提取紫椴花多糖,在单因素实验的基础上,以多糖得率为响应值,微波时间、微波功率和料液比作为自变量,利用Minitab软件进行响应面优化设计实验,得到微波提取紫椴花多糖的最佳工艺条件:微波时间9.14 min,微波功率585 W,料液比1∶67(g/mL),多糖得率模型理论预测值可达到12.57%。验证实验表明,回归模型可以较准确地对实际操作条件下的多糖得率进行预测。
研究表明,机体的衰老、炎症、癌症和免疫疾病等均与体内过剩氧自由基(ROS)有关,其中羟基自由基(·OH)可直接作用于生物膜,引起脂质过氧化反应,危害最大[30-31]。植物多糖作为一类天然自由基清除剂,能够清除和平衡多种活性氧自由基,减少自由基对人体的损伤。本实验的研究结果表明,紫椴花多糖具有还原能力,能够清除DPPH自由基和Fenton反应产生的·OH,同时对Fe2+诱发的脂质过氧化反应有较强的抑制作用,显示出较好的体外抗氧化活性。与同质量浓度的VC相比,其还原力、清除自由基能力稍弱,但其抑制脂质过氧化的效果在达到一定质量浓度后,有强于同质量浓度VC的趋势。紫椴花多糖清除自由基的机制可能与多糖链的结构有关,抑制脂质过氧化的机理可能是其具有螯合金属离子的能力,使其不能产生启动脂质过氧化反应的羟自由基,进而抑制脂质过氧化反应的发生[32]。
作者对紫椴花多糖粗提物进行了体外抗氧化活性评价,有必要在此基础上对其纯化组分的结构、功能及单糖组成进行更加深入的研究,以期为其构效关系提供更加充分的理论依据。同时,可在体外抗氧化实验的基础上对紫椴花多糖的体内抗氧化活性进行研究,为开发安全性高的天然抗氧化剂和保健产品奠定理论基础。
[1]马微微,许颖,穆立蔷.紫椴的研究进展及其资源的开发利用[J].中国林副特产,2009(2):88-90.MA Weiwei,XU Ying,MU Liqiang.The resource development and research progress of Tilia amurensis Rupr.[J].Forest Byproduct and Specialty in China,2009(2):88-90.(in Chinese)
[2]国家中医管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:4312.
[3]Ahn D K.Illustrated Book of Korean Medicinal Herbs[M].Seoul:Kyo-Hak Publishing Co Ltd,2003:56.
[4]Park J H.Medicinal Plants of Korea[M].Seoul:Shinil Book Co,2004:896-900.
[5]穆立蔷,郑健,王洋,等.紫椴花和果实化学成分及其地理变异[J].林业科学,2009,45(4):46-52.MU Liqiang,ZHENG Jian,WANG Yang,et al.Chemical compositions and geographic variation in flowers and fruits of Tilia amurensis[J].Scientia Silvae Sinicae,2009,45(4):46-52.(in Chinese)
[6]马微微.紫椴花抗炎镇痛及抗菌的药效学研究[D].哈尔滨:东北林业大学,2009.
[7]Choi J Y,Seo C S,Zheng M S,et al.Topoisomerase I and II inhibitory constituents from the bark of Tilia amurensis[J].Archives of Pharmacal Research,2008,31(11):1413-1418.
[8]刘立平.紫椴地上器官化学成分的初步研究[D].哈尔滨:东北林业大学,2009.
[9]MU Liqiang,LIU Liping,MA Dalong.Optimal ultrasonic extraction condition and determination of polysaccharides in Tilia amurensis flowers[J].Journal of Forest Research,2010,21(1):77-80.
[10]WU Yan,Steve W Cui,TANG Jian,et al.Optimization of extraction process of crude polysaccharides from boat-fruited sterculia seeds by response surface methodology[J].Food Chemistry,2007,105:1599-1605.
[11]卢丹,吕淼华,姚善泾.微波辅助法提取猕猴桃多糖的条件优化[J].食品与生物技术学报,2010,29(3):401-405.LU Dan,LV Miaohua,YAO Shanjing.Optimization of the extraction of polysaccharides with microwave-assisted extraction from Actinidia chinensis[J].Journal of Food Science and Biotechnology,2010,29(3):401-405.(in Chinese)
[12]ZHONG Kui,WANG Qiang.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrate Polymers,2010,80:19-25.
[13]郭辉娟,魏定国.半夏多糖提取工艺优化及其清除自由基能力研究[J].安徽农业科学,2010,38(34):19341-19342,19345.GUO Huijuan,WEI Dingguo.Study on optimization of extraction process of Pinellia ternate (Thunb.) Breit.polysaccharide and its scavenging effect on radical[J].Journal of Anhui Agricultural Sciences,2010,38(34):19341-19342,19345.(in Chinese)
[14]孟宪军,孙希云,朱金艳,等.蓝莓多糖的优化提取及抗氧化性研究[J].食品与生物技术学报,2010,29(1):56-60.MENG Xianjun,SUN Xiyun,ZHU Jinyan,et al.Extraction and antioxidant capability of blueberry polysaccharides[J].Journal of Food Science and Biotechnology,2010,29(1):56-60.(in Chinese)
[15]SONG Houfang,ZHANG Quanbin,ZHANG Zhongshan,et al.In vitro antioxidant activity of polysaccharides extracted from Bryopsis plumosa[J].Carbohydrate Polymers,2010,80:1057-1061.
[16]谢佳,张静.不同苦瓜多糖的体外抗氧化活性研究[J].广州化工,2010,38(5):87-90.XIE Jia,ZHANG Jing.Study on antioxidant activity in vitro of different polysaccharides from Momordica charantia[J].Guangzhou Chemical Industry,2010,38(5):87-90.(in Chinese)
[17]王希,吴向阳,仰榴青,等.大麦多糖的提取及清除羟自由基活性研究[J].食品研究与开发,2008,29(11):64-67.WANG Xi,WU Xiangyang,YANG Liuqing,et al.Study on extraction and ability to scavenge hydroxyl radicals of polysaccharides from barely[J].Food Research and Development,2008,29(11):64-67.(in Chinese)
[18]张尔贤,方黎,张捷,等.菊花提取物的抗氧化活性研究[J].食品科学,2000,21(7):6-9.ZHANG Erxian,FANG Li,ZHANG Jie,et al.Study on anti-oxidative activity of flos chrysanthemum extract[J].Food Science,2000,21(7):6-9.(in Chinese)
[19]杨颖,孙文武,周晨,等.响应曲面法优化玉竹水溶性多糖提取及体外抗氧化研究[J].食品与生物技术学报,2013,32(3):298-306.YANG Ying,SUN Wenwu,ZHOU Chen,et al.Optimization of water-soluble polysaccharides extraction from rhizome of Polygonatum odoratum using response surface methodology and its antioxidant activities in vitro[J].Journal of Food Science and Biotechnology,2013,32(3):298-306.(in Chinese)
[20]陈小梅,甘纯玑,陈彩玲,等.响应面法优化微波辅助提取浒苔多糖工艺[J].食品研究与开发,2011,32(4):44-48.CHEN Xiaomei,GAN Chunji,CHEN Cailing,et al.Microwave-assisted extraction of polysaccharides from Enteromorpha prolifera(EP) by response surface methodology[J].Food Research and Development,2011,32(4):44-48.(in Chinese)
[21]王磊,刘秀凤,邱芳萍,等.微波辅助提取玉米须多糖及其组成的研究[J].食品与生物技术学报,2009,28(1):72-75.WANG Lei,LIU Xiufeng,QIU Fangping,et al.Extraction of corn-silk polysaccharides by microwave-assisted technology[J].Journal of Food Science and Biotechnology,2009,28(1):72-75.(in Chinese)
[22]夏朝红,戴奇,房韦,等.几种多糖的红外光谱研究[J].武汉理工大学学报,2007,29(1):45-47.XIA Chaohong,DAI Qi,FANG Wei,et al.Research on the IR spectrscopy of kinds of polysaccharide[J].Journal of Wuhan University of Technology,2007,29(1):45-47.(in Chinese)
[23]张赛金,李文权,邓永智,等.海洋微藻多糖的红外光谱分析初探[J].厦门大学学报:自然科学版,2005,44(z1):212-214.ZHANG Saijin,LI Wenquan,DENG Yongzhi,et al.Analysis of marine microalgal polysaccharides by gas chromatography and IR spectroscopy[J].Journal of Xiamen University:Natural Science,2005,44(z1):212-214.(in Chinese)
[24]盖英萍,牟志美,冀宪领,等.桑叶多糖的提取与分析[J].蚕业科学,2005,31(1):31-35.GAI Yingping,MU Zhimei,JI Xianling,et al.The extracting and analyses of polysaccharides in mulberry leaf[J].Acta Sericologica Sinica,2005,31(1):31-35.(in Chinese)
[25]张汇,鄢嫣,聂少平,等.黑灵芝不同部位多糖成分分析及抗氧化活性[J].食品科学,2011,32:56-61.ZHANG Hui,YAN Yan,NIE Shaoping,et al.Monosaccharide composition and antioxidant activity in vitro of polysaccharides from different parts of Ganoderma atrum[J].Food Science,2011,32:56-61.(in Chinese)
[26]LIU Xin,SUN Zhenliang,ZHANG Miansong,et al.Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J].Carbohydrate Polymers,2012,90:1664-1670.
[27]XIONG Shuangli,LI Anlin,HUANG Ni,et al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicus[J].Carbohydrate Polymers,2011,86:1273-1280.
[28]曹炜,宋纪蓉,陈卫军,等.蜂胶对脂质过氧化的抑制作用[J].食品科学,2004,25(1):34-36.CAO Wei,SONG Jirong,CEHN Weijun,et al.Study on the action of propolis inhibit the peroxidation of polyunsaturated fatty acid from yelk lipoprotein induced by Fe2+[J].Food Science,2004,25(1):34-36.(in Chinese)
[29]张强,王松华,孙玉军,等.洋葱中黄酮类化合物体外抗氧化活性研究[J].农业机械学报,2009,40(8):139-142.ZHANG Qiang,WANG Songhua,SUN Yujun,et al.Study on antioxidant activity in vitro of onion flavonoids[J].Transactions of the Chinese Society for Agricultural Machinery,2009,40(8):139-142.(in Chinese)
[30]丁红秀,高荫榆,晁红娟,等.毛竹叶多糖体内抗氧化作用研究[J].食品科学,2008,29(5):427-430.DING Hongxiu,GAO Yinyu,CHAO Hongjuan,et al.Study on antioxidation effect in vivo of polysaccharide from moso bamboo leaves[J].Food Science,2008,29(5):427-430.(in Chinese)
[31]王德才,高丽君,高艳霞.泰山四叶参多糖体外抗氧化活性的研究[J].中国生化药物杂志,2008,29(2):104-106.WANG Decai,GAO Lijun,GAO Yanxia.Antioxidative effects of polysaccharide extracted from Radix Codonopsis Lanceolatae from Mount Taishan in vitro[J].Chinese Journal of Biochemical Pharmaceutics,2008,29(2):104-106.(in Chinese)
[32]梁俊,李建科,赵伟,等.石榴皮多酚体外抗脂质过氧化作用研究[J].食品与生物技术学报,2012,31(2):159-165.LIANG Jun,LI Jianke,ZHAO Wei,et al.Effect of pomegranate peel polyphenols on lipid peroxidation in vitro[J].Journal of Food Science and Biotechnology,2012,31(2):159-165.(in Chinese)
