不同浓度盐胁迫对黄瓜幼苗生长和生理代谢的影响
2014-12-23郭世荣贺超兴孙艳军高文瑞李德翠史珑燕
韩 冰, 徐 刚, 郭世荣, 贺超兴, 孙艳军, 高文瑞, 李德翠, 史珑燕
(1.江苏省农业科学院蔬菜研究所,江苏 南京210014;2.南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室,江苏 南京210095;3.中国农业科学院蔬菜花卉研究所,北京100081)
土壤盐渍化已成为制约农业生产的全球性问题,严重威胁农业的可持续发展。目前,全世界盐渍化程度不断加重的农业用地约有20%,预计2050年这个数字将会超过50%[1]。中国设施蔬菜的连年种植,加上生产过程中化肥的不合理施用和设施内封闭或半封闭的特定环境条件,造成设施土壤次生盐渍化,不利于设施蔬菜的可持续高效生产。
土壤盐渍化是目前影响作物生长和产量形成的主要限制因素[2],这可能是因为盐胁迫影响作物光合作用[3-5]和对水分[6]、养分[7]的吸收,从而影响植物体内氨基酸和蛋白质的合成,使作物生长发育受阻。盐胁迫会引起渗透胁迫、离子毒害等原初效应以及营养亏缺、氧化胁迫等一系列次生胁迫[8],造成植物代谢紊乱,增加渗调物质合成和积累及维持渗透势的能耗,最终加速植物的衰老和死亡。已有研究表明,为了减轻盐胁迫对植株造成的伤害,植物会合成可溶性蛋白、可溶性糖等渗透调节物质[9-10],来提高其渗透调节能力;同时植株体内的酶促保护系统SOD、POD、CAT等抗氧化酶活性升高[11],以有效清除细胞内过多的活性氧自由基,缓解细胞的膜质过氧化作用,减轻盐胁迫对植株造成的伤害。本试验拟采用基质栽培,研究不同浓度NaCl 处理对黄瓜幼苗生长和光合特性、水分吸收和利用、抗氧化酶活性等生理代谢的影响,旨在探明土壤中不同盐浓度对黄瓜幼苗生长和生理代谢的影响。
1 材料与方法
1.1 材料与处理
试验于2009 年9 ~10 月在中国农业科学院蔬菜花卉研究所进行,供试黄瓜(Cucumis sativusL.)品种为抗盐性黄瓜品种新泰密刺,供试基质为混合基质(泥炭∶蛭石=1 ∶1,质量比),采用高和直径均为10 cm 的塑料营养钵进行栽培。试验共设5 个不同浓度(0、0.3%、0.6%、0.9%、1.2%)的NaCl 胁迫处理。选取饱满一致的种子浸种催芽,待种子发芽后播于装有基质的营养钵中育苗,昼温27 ~30 ℃、夜温16 ~18 ℃。待幼苗达到两叶一心后进行NaCl处理,每2 d 浇1 次盐水,共处理4 次,为保证钵内盐浓度,钵下放水盘,如有渗漏,将渗出液反倒回去。于处理后第10 d,进行叶片光合作用参数的测定;第12 d 取叶片和根系,进行相关生理指标的测定,每处理分别取5 株,剪取幼苗根组织和生长点下第2片展开真叶测定,重复3 次。第14 d 对各植株株高、茎粗、地上部和地下部干鲜质量等生长指标进行测定,每处理5 株,重复3 次。
1.2 测定方法
测量幼苗从子叶到生长点的高度,记为株高;测量幼苗与子叶展开方向平行的子叶节的粗度,记为茎粗;分别取幼苗地上部和地下部,用清水冲洗表面杂物,再用去离子水冲洗干净,擦干水分后,称鲜质量,105 ℃杀青15 min,75 ℃烘至恒重,称干质量。
质膜透性测定参照李振国[12]的方法,用相对电导率表示,相对电导率=煮前电导率/煮后电导率×100%表示;MDA 含量采用Herth 等[13]硫代巴比妥酸法;O2·-产生速率采用王爱国等[14]的方法测定;SOD活性按Giannopolitis 等[15]的方法测定;POD活性按照曾韶西等[16]的方法测定;CAT活性采用Dhindsa 等[17]的方法测定;可溶性蛋白含量采用Bradford[18]考马斯亮蓝G-250 法测定。
用LI-6400XT 型便携式光合测定系统于上午9 ∶00 ~11 ∶30 测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。测量时采用开放气路,CO2采自温室外相对稳定的3 ~4 m高的空气中,利用6400 PS 提供光照,光量子通量密度(PFD)设定为1 000 μmol/(m2·s)(人工光源),叶室温度控制在(25±1)℃,CO2浓度为(380±10)μmol/mol,相对湿度(RH)为50%。利用公式Ls=1-Ci/Ca(Ca为空气中CO2浓度)和WUE=Pn/Tr分别计算气孔限制值(Ls)和水分利用率(WUE)。
试验数据采用SAS 软件Duncan 氏多重比较法进行统计分析。
2 结果
2.1 不同浓度NaCl 对黄瓜幼苗生长的影响
由表1 可以看出,在不同浓度NaCl 处理下,黄瓜植株的株高、茎粗、地上部和地下部干鲜质量均显著低于对照,降低幅度随NaCl 浓度的增加而增大。其中,株高和干质量的变化最为明显,0.3%、0.6%、0.9%和1.2% NaCl 处理下,黄瓜幼苗株高分别比对照降低16.45%、30.28%、51.91%和54.71%,地上地下总干质量比对照降低13.3%、35.01%、45.05%和59.81%,表明随着盐胁迫浓度的增加,黄瓜幼苗的生长量显著降低,生长受到盐胁迫的抑制程度显著增大。
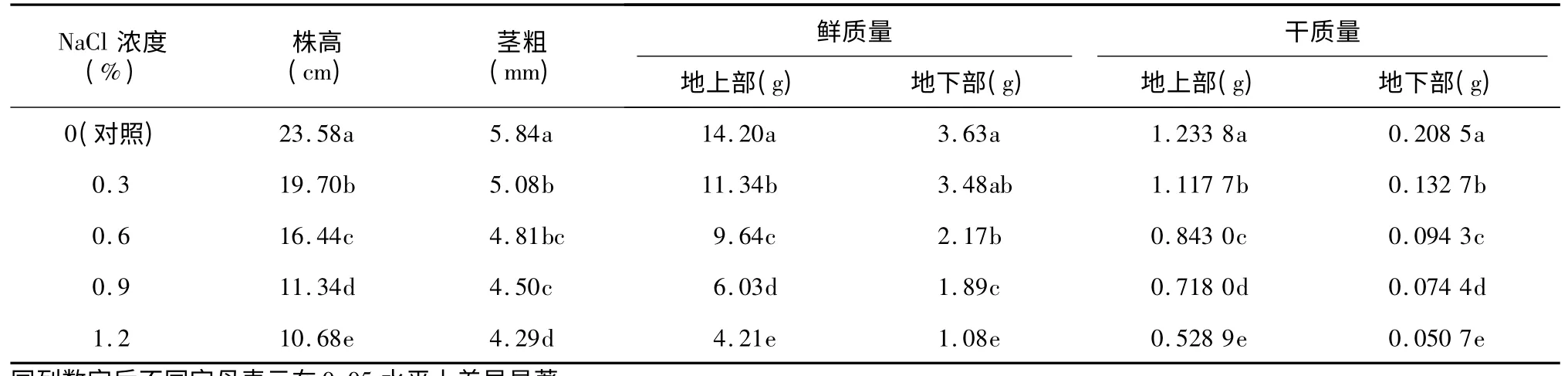
表1 不同浓度NaCl 对黄瓜幼苗生长指标的影响Table 1 Effects of different NaCl concentrations on growth indexes of cucumber seedlings
2.2 不同浓度NaCl 对黄瓜幼苗质膜透性的影响
由图1 可知,各浓度NaCl 处理下黄瓜幼苗叶片和根系相对电导率呈逐渐升高的趋势,且升高幅度随NaCl 处理浓度的增加而增大。其中,叶片相对电导率变化尤其明显,0.3%、0.6%、0.9% 和1.2%NaCl 处理下的黄瓜幼苗叶片相对电导率分别为对照的1.16、1.51、1.77 和1.99 倍。说明叶片受盐胁迫的影响明显大于根系。
2.3 不同浓度NaCl 对黄瓜幼苗光合特性和水分利用的影响
由表2 可以看出,在不同浓度NaCl 处理下,黄瓜幼苗Pn、Tr、WUE均显著降低,且下降幅度随NaCl 浓 度 增 加 而 增 大。0.3%、0.6%、0.9% 和1.2% NaCl 处理下,黄瓜Pn分别比对照降低13.95%、29.92%、46.41%和64.61%,Tr分别比对照降低12.16%、25.98%、37.30%和46.56%。
由表2 可知,在不同浓度NaCl 处理下黄瓜幼苗Gs、Ls和Ci明 显 下 降。0.3% 、0.6% 、0.9% 和1.2% NaCl 处理下,黄瓜幼苗Gs分别比对照降低10.30%、23.19%、41.97%和67.35%,Ls分别比对照降低3.20%、9.82%、15.50%和31.13%。表明黄瓜幼苗Gs和Ls下降幅度随盐胁迫浓度的增加而增大。盐胁迫下虽然Ls降低,使得气孔因素的影响减小,但同时Gs降低使得进入植物细胞的CO2减少。
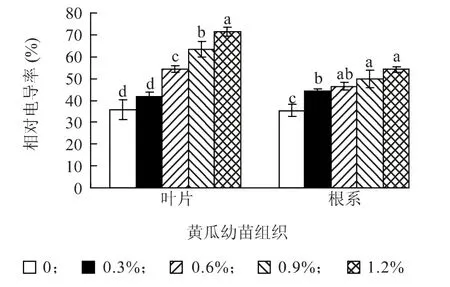
图1 不同浓度NaCl 对黄瓜幼苗叶片和根系质膜透性的影响Fig.1 Effects of different NaCl concentration on membrane permeabilitys in leaves and roots of cucumber seedlings

表2 不同浓度NaCl 对黄瓜幼苗光合特性和水分利用的影响Table 2 Effects of different NaCl concentrations on photosynthetic rates and water use of cucumber seedlings
2.4 不同浓度NaCl 对黄瓜幼苗MDA 含量和产生速率的影响

图2 不同浓度NaCl 对黄瓜幼苗叶片和根系MDA 含量和O2·-产生速率的影响Fig.2 Effects of different NaCl concentrations on MDA contents and O2·- production rates in the leaves and roots of cucumber seedlings
2.5 不同浓度NaCl 对黄瓜幼苗抗氧化酶活性的影响
由图3 可知,随着NaCl 胁迫浓度的增加,黄瓜幼苗体内SOD、POD和CAT活性逐渐升高,且叶片SOD和POD活性变化更加明显,而根系是CAT活性变化更加明显。在0.3%、0.6%、0.9%和1.2% NaCl 处理下,黄瓜幼苗叶片SOD活性分别为对照的2.04、2.65、3.11 和3.45 倍,根系SOD活性分别为对照的1.30、1.83、1.96 和2.14 倍;黄瓜幼苗叶片POD活性分别为对照的1.51、1.97、2.32 和2.65 倍,根系POD活性分别为对照的1.31、1.66、1.84 和2.02 倍;黄瓜幼苗叶片CAT活性分别为对照的1.18、1.42、1.54 和1.63 倍,根系CAT活性分别为对照的1.72、2.10、2.37 和2.67 倍。表明盐胁迫下抗氧化酶活性显著升高,可有效清除黄瓜幼苗体内多余的活性氧,降低膜质过氧化伤害,提高植株对盐胁迫的抗性。

图3 不同浓度NaCl 对黄瓜幼苗叶片和根系SOD、POD 和CAT 活性的影响Fig.3 Effects of different NaCl concentrations on SOD,POD and CAT activities in the leaves and roots of cucumber seedlings
2.6 不同浓度NaCl 对黄瓜幼苗体内可溶性蛋白含量的影响
由图4 可知,在NaCl 处理下黄瓜幼苗叶片和根系可溶性蛋白含量显著升高,且浓度越大可溶性蛋白含量升高越明显。在0.3%、0.6%、0.9% 和1.2% NaCl 处理下,黄瓜幼苗叶片可溶性蛋白含量分别 比 对 照 增 加38.86%、83.67%、109.03% 和134.13%,根系可溶性蛋白含量分别比对照增加45.28%、75.05%、133.41%和141.9%。表明可溶性蛋白含量的升高增强了植物在盐胁迫下的渗透调节能力,有利于增强植株对盐胁迫的抗性。

图4 不同浓度NaCl 对黄瓜幼苗叶片和根系可溶性蛋白含量的影响Fig.4 Effects of different NaCl concentrations on soluble protein contents in the leaves and roots of cucumber seedlings
3 讨论
盐胁迫下,土壤溶液浓度增大,导致根际渗透压加大和水分外流,影响作物对水分、养分的吸收,并产生相应的生理反应影响地上部生长。已有研究表明,黄瓜[19]、高羊茅[20]、番茄[11]等作物在盐胁迫下幼苗株高和生长量减少,生长受到明显抑制,这与本试验研究结果一致。同时还发现盐胁迫对植株生长的抑制作用随盐浓度的增加而增大,1.2% NaCl 处理对植株的生长影响很大,植株很难进行正常的生长,甚至产生死亡现象。
盐胁迫通过影响CO2扩散到结合部位,改变负责光反应的细胞器的结构和功能,以及改变暗反应的化学过程和抑制同化产物转移等途径引起植物光合作用的降低[21]。本试验结果表明,盐胁迫会导致黄瓜幼苗叶片Gs和Tr下降,有利于减少植株体内水分的散失,增强其对盐胁迫的抗性,这与王素平等[22]的研究结果是一致的。Gs的降低会造成光合作用所需的CO2向叶肉细胞运输受阻,但由于盐胁迫引起植物Pn减小,所以光合作用所需的CO2也减少,使CO2在植物细胞中积累,Ci值增大。Ls的减小则说明气孔限制已经不是盐胁迫下影响植物光合作用的主要因素。盐胁迫下供试材料光合作用的减弱,可能造成碳水化合物减少,导致植物生长受到抑制。
在正常情况下,植物体内活性氧产生与清除处于平衡状态,不会导致细胞受到伤害。一旦植物受到环境胁迫,这种平衡体系就会遭到破坏,自由基积累,膜通透性增加,代谢紊乱,致使植物受伤害[23]。积累的氧自由基首先攻击膜系统,膜脂肪酸中的不饱和键被过氧化,最终形成MDA[24]。MDA 能强烈地与细胞内各种成分发生反应,引起酶和膜的损伤,并导致膜结构和生理机能的破坏,其含量是反映细胞膜脂过氧化作用强弱和质膜破坏程度的重要指标[25]。本研究结果表明,盐胁迫处理下,相对电导率、MDA 含量和O2·-产生速率均随盐胁迫浓度的升高而增大。说明盐胁迫会引起细胞膜脂的过氧化,使细胞膜正常结构遭到破坏,相对电导率增大,细胞内物质外渗,对植物产生伤害。
植物体内清除氧自由基的酶促系统包括SOD、POD和CAT。当植物受到逆境胁迫时,其体内会产生大量的氧自由基,于是体内清除过剩自由基的保护酶系统会启动,活性提高。SOD能催化超氧阴离子自由基的歧化反应而形成氧分子和过氧化氢,CAT和POD则进一步分解过氧化氢形成水,三者协同作用,降低植株体内自由基的水平,从而防止自由基对植物造成伤害[26]。NaCl 胁迫对番茄[11]和柑橘[27]的研究结果与本研究结果是一致的,即植物SOD、POD和CAT活性在盐胁迫下显著提升,说明植物可以通过提高自身的抗氧化酶活性来减少活性氧,降低膜脂过氧化作用,减轻盐胁迫造成的伤害。
植物受到盐胁迫逆境时,通过渗透调节降低渗透势,维持细胞膨压是保证体内正常生理功能的重要调节方式。植物体内的可溶性蛋白大多是参与各种代谢的酶类,其含量是植物体总代谢水平的一个重要指标[28]。本试验结果表明,随着盐胁迫浓度的增加,黄瓜幼苗中可溶性蛋白含量呈上升趋势,说明盐胁迫会诱导产生可溶性蛋白,进行渗透调节,从而减少细胞失水,降低盐胁迫给细胞带来的伤害。
综上所述,盐胁迫下,黄瓜幼苗体内光合作用和水分吸收减少,导致了植株生长受到抑制。活性氧和MDA 增多,使细胞膜受到更多的伤害,相对电导率升高,细胞内物质外渗,水分流失,这时可溶性蛋白的含量增加,加强了植株体内的渗透调节作用,有利于植物吸水,同时各种保护酶的活性提高,减轻了膜质过氧化作用对细胞膜的伤害,从而缓解了盐胁迫对植株的伤害。本试验结果表明0.3% NaCl 处理对盐胁迫下黄瓜幼苗生长和各项生理指标影响较小,0.6%和0.9% NaCl 处理下,黄瓜幼苗生物量显著下降,1.2%则达到了黄瓜幼苗生长的极限盐浓度。
[1] VNOCUR B,ALTMAN A.Recent advances in engineering plant tolerance to abiotic stress:achievements and limitations[J].Current Opinion in Biotechnology,2005,16:123-132.
[2] PARIDA A K,DAS A B.Salt tolerance and salinity effects on plants:a review [J].Ecotoxicology and Environmental Safety,2005,60:324-349.
[3] 王素平,郭世荣,胡晓辉,等.盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J].江西农业大学学报,2006,28(1):32-38.
[4] 吕艳伟,何文慧,陈雨鸥,等.盐胁迫对小麦幼苗光合色素含量和细胞膜的影响[J].江苏农业科学,2013,41(6):74-76.
[5] 张丽辉,赵骥民,范亚红.中性盐胁迫对高梁苗期光合特性的影响[J].江苏农业科学,2012,40(8):100-101.
[6] 李娅娜,江可珍,别之龙.植物盐胁迫及耐盐机制研究进展[J].黑龙江农业科,2009(3):153-155.
[7] 郑青松,刘海燕,隆小华,等.盐胁迫对油菜幼苗离子吸收和分配的影响[J].中国油料作物学报,2010,32(1):65-70.
[8] ZHU J K.Plant salt tolerance[J].Trends Plant Sci,2001,6:66-71.
[9] 赵 春.盐胁迫下小麦苗期渗透调节物质含量的变化研究[J].安徽农业科学,2009,37(24):11473-11474.
[10] 李百伟,孙存华,王 丹.CaCl2对NaCl 胁迫下甘薯幼苗叶片渗透调节物质的影响[J].江苏农业科学,2012,40(10):84-85.
[11] 胡晓辉,王素平,曲 斌.NaCl 胁迫下亚精胺对番茄种子萌发及幼苗抗氧化系统的影响[J].应用生态学报,2009,20(2):446-450.
[12] 李振国.植物细胞质膜透性的测定[M]//中国科学院上海植物生理研究所,上海植物生理学会.现代植物生理学实验指南.北京:科学出版社,1999.
[13] HERTH R L,PACKER L.Photoperoxidation in isolated chloroplasts I kinetics and stoichiometry of fatty acid peroxidation[J].Arch Biochem Biophys,1986,125:189-198.
[14] 王爱国,罗广华.植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990(6):55-57.
[15] GIANNOPLTIS C N,RIES S K.Purification and quantitative relationship with water soluble protein in seedling[J].Plant Physiology,1997,59:315-318.
[16] 曾韶西,王以柔,李美如.不同胁迫预处理提高水稻幼苗抗寒期间膜保护系统变化比较[J].植物学报,1997,39(4):
308-314.
[17] DHINDSA R S,PLUMBDHINDSA P,THORPE T A.Leaf senescence correlated with increase levels of memebrane permeability and lipid peroxidation and decrease levels dismutase and catalase[J].Journal of Experimental Botany,1982,32:91-101.
[18] BRADFORD M M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[19] 王素平,郭世荣,李 璟,等.盐胁迫对黄瓜幼苗根系生长和水分利用的影响[J].应用生态学报,2006,17(10):1883-1888.
[20] 朱 义,谭贵娥,何池全,等.盐胁迫对高羊茅(Festuca arundinacea)幼苗生长和离子分布的影响[J].生态学报,2007,20
(12):5447-5454.
[21] 赵可夫.植物耐盐生理[M].北京:中国科学技术出版社,
1993.
[22] 王素平,郭世荣,胡晓辉,等.盐胁迫对黄瓜幼苗叶片光合色素含量的影响[J].江西农业大学学报,2006,28(1):32-38.
[23] KANAZAWA S,SANO S,KOSHIBA T,et al.Changes in antioxidative in cucumber cotyledons during natural senescence comparison with those during dark-induced senescence [J].Physiol Plant,2000,109(2):211-216.
[24] 曾韶西,王以柔,刘鸿先.低温下黄瓜幼苗子叶硫氢基(SH)含量变化与膜脂过氧化[J].植物学报,1991,33(1):50-54.
[25] 李文兵,王燕凌,李 芳,等.水分胁迫下多枝怪柳体内活性氧与保护酶的关系[J].新疆农业大学学报,2007,30(1):30-34.
[26] 孙国荣,彭永臻,阎秀峰,等.干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响[J].林业科学,2003,39(1):165-167.
[27] 甘海峰,刘可慧,傅翠娜,等.NaCl 胁迫对不同柑橘砧木品种抗氧化系统的影响[J].生态环境学报,2010,19(1):183-187.
[28] 刘惠芬,史铭均,高玉葆.不同种群羊草幼苗对渗透胁迫的反应和生理生态适应[J].南开大学学报:自然科学版,2003,36(2):31-35.
