人工合成禽流感M2e/HA0 多肽的免疫原性分析
2014-12-23陆吉虎唐应华刘振兴查国飞侯继波
陆吉虎, 唐应华,3, 田 震, 刘振兴, 查国飞, 陈 辉, 侯继波
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心,江苏 南京210014;2.南京天邦生物科技有限公司,江苏 南京211102;3.南京农业大学动物医学院,江苏 南京210095;4.安徽农业大学动物科技学院,安徽 合肥230036)
禽流感(Avian influenza,AI)是由正黏病毒科、甲型流感病毒属的A 型流感病毒引起的一种禽类感染和/或者疾病综合征[1]。该病主要侵害禽类的呼吸系统、消化系统及神经系统等,产生从无症状或温和症状到高致病性的感染。其中高致病性禽流感(Highly pathogenetic avian influenza,HPAI)表现为高发病率和高死亡率的全身感染,HPAI 的每一次流行,都会引起禽的大量死亡和生产性能的急剧下降,造成极大的经济损失。目前使用的禽流感疫苗,主要是以病毒的膜蛋白质血凝素(HA)或者神经氨酸酶(NA)为关键靶抗原,完全或者主要依靠HA(或NA)诱导产生中和抗体。但是禽流感病毒基因中,HA 和NA 基因突变率很高[2-3],从而导致抗原及致病力的易变异性,针对某一进化分支病毒抗原发展的疫苗对不同进化分支的病毒株缺乏有效的中和活性[4],这加大了禽流感的检测和防治难度。M2蛋白质是禽流感病毒(Avian influenza virus,AIV)中高度保守的蛋白质,在AIV 各亚型的不同毒株之间都具有很高的同源性[5-7],主要以四聚体形式存在于流感病毒粒子表面,能诱导产生保护性免疫应答并且具有一定的交叉保护力[8],因此是研究交叉保护性疫苗的理想抗原。而且,M2 的主要保护性抗原决定簇在M2 的膜外部分,即M2 氨基酸N 端的1 ~24个氨基酸(M2e)[6,9],M2e 同样可以诱导保护性免疫应答[10-11]。本试验参照流感病毒M2 及HA 的氨基酸序列分别设计2 条多肽后进行人工合成并制成油乳剂疫苗进行动物免疫,以期为开发具有交叉保护性的禽流感疫苗打下基础。
1 材料与方法
1.1 材料
1.1.1 试剂 链霉亲和素(Streptavidin,SA)为AMRESCO 公司产品;HRP 标记羊抗鸡IgG 及FITC 标记羊抗鸡IgG 购自Thermo 公司;DMEM 购自GIBCO
公司,96 孔细胞板、ELISA 板均为Costar 公司的产品;禽流感病毒H5(H9)亚型血凝抑制试验抗原(Re-4/Re-6 株)购自哈尔滨维科生物技术开发公司。小牛血清购自杭州四季青生物工程公司;Tween-20、白油、司本-80 等试剂均为国产分析纯试剂;PBS 缓冲液,本实验室配制。
1.1.2 合成肽 根据文献报道,参照流感病毒M2及HA 的氨基酸序列设计2 条多肽,由吉尔生化(上海)有限公司合成。M2e 序列为SLLTEVETHTRN,HA0 序 列 为 ACGLRNSPQRERRRKRGLFGAIAGFIEGGWQGMVCA。同时合成M2e-biotin、HA0-biotin 多肽。
1.1.3 毒株、细胞及SPF 鸡胚 禽流感H9N2 病毒SD01 株(A/Chinken/ShanDong/01/2011)由本实验室分离鉴定为禽流感H9N2 病毒;MDCK 细胞由本实验室冻存。SPF 鸡(鸡胚)系用购自北京梅里亚维实验动物技术有限公司的SPF 种蛋,由本实验室孵化,出壳后饲养于隔离器备用。重组禽流感病毒灭活疫苗(H5N1 亚型,Re-6 株)为哈尔滨维科生物技术公司产品;禽流感(H9 亚型,NJ02 株)灭活疫苗为南京天邦生物科技有限公司有限公司产品。
1.2 方法
1.2.1 多肽疫苗的制备及动物免疫 合成的M2e、HA0 多肽用PBS 溶解后加入4%吐温-80,然后与白油(含4%司本-80)按照1 ∶3 体积比混合并充分乳化配制成油乳剂疫苗,每羽份(0.3 ml)抗原含量为300 μg。100 只SPF 鸡随机分成5 组,每组20 只,母源抗体血凝抑制(HI)效价降低至2lg2 以下后,采用颈部皮下注射法免疫(对照组用PBS 同法免疫)。隔2 周加强免疫1 次,共免疫3 次。第1 次免疫后每2 周翅静脉采血(即分别为一免后的第2、4、6、8周采血)并分离血清用于检测抗体效价。试验分组及免疫情况见表1。

表1 试验SPF 鸡分组及免疫剂量Table 1 The grouping of SPF chickens and immune doses
1.2.2 免疫血清抗体的检测 用微量血凝抑制试验检测血清抗体的HI 效价。ELISA 检测免疫血清抗体的方法简述如下:先用6 μg/ml 链霉亲和素每孔200 μl 包被ELISA 板,于35 ℃湿盒孵育过夜;再加200 μl 2 μmol/ml 合成抗原Biotin-多肽,37 ℃湿盒孵育1 h,用1%BSA 的PBST(含5%吐温-20 的PBS 溶液)溶液37 ℃封闭;待检血清用含0.5%BSA 的PBST 稀释600 倍,分别加入相应孔内,37 ℃孵育1 h;每孔加入100 μl 1 ∶20 000 的HRP 标记的羊抗鸡IgG,37 ℃湿盒反应1 h 后,加入现配制的TMB 底物溶液每孔100 μl,37 ℃显色10 min。每孔加入100 μl 2 mol/L H2SO4终止反应,读取吸光值OD450。比较两种合成肽疫苗免疫后产生的抗体水平。
1.2.3 免疫后血清的病毒中和抗体效价 用固定病毒稀释血清法,将免疫后血清56 ℃灭活30 min后,用含5 μg/ml TPCK(甲苯磺酰-苯丙氨酸氯甲基酮)胰酶的DMEM 培养液进行2 倍倍比稀释,每个稀释度分别与2 000TCID50/ml 禽流感H9 亚型SD01 病毒液等体积混合[12],置37 ℃反应1 h 后,按每孔100 μl 接种至铺成单层MDCK 细胞的96 孔细胞板内。每一个稀释度接种4 个重复孔。同时设病毒对照(200TCID50)、商品灭活疫苗免疫血清及商品灭活疫苗免疫血清与病毒混合液对照。置37 ℃的5% CO2培养箱培养120 h,记录出现CPE(致细胞病变效应)孔数,结果以3/4 以上细胞孔未发生病变的最高稀释度记为有效中和保护效价。
1.2.4 间接免疫荧光检测免疫后血清 用含10%
犊牛血清的DMEM 培养液在37 ℃、5% CO2细胞培养箱内培养MDCK 细胞24 h,弃去上清,加入200TCID50的禽流感H9N2 亚型病毒SD01 株,置于37℃、5% CO2细胞培养箱内孵育20 h。弃掉培养液,用PBS (pH 7.4)洗涤3 次,加-20 ℃预冷的丙酮∶乙醇(6 ∶4),固定5 min,再用PBS 漂洗3 次后干燥。分别加入用PBS 稀释50 倍的检测血清和阴性对照血清,于37 ℃孵育1 h。用PBS 冲洗3 次,加入FITC 标记羊抗鸡IgG,避光37 ℃反应30 min。用PBS 洗涤3 次并风干后用荧光显微镜观察,验证产生的抗M2e/HA0 抗体能否与表达在感染MDCK 细胞表面的M2/HA 结合。
1.2.5 免疫鸡攻毒后的排毒检测 试验鸡第3 次加强免疫后第4 周,对免疫组和对照组均用禽流感病毒H9N2 亚型SD01 株进行滴鼻接种病毒,每只鸡接种病毒108EID50/ml。攻毒后鸡饲养于隔离器中,观察14 d,记录试验鸡死亡及发病情况,同时于攻毒后3 d、5 d、7 d 分别采集喉拭子和肛门拭子。将同一只鸡的喉拭子和肛门拭子混合,8 000 r/min离心5 min 后取上清,以每只0.1 ml 接种10 日龄SPF 鸡胚5 只,36 ℃继续孵化,去除24 h 内死亡的鸡胚,在120 h 后将所有健活鸡胚于4 ℃全部冻死,然后检测各胚的HA 效价。鸡胚尿囊液的血凝价(HA)≥22判为阳性。
2 结果
2.1 免疫血清抗体滴度
M2e/HA0 多肽苗和H5/H9 亚型灭活苗免疫后血清分别用禽流感病毒H5 亚型和H9 亚型血凝抑制检测抗原检测,结果显示M2e/HA0 多肽苗组血清均未检测到HI 抗体,而H5 亚型和H9 亚型灭活苗组免疫后第2 周血清的HI 抗体效价分别为6.49 lg2 和7.06 lg2,第8 周血清的HI 抗体效价分别达9.15 lg2 和9.78 lg2(表2)。
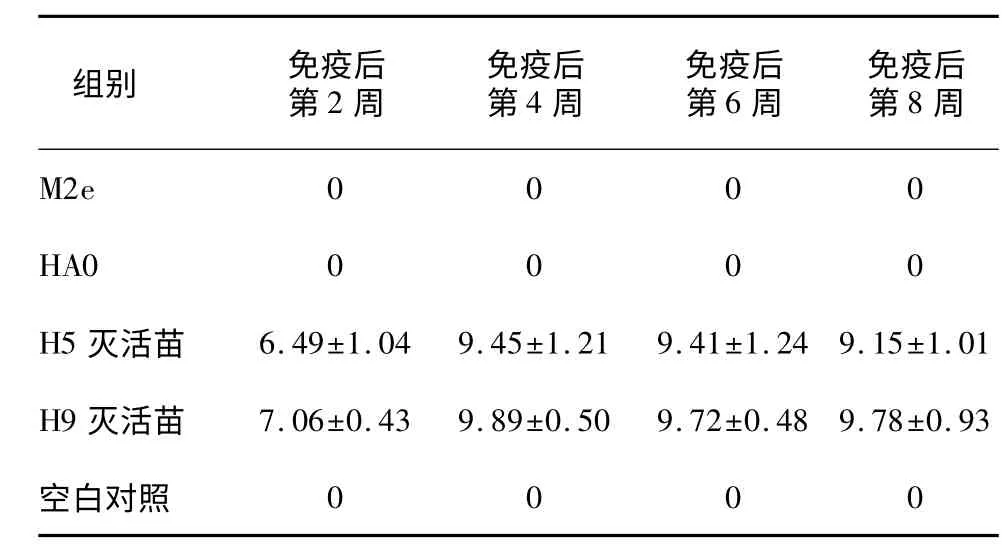
表2 疫苗免疫后血清的HI 效价Table 2 HI titers of serum antibody following immunization
以血清1 ∶600 稀释的OD450值作为抗体滴度,分别以合成的M2e-biotin、HA0-biotin 多肽进行包被检测含M2e、HA0 多肽疫苗免疫后血清的抗体效价。以M2e-biotin 包被检测M2e 多肽及H5 和H9灭活苗免疫组一免后第8 周血清ELISA 抗体效价,分别为0.783、0.223 和0.234(图1A);以HA0-biotin 包被检测HA0 多肽及H5 和H9 灭活苗一免疫后第8 周血清的抗体效价,分别为0.767、0.470 和0.365(图1B)。M2e 和HA0 多肽疫苗免疫后血清的ELISA 抗体效价明显呈上升趋势,且都比H9 和H5 灭活苗免疫后血清的效价高(图1)。

图1 SPF 鸡免疫M2e/HA0 多肽苗后血清ELISA 抗体水平Fig.1 ELISA titers of serum antibody in SPF chicken following vaccination with peptide M2e/HA0
2.2 血清的病毒中和抗体效价
免疫后血清的病毒中和抗体效价判定标准为以3/4 细胞孔未出现病变的最高血清稀释度作为有效中和效价。禽流感H9 灭活苗首免后第4、6、8 周的血清中和效价最高,分别为1 ∶128、1 ∶256 和1 ∶128。两种多肽疫苗免疫血清效价在首免后第8 周HA0 组比M2e 组高(分别为1 ∶16 和1 ∶8),第6周均为1 ∶16。禽流感H5 灭活苗的免疫血清效价远低于H9 灭活苗免疫血清的中和效价,也低于M2e/HA0 多肽苗的免疫血清中和效价(表3)。
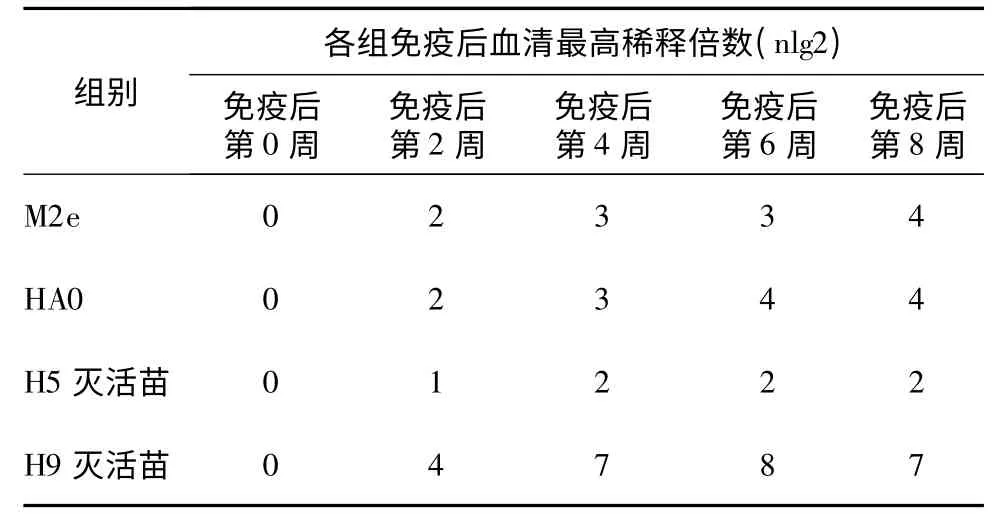
表3 免疫后血清与SD01 株的中和试验结果Table 3 Neutralization test results of immunized chicken serum with strain SD01
2.3 血清抗体间接免疫荧光
如图2 所示,用禽流感H9N2 亚型病毒SD01株感染MDCK 细胞与免疫后的血清孵育后再结合FITC 标记抗体,观察抗原抗体结合特性,荧光显微镜(×10)下观察。H9 和H5 灭活苗组血清均能在MDCK 的胞内产生明亮的荧光颗粒,且H9 灭活苗组含荧光颗粒的MDCK 细胞约达到70%左右(图2A),H5 灭活苗组血清含荧光颗粒的MDCK 细胞约50% 左右(图2B)。多肽苗(M2e/HA0)组含荧光颗粒的MDCK 细胞仅约20%左右,且荧光亮度较弱(图2C、图2D)。阴性血清对照组的细胞表面没有荧光(图2E)。表明免疫血清能够与病毒表达在感染细胞表面的M2 和HA 结合。
2.4 免疫鸡攻毒后排毒检测
对免疫后试验鸡进行攻毒试验,结果见表4。M2e 疫苗组与HA0 疫苗组攻毒后第3 d 分别有9 和10 只鸡出现排毒情况,第7 d 都有所下降,分别为5只和8 只。H9 亚型灭活苗组攻毒后3 d 出现排毒鸡数量与M2e 疫苗组相当,但是7 d 后H9 亚型灭活苗组已经无排毒鸡。

图2 间接免疫荧光检测感染H9 禽流感的MDCK 细胞与血清反应性Fig.2 Fluorescence microscopic observation of the reaction between sera and MDCK cells infected with H9 AIV
表4 禽流感病毒H9N2 亚型SD01 株攻毒后各组鸡的排毒情况Table 4 Virus shedding of chicken groups post challenge with H9N2 subtype AIV strain SD01
3 讨论
AIV 亚型众多,变异快,给检测和防治工作都带来了困难。长期以来,人们期望能够发展通用型禽流感疫苗来达到一劳永逸的免疫预防效果。禽流感的外膜蛋白质包括HA、NA、M2 三类,其中的HA、NA基因突变率最高,而M2 是高度保守的抗原分子,是发展通用型疫苗的理想靶抗原[13]。M2e 蛋白质可诱导产生交叉保护抗体[10-11],Ernst 等[11]用合成的M2e 抗原多肽与佐剂混合后经鼻腔免疫小鼠,攻毒能产生明显的免疫保护;杆状病毒表达的M2蛋白质也能够诱导产生免疫保护并具有交叉保护力[14]。尚书文等[15]将M2基因与鸡IgG Fc 片段基因相串联,在巴斯德毕赤酵母中融合表达,免疫试验证明融合蛋白质可以诱导产生较高水平的抗M2e蛋白质抗体。本试验在对不同亚型禽流感的M2 和HA 氨基酸序列分析比对的基础上,选择了部分保守肽段并适当优化后合成小分子肽段,然后制备成油乳剂疫苗免疫SPF 鸡,同时与市售禽流感H5/H9灭活疫苗进行对比试验。以合成M2e-biotin(HA0-biotin)多肽包被ELISA 板分别检测对应多肽疫苗免疫后的血清抗体效价,结果都比H5 和H9 灭活苗免疫的血清效价高,证明了合成的M2e 和HA0 多肽具有较好的免疫原性,可以诱导产生较高水平的抗体。用禽流感H9 亚型SD01 株病毒对免疫后血清测定中和抗体效价,多肽免疫组最高效价为1 ∶16,远低于H9 血清中和效价(1 ∶256),但是都比H5 灭活苗的免疫血清效价高(1 ∶4),表明合成多肽疫苗具有一定的交叉保护性。在随后的攻毒排毒检测试验结果表明,两个多肽疫苗免疫组都能够有效地抑制试验鸡攻毒后排毒,其中M2e 免疫组抑制效果略好于HA0 免疫组。多肽抗原是完整病毒的一部分,不具有传染性并且可以大量生产,是发展疫苗的途径之一。早在上个世纪,Lerener 等[16]就提出了开发合成肽疫苗的观点,即先确定天然抗原的氨基酸序列
及抗原决定簇肽段,然后合成抗原肽并验证合成肽免疫原性,筛选出具有保护性的抗原肽来制备疫苗。本试验进一步证实了M2e/HA0 多肽具有较好的免疫原性,可以诱导产生保护性抗体,为开发通用型禽流感亚单位疫苗奠定了基础。
[1] 杨德全,葛菲菲,刘 健,等.一株鸭源H4N6 亚型禽流感病毒A/duck/Shanghai/Y20/2006 的全基因组序列测定及遗传演化分析[J].江苏农业学报,2012,28(4):815-822.
[2] WHO.Antigentic and genetic characteristics of influenza A(H5N1)and influenza A(H9N2)viruses and candidate vaccine viruses developed for potential use in human vaccines-February 2010[J].Wkly Epidemiol Rec,2010,85(11):100-107.
[3] SMITH G J,NAIPOSPOS T S,NGUYEN T D,et al.Evolution and adaptation of H5N1 influenza virus in avian and human hosts in Indonesia and Vietnam[J].Virology,2006,350(2):258-268.
[4] WU W L,CHEN Y,WANG P,et al.Antigenic profile of avian H5N1 viruses in Asia from 2002 to 2007[J].J Virol,2008,82(4):1790-1807.
[5] SUGRUE R J,HAY A J.Structural characteristics of the M2 protein of influenza A viruses:evidence that it forms a terameric channel[J].Virology,1991,180(2):617-624.
[6] FRACE A M,KLIMOV A I,ROWE T,et a1.Modified M2 proteins produce heterotypic immunity against influenza A virus[J].Vaccine,1999,17(18):2237-2244.
[7] 闫若潜,杜向党.流感病毒基因组结构及其编码蛋白研究进展[J].动物医学进展,2004,25(1):32-35.
[8] LIU W L,LI H,CHEN Y H.N-terminus of M2 protein could induce antibodies with inhibitory against influenza virus replication[J].FEMS Immunol Med Microbiol,2003,35(2):141-146.
[9] ZEBEDEE S L,LAMB R A.Influenza A virus M2 protein:monoclonal antibody restriction of virus growth and detection of M2 in virions[J].J Vieol,1988,62(8):2762-2772.
[10] NEIRYNCK S,DEROO T,SAELENS X,et a1.A universal influenza A vaccine based on the extracellular domain of the M2 protein[J].Nat Med,1999,5(10):1157-1163.
[11] ERNST W A,HYUNG J K,TERRENCE M T,et a1.Protection against H1,H5,H6 and H9 influenza A infection with liposomal matrix 2 epitope vaccines[J].Vaccine,2006,24(24):5158-5168.
[12] 殷 震,刘景华.动物病毒学[M].北京:科学出版社,1999:336-340.
[13] SCHOTSAERT M,DE FILETTE M,FIERS W,et a1.Universal M2 ectodomain-based influenza A vaccines:preclinical and clinical developments[J].Expert Rev Vaccines,2009,8(4):499-508.
[14] SLEPUSHKIN V A,XITZ J M,BLACK R A,et a1.Protection of mice against influenza A virus challenge by vaccination with baculovirus-expressed M2 protein[J].Vaccine,1995,13 (15):1397-1401.
[15] 尚书文,王秀清,姜 平.禽流感病毒M2e基因与鸡IgG Fc基因在巴斯德毕赤酵母中的融合表迭[J].西北农林科技大学学报:自然科学版,2008,36(1):17-21.
[16] LERNER R A,GREEN N,ALEXANDER H,et al.Chemically synthesized peptides predicted from the nucleotide sequence of the hepatitis B virus genome elicit antibodies reactive with the native envelope protein of Dane particles[J].Proc Natl Acad Sci USA,1981,78(6):3403-3407.
