顺式对叔丁基环己醇的合成及分离研究进展
2014-12-23高丰琴王珊范广高奕红
高丰琴,王珊,范广,高奕红
(咸阳师范学院 化学与化工学院,陕西 咸阳 712000)
顺式对叔丁基环己醇是医药﹑农药、液晶及香料合成的重要中间体[1-3],特别是在香料的合成及配方过程中,其应用日益广泛[4-6]。顺式对叔丁基环己醇的醋酸酯衍生物是高档香料、香皂和洗发液生产的主要原料,而若有反式对叔丁基环己醇醋酸酯衍生物的存在,则会大幅度地降低产品的香味[7-8],而当前文献[9-12]报道通过反应合成出的均是顺/反对叔丁基环己醇的混合物,因此,如何提高所合成出来的顺/反对叔丁基环己醇混合物中顺式异构体的含量,或者如何采用最低廉的方法从顺/反对叔丁基环己醇混合物中提炼出高纯度的顺式对叔丁基环己醇已成为当前众多研究者关注的热点。
1 顺式对叔丁基环己醇的合成研究现状
1.1 以对叔丁基苯酚为起始原料来合成顺式对叔丁基环己醇
1.1.1 以对叔丁基苯酚为起始原料来合成顺式对叔丁基环己醇的机理分析对叔丁基苯酚加氢分两个阶段完成[13-15]:第1 阶段首先生成对叔丁基环己酮中间体;第2 阶段对叔丁基环己酮中间体的加氢还原。由于加氢还原过程中氢原子进攻环己酮的方向不同,无明确的选择性,因而通过加氢反应所合成出来的均为顺/反对叔丁基环己醇的混合物,其反应机理示意图如下:

图1 对叔丁基苯酚加氢合成顺式对叔丁基环己醇的反应机理Fig.1 The reaction mechanism of synthesis of cis-4-tert-butylcyclohexanol with 4-tert-butylphenol via hydrogenation
1.1.2 以对叔丁基苯酚为起始原料来合成顺式对叔丁基环己醇的研究现状以对叔丁基苯酚为起始原料经催化加氢来合成顺式对叔丁基环己醇,在国内研究者并不多,熊前政等[8]曾尝试筛选了Raney-Ni、Pd/C、Pd/Al2O3及Pt/C 等催化剂对对叔丁基苯酚进行液相催化加氢合成顺式对叔丁基环己醇,从其不同催化剂的加氢结果数据来看,顺式的选择性并不理想,加氢反应效果最佳时,顺式对叔丁基环己醇的含量为76.2%,其结果对比见表1。
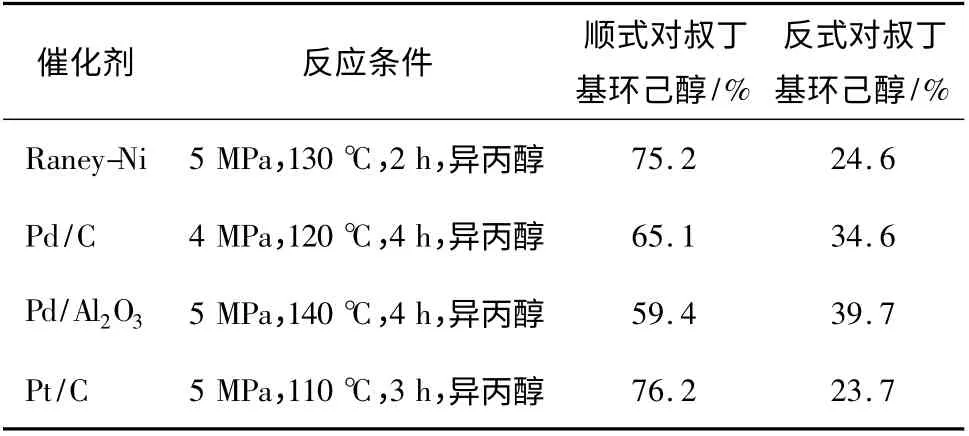
表1 不同催化剂的反应效果对比Table 1 Comparison of the reaction effects of different catalysts
同样是以对叔丁基苯酚为起始原料经催化加氢来合成顺式对叔丁基环己醇,在国外研究者较多[16-17],其中Masahito Sekiguchi 等[13]在此方面做了大量的研究工作,并取得了较为理想的加氢反应效果,其研究发现,以对叔丁基苯酚为起始原料,围绕Rh/C 催化剂做了大量的研究工作,取得了比较理想的加氢反应效果。其研究发现,以Rh/C 为催化剂,环己烷为反应溶剂,当反应温度40 ℃,压力为2.1 MPa,反应时间为0.5 h,反应体系中加入0.60 g 36% 的浓盐酸时,加氢反应完后能得到含量为91.2%的顺式对叔丁基环己醇,其结果对比见表2。分析其加氢过程中,适量酸(36% HCl 和98%H2SO4)的加入对顺式对叔丁基环己醇含量的提高起着极为重要的作用,有文献[7]专门对该加氢过程中加入适量的酸的作用进行了分析,认为加氢反应过程中加入适量的酸主要用来提高反应体系的酸性,在酸性体系中,对叔丁基苯酚不易电离出酚质子,这样,酚质子易与溶剂异丙醇的氧原子或者另一分子对叔丁基苯酚的氧原子孤对电子形成络合物,造成较大的空间位阻,因而加氢顺式选择性好。但加氢反应过程中,加入适量的酸,将会对设备造成一定的腐蚀[18-19],特别是在高压的加氢条件下,存在一定的安全隐患[20-22]。

表2 Rh/C 催化时不同反应条件下的反应效果对比Table 2 Comparison of the reaction effects of different reaction conditions with Rh/C catalysis
1.2 以对叔丁基环己酮为起始原料来合成顺式对叔丁基环己醇
1.2.1 以对叔丁基环己酮为起始原料加氢来合成顺式对叔丁基环己醇以对叔丁基环己酮为起始原料,经加氢还原合成顺式对叔丁基环己醇,其反应相当于以对叔丁基苯酚为起始原料加氢合成顺式对叔丁基环己醇反应的第2 个阶段[23]。文献调研发现,Robert M Weinstein 等[24]以对叔丁基环己酮为起始原料,围绕着Rh/Al2O3催化剂并对其用不同的有机及无机酸进行改性后再进行加氢研究,发现加氢反应效果最佳时顺式对叔丁基环己醇含量为87.7%。Makoto Emura 等[25]同样以对叔丁基环己酮为起始原料,以RuCl2(Ph3P)3催化剂,通过改变各辅料料比,反应压力及时间,发现以异丙醇为反应溶剂,当叔丁基环己酮/RuCl2(Ph3P)3/KOH/三甲撑二胺=10 000 ∶1∶2.2 ∶1,反应压力为0.4 MPa,室温下反应80 h 时,顺式对叔丁基环己醇含量能达到98.3%,其结果对比见表3,但该方法的唯一缺点在于反应时间过长,产能较低,产业化难以取得一定的效益。

表3 RuCl2(Ph3P)3 催化下不同反应条件下的反应效果对比Table 3 Comparison of the reaction effects of different reaction conditions with RuCl2(Ph3P)3 catalysis
1.2.2 以对叔丁基环己酮为起始原料通过强还原剂还原合成顺式对叔丁基环己醇以对叔丁基环己酮为起始原料通过强还原剂还原也是合成顺式对叔丁基环己醇的一种思路,但从所调研的文献来看,依靠强还原剂还原对叔丁基环己酮合成出来的顺式对叔丁基环己醇含量均较低,主要得到的是反式对叔丁基环己醇。国外有研究者曾经尝试用NaBH4[26-28]和KBH4[29-30]还原对叔丁基环己酮,最终得到了含量约75%以上的反式对叔丁基环己醇,顺式对叔丁基环己醇的含量约20%左右。还有研究者尝试用Li(MeBH3)[31]和Li(n-Pr2)NBH3[32]还原剂在0 ℃左右还原对叔丁基环己酮,仅得到了含量95%以上的反式对叔丁基环己醇。同样也有大量的研究者尝试用LiAlH4还原剂还原对叔丁基环己酮[33-35],也同样得到了约90%以上的反式对叔丁基环己醇,之所以强还原剂还原对叔丁基环己酮主要得到反式对叔丁基环己醇,推测其主要原因[36-37]在于:还原剂还原对叔丁基环己酮,属于亲核加成反应,由于叔丁基的较大空间位阻,还原剂会优先从叔丁基的另外一侧进攻羰基形成对叔丁基环己醇盐的形式,然后醇盐经水解或者酸化生成相应的醇,因而还原反应完主要生成产物为反式对叔丁基环己醇。
1.3 顺式对叔丁基环己醇的其它合成方法
除以对叔丁基苯酚和对叔丁基环己酮为原料合成顺式对叔丁基环己醇外,还有少量的文献报道用对叔丁基环己基甲酸[38]、对叔丁基环己烯[39]及对叔丁基环己胺[40]为起始原料来合成顺式对叔丁基环己醇的报道,但此类反应普遍副产物较多,收率偏低,合成成本高昂,难以实现产业化。
2 顺式对叔丁基环己醇的分离研究现状
无论是以对叔丁基苯酚为起始原料,还是以对叔丁基环己酮为起始原料来合成顺式对叔丁基环己醇,尽管有文献报道通过控制反应条件顺式选择性能达到95%及以上,但这种纯度远远达不到当今香料配方的要求。故顺/反对叔丁基环己醇混合物的分离的方法探索也显得尤为重要。国内有研究者[7]曾尝试通过顺/反对叔丁基环己醇空间位阻的差异,用衍生化反应的方法对顺/反对叔丁基环己醇混合物进行分离,其衍生化反应的实验数据如表4所示,从表4 中数据来看,要把1 mol 顺/反对叔丁基环己醇(顺/反为81.89/11.84)中的反式对叔丁基环己醇通过衍生化反应至1% 以下,需要消耗0.35 mol的叔丁基二甲基氯硅烷(TBDMSCl),几乎要损失掉10%左右的顺式对叔丁基环己醇,再经重结晶至顺式对叔丁基环己醇含量为99.56%时,总收率仅为51.9%。该方法虽然对顺/反对叔丁基环己醇的分离效果比较明显,但收率还是偏低,导致实际成本较高,较高的成本极大地限制了该方法的使用及推广。

表4 顺/反对叔丁基环己醇与TBDMSCl 衍生化反应数据Table 4 The derivatization reaction data of cis/trans-4-tert-butylcyclohexanols with TBDMSCl
3 结束语
近年来,香料工业、农药及医药领域对顺式对叔丁基环己醇中间体的需求量逐年增大,而商家们期望其合成成本越来越低廉,纵观顺式对叔丁基环己醇的合成,无论是以对叔丁基苯酚为起始原料,还是以对叔丁基环己酮为起始原料,想通过选择性反应直接得到高纯度的顺式对叔丁基环己醇,目前技术上还不能实现。尽管已经研究出仅通过反应就能得到95%以上顺式对叔丁基环己醇的合成方法,但各种方法都有自身的缺陷,有的合成方法存在潜在的安全隐患,有的合成方法产能较低,这两点在很大程度上均限制了顺式对叔丁基环己醇的产业化及合成成本的降低。针对顺式对叔丁基环己醇国内外的研究现状,要想降低顺式对叔丁基环己醇的成本,必须从以下两点入手:①寻找更加温和,更加廉价的顺式对叔丁基环己醇的合成方法;②寻找顺/反对叔丁基环己醇混合物更为有效的分离方法。上述两个关键点中,只要任何一个关键点能取得突破,均会对顺式对叔丁基环己醇成本的降低产生较为深远的影响。
[1] Lamartine R,Perrin R,Thozet A,et al. Catalytic hydrogenation of organic solids-basic problaems[J]. Molecular Crystals and Liquid Crystals,1983,96:57-70.
[2] Hiyoshi N,Mine E,Rode C V,et al. Control of stereoselectivity in 4-tert-butylphenol hydrogenation over a carbon-supported rhodium catalyst by carbon dioxide solvent[J].Chemistry Letters,2006,35(9):1060-1061.
[3] Nie Y T,Jaenicke S,Bekkum H,et al.Stereoselective cascade hydrogenation of 4-tert-butylphenol and p-cresol over Zr-zeolite beta-supported rhodium[J]. Journal of Catalysis,2007,246(1):223-231.
[4] 毛祥源.新的烷基化法在香料合成中的应用[J].香料香精化妆品,1998,3:19-20.
[5] Mituyoshi O J,Jun Y O.Method for the preparation of cisalkylcyclohexanols:US,4343955[P].1982-08-10.
[6] Werner O D,Rudolf N,Manfred Z H,et al.Process for the production of 2-and 4-tert-butylcyclohexanols with high proportions of cis-isomers by catalytic-hydrogenation of the corresponding tert-butylphenpls:US,4551564[P].1985-11-05.
[7] 何汉江,王小明,郭强,等. 衍生化法合成高纯度顺式对叔丁基环己醇[J]. 化学研究与应用,2012,24(1):157-160.
[8] 熊前政,刘智凌,廖文文,等. 对叔丁基苯酚催化加氢制备顺式对叔丁基环己醇[J]. 精细化工中间体,2002,32(2):25-27.
[9] Bonnekessel M,Ditrich K,Dauwel J,et al. Lipase catalyzed kinetic resolution of substituted cyclohexanols:US,20120135483[P].2012-05-31.
[10]王璟琳,翁卫栋. 一种高顺式乙酸对叔丁基环己酯制备方法:CN,101830798[P].2010-09-15.
[11] Araki N,Nishiama S. Preparation of alkylcyclohexanones from alkylphenols:JP,3206061[P].1991-09-09.
[12] Oshima M,Yoshimoto J. Cis-alkylcyclohexanols:DE,2909663[P].1979-09-27.
[13] Masahito S,Shin T. Process for preparing 4-tert-butylcyclohexanol and 4-tert-butylcyclohexanol acetate:US,5977402[P].1999-11-02.
[14] Yoshida A,Kyochika N,Funada H,et al. Resin binders treated with metalcompounds for foundry mold manufacture:JP,05228575[P].1993-09-07.
[15] Weinstein R M. Process for the preparation of cyclohexanol derivatives:EP,427965[P].1991-05-22.
[16]Hiyoshi N,Rode C V,Sato O,et al.Stereoselective hydrogenation of tert-butylphenols over charcoal-supported rhodium catalyst in supercritical carbon dioxide solvent[J].Journal of Catalysis,2007,252(1):57-68.
[17]Kalantar A,Backman H,Carucci J H,et al.Gas-phase hydrogenation of 4-tert-butylphenol over Pt/SiO2[J]. Journal of Catalysis,2004,227(1):60-67.
[18]蔡广富.酸性气体对设备的腐蚀问题[J].黑龙江科技信息,2012(3):32.
[19]郝新焕,崔轲龙,马红杰,等. 高含硫污水氯化物测定方法的改进和优化[J]. 石油化工腐蚀与防护,2012,29(3):33-37.
[20]崔咏梅,袁达,王延吉,等. 酸性离子液体作催化剂的硝基苯加氢合成对氨基苯酚[J]. 化工学报,2009,60(2):345-350.
[21]陈晓梅,桂建舟,张晓彤,等.甲苯/酸性离子液体两相中顺酐选择性加氢生成四氢呋喃的研究[J]. 工业催化,2006,14(3):31-35.
[22]李立权,朱华兴.加氢裂化装置安全性分析[J]. 炼油技术与工程,2004,34(5):54-60.
[23]Farooq A,Hanson J R.The biotransformation of 4-tert-amyl-and 4-tert-butylcyclohexanone by cephalosporium aphidicola[J]. Journal of Chemical Research Synopses,1996,2:104-105.
[24]Robert M W,Geneva S.Process for the preparation of cyclohexanol derivatives:US,5107038[P].1992-04-21.
[25]Makoto E,Takaaki T,Nobuo S,et al. Process for producing cis-4-tert-butylcy-clohexanol:US,5856590 [P].1999-01-05.
[26] Nishiki M,Miyataka H,Niino Y,et al. Facile hydrogenation of aromatic nuclei with sodium borohydride-rhodium chloride in hydroxylic solvents[J]. Tetrahedron Letters,1982,23(2):193-196.
[27]Spiniello M,White J M.Low-temperature X-ray structural studies of the ester and ether derivatives of cis-and trans-4-tert-butyl cyclohexanol and 2-adamantanol:application of the variable oxygen probe to determine the relative σdonor ability of C—H and C—C bonds[J]. Organic and Biomolecular Chemistry,2003,1(17):3094-3101.
[28] Sarkar A,Rao B R. Reduction of ketones with polydibenzo-18-crown-6-borohydride[J]. Tetrahedron Letters,1991,32(19):2157-2160.
[29] Takasago international corporation. Process for producing cis-4-t-butylcyclohexanol:US,5856590[P].1999-01-05.
[30]Takasago international corporation.Processes for the preparation of alcohols:US,6476278[P].2002-11-05.
[31] Kim S,Lee S J,Kang H J.Lithium methylborohydride.A new stereoselective reducing agent for reduction of cyclic ketones[J]. Synthetic Communications,1982,129(9):723-726.
[32] Fisher G B,Fuller J C,Harrison J,et al. Aminoborohydrides.4.The synthesis and characterization of lithium aminoborohydrides:a new class of powerful,selective,airstable reducing agents[J].Journal of Organic Chemistry,1994,59:6378-6385.
[33]Agami C,Kazakos A,Levisalles J,et al.Stereochimie-LII.controle orbitalaire de la stereochimie des reactions-IIIa:effects des groupes β-fluoro et β-cyano sur la stereochimie la cinetique de la reduction de cyclohexanones par le tritertiobutoxyaluminohydrure de lithium[J]. Tetrahedron,1980,36:2977-2981.
[34]Pearlman B A,Putt S R,Fleming J A.Olefin synthesis by reaction of stabilized carbanions with carbene equivalents[J].Journal of Organic Chemistry,1985,50(19):3622-3624.
[35]Malkar N B,Kumar V G.Chemoselectivity of lithium aluminum hydride-(± )threo-1,16-dibenzyloxy-7,8-dihydroxyhexadecane-methanol complex in reduction of carbonyl compounds[J]. Synthetic Communications,1998,28(6):977-993.
[36]罗枝伟,张逸伟,林东恩.硼氢化钠体系作还原剂对羰基的还原[J].广东化工,2005(3):12-14.
[37]王彩兰,王玉炉,王晓阳,等.α,β-不饱和醛、酮中羰基的选择性还原[J].合成化学,1998,6(4):358-364.
[38] Fossey J,Lefort D. Etude du caractere nucleophile des radicaux lors de reaction de transfert sur la liaison O—O des peracides[J]. Tetrahedron,1980,36(81):1023-1036.
[39]Trainor R W,Deacon G B,Jackson W R,et al.The use of Bismuth(III)acetate in‘wet’and‘dry’prevost reactions[J].Australian Journal of Chemistry,1992,45(8):1265-1280.
[40]Kirmse W,Siegfried R.2-Norbornanediazonium ions revisited[J].Journal of the American Chemical Society,1983,105:950-956.
