不同禾本科牧草种子萌发及幼苗耐盐性鉴定
2014-12-21王晓龙米福贵郭跃武闫利军刘伟伟
王晓龙,米福贵,郭跃武,闫利军,刘伟伟
(内蒙古农业大学 生态环境学院,内蒙古 呼和浩特 010019)
盐碱地是人类面临的世界性问题,主要分布在内陆的干旱和半干旱地区[1]。全世界约有1/3的盐渍化土壤,我国约有3 460万hm2各类盐碱地(盐土中含有NaCl、Na2SO4、CaCO3等;碱 土 中 含 有 Na2CO3、NaHCO3等),而且还呈逐年上升趋势。盐胁迫环境对作物的生长发育产生一系列不利影响,最终影响作物产量的提高[2]。如何有效利用和改善这些盐碱地,已经引起人们的高度重视[3]。在生物措施治理盐碱地方面,人们已对植物抗盐、耐盐生理机理的研究做了大量工作,研究内容不断深入[4]。有关种子萌发及生长发育的耐盐性研究多集中于牧草[5]、草坪草[6]、禾本科作物[7]和经济作物[8]。
牧草有适应性广、抗盐性强的特性,是改良和利用盐碱地的主要植物[9],而禾本科牧草的耐盐性通常又优于作物及(豆科牧草,更是改良盐碱地的良好植物[10]。研究对比鉴定了不同禾本科牧草种子萌发及幼苗的耐盐性,旨在为盐碱地禾本科牧草的栽培利用及耐盐新品种选育提供依据。
1 材料和方法
1.1 供试材料
研究选取了5种在我国东北、华北和西北地区分布与利用较为广泛和普遍的禾本科牧草进行耐盐性鉴定。5种禾草分属3个不同的属,大多为中旱生物种,均具有较强的抗旱和耐寒性,饲用品质亦优良(表1)。
1.2 试验方法
1.2.1 禾草种子萌发期耐盐性测定内容与方法 试验采用培养皿纸上发芽法培养种子,将选出成熟饱满、均匀一致的供试牧草种子置于有双层滤纸的9cm培养皿中,分别加入等量的浓度为0.4%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6% 的 复 盐 溶 液(NaCl与Na2SO4,摩尔比1∶1)进行胁迫。每处理3次重复,种子经粒选之后用0.1%的升汞消毒20min,冲洗3~5次后,每重复用种子50粒,以蒸馏水作为对照。每日16∶00~20∶00用称量法根据水分蒸发量加入蒸馏水以维持盐浓度[11],在光照培养箱中培养,恒温25℃,湿度80%,光照间隔12h,第2d开始观察并记录种子萌发情况,第10d统计发芽率,相对发芽率以每天统计发芽种子数(发芽以胚根突破种皮2mm为标准)[11],将第6d的发芽率定为发芽势,第10d分别称量各品种发芽种子胚根、胚芽的重量。根据公式计算:

表1 供试材料及其来源Table1 Source of tested materials
相对发芽率=处理种子发芽率/对照种子发芽率×100
相对发芽势=处理种子发芽势/对照种子发芽势×100
发芽指数GI=∑GT/DT
式中:GT为T天的发芽数;DT为相应的天数。
胚根/胚芽=胚根重/胚芽重
简化活力指数G.S.=生物量×相对发芽率
式中:S表示生物量,S=胚芽干质量+胚根干质量。
1.2.2 禾草幼苗期耐盐性测定 试验幼苗在温室中培育,先配制土壤,将过2mm目土壤筛的干土、花土和蛭石,以1∶1∶1的比例混合,然后,装入内径为15cm,高度为11cm的塑料花盆中,每盆装土1 500 g,种子200粒撒播,浇自来水使土壤含水量达到75%,以后定期浇水以保持土壤含水量;当幼苗长出3~4片叶子进行盐化处理,处理浓度为0.3%、0.6%、0.9%、1.2%、1.5%的 NaCl与 Na2SO4(摩尔比1∶1)的复盐溶液,每处理3次重复,以自来水为对照(以后每天称重补充损失的水分以防止反盐和保持盐浓度)。处理12d后测定相关指标。
游离脯氨酸含量测定采用酸性茚三酮法;丙二醛含量(MDA)的测定采用硫代巴比妥酸法,参照文献[13]的方法。
1.3 统计分析
采用Excel作图,SAS 9.0软件进行方差分析和多元统计分析。
2 结果与分析
2.1 盐胁迫下供试牧草相对发芽率和相对发芽势
与对照相比,随着盐胁迫的加剧,各供试材料的相对发芽率整体呈下降趋势,垂穗披碱草在0.4%处理时相对发芽率略显上升,高于对照5.2%(图1)。此现象出现可能是低浓度盐胁迫对垂穗披碱草种子萌发有促进作用;盐浓度大于0.6%时,相对发芽率低于对照,说明高浓度盐胁迫抑制种子萌发。无芒雀麦在0.6%处理时出现明显下降,这表明低浓度盐胁迫对无芒雀麦种子萌发有抑制作用,盐浓度在0.6%~1.0%时相对发芽率基本保持不变。当盐浓度大于1.0%时,各材料相对发芽率均有不同程度降低,其中细茎冰草、老芒麦较明显,说明高浓度盐胁迫对种子萌发有较强抑制作用。
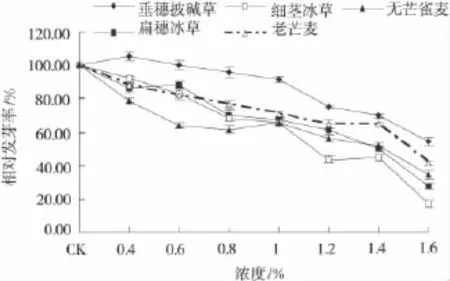
图1 盐胁迫下几种禾本科牧草种子的相对发芽率Fig.1 The relative seed germination rate under salt stress
供试材料相对发芽势也随盐浓度升高而降低(图2),说明种间差异显著。盐浓度在1.5%时,垂穗披碱草与扁穗冰草、细茎冰草、无芒雀麦相对发芽势呈显著性差异(P<0.05)。
2.2 盐胁迫下的发芽指数
5种材料发芽指数随盐胁迫增加变化不大(图3)。细茎冰草和扁穗冰草的变化幅度相对较大,在1.6%处理时,分别为对照的17.1%和27.8%,可能是由于盐胁迫导致发芽时间延迟所致;无芒雀麦和老芒麦由于发芽率较低,因此,发芽指数随盐浓度升高变化不明显;比较盐胁迫下5种材料发芽指数变化情况,垂穗披碱草发芽指数变化相对平缓,材料稳定,耐盐性较强。
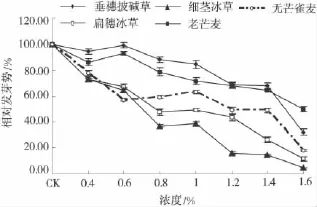
图2 盐胁迫下几种禾本科牧草种子的相对发芽势Fig.2 The relative seed germination potential under salt stress

图3 盐胁迫下几种禾本科牧草种子的发芽指数Fig.3 The germination index changes under salt stress
2.3 盐胁迫下的胚根/胚芽
5种材料的胚根胚芽比的曲线变化趋势较复杂,此现象可能是它们在不同盐胁迫下胚根胚芽的生长状况不同所致。无芒雀麦和细茎冰草低盐浓度下,胚根生长较快,所以其胚根/胚芽值比对照大,在0.4%盐浓度时,比值分别为0.31、0.41,但随盐胁迫增加其胚根生长受到抑制比值降低。垂穗披碱草和老芒麦在低盐胁迫时由于胚芽生长较胚根快,在0.4%处理时胚根/胚芽值分别为0.26、0.37;随着盐梯度的升高,盐胁迫对胚根生长较对胚芽生长的影响小,所以胚根胚芽比值增加,老芒麦在1.6%处理时达到最高,为0.50,其他4种材料的变化与对照相比曲线波动不大,盐浓度大于1.0%条件下,无芒雀麦胚根胚芽比值较其他材料低(图4)。
2.4 盐胁迫下的简化活力指数

图4 盐胁迫下几种禾本科牧草胚根胚芽比Fig.4 The ratio of radicle to germ under salt stress
相对于对照,5种禾草材料的简化活力指数随盐胁迫的加强均表现为降低,在不同梯度盐胁迫下垂穗披碱草简化活力指数均高于其他4种材料,存在显著性差异(P<0.05),其中,垂穗披碱草在浓度0.4%~1.0%时简化活力指数变化较小,盐浓度高于1.0%时下降较大,可能是高浓度盐胁迫严重抑制了胚根胚芽的生长;老芒麦在0%~0.8%盐浓度较其他材料简化活力指数低,可能与发芽率低有关(图5)。

图5 盐胁迫下几种禾本科牧草简化活力指数Fig.5 The simplified vigor index under salt stress
2.5 盐胁迫对牧草幼苗丙二醛含量的影响
丙二醛(MDA)是植物体内膜脂过氧化的产物,其含量与细胞膜系统的伤害程度密切相关,反映了植物细胞伤害的程度[4]。
随着盐胁迫强度的增加,各材料叶片中的MDA含量均有不同程度升高,盐浓度在0%~0.6%时牧草叶片中MDA含量变化幅度较小,说明牧草幼苗对低浓度盐胁迫有一定耐受能力。随着盐胁迫的加剧,无芒雀麦、细茎冰草和老芒麦MDA值变化较大,其中,老芒麦在1.2%盐处理下为对照的1.84倍,细茎冰草在1.5%盐胁迫下是对照的2.26倍,存在显著性差异(P<0.05)。垂穗披碱草和扁穗冰草幼苗随盐浓度的升高,MDA含量增加幅度较其他3种材料低,在盐浓度为1.5%时,分别为对照的1.5 7和1.61倍(图6)。
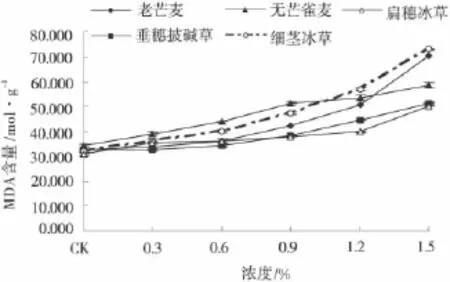
图6 盐胁迫下几种禾本科牧草的MDA含量Fig.6 The MDA contents under salt stress
2.6 盐胁迫对牧草幼苗脯氨酸含量的影响
在逆境条件下游离脯氨酸的积累是植物的普遍反应,不同的盐浓度下植物体内的游离脯氨酸均有不同程度的积累[12,13]。
随着盐胁迫的加强,各禾草叶片脯氨酸含量有不同程度增加,在1.5%盐处理条件下,老芒麦和细茎冰草脯氨酸含量与对照呈显著性差异(P<0.05);细茎冰草在1.5%处理的脯氨酸含量是对照的2.7倍,垂穗披碱草脯氨酸含量增加幅度最小,由此说明在不同的盐浓度梯度下各材料体内的游离脯氨酸均有不同程度积累,游离脯氨酸含量增加幅度越小则该禾草越耐盐,反之则越不耐盐(图7)。

图7 盐胁迫下几种禾本科牧草的脯氨酸含量Fig.7 The proline contents under salt stress
2.7 5种禾本科牧草耐盐性隶属函数分析
用于分析的隶属函数值[X(u1),X(u2)]计算方程为:

式中:X为各鉴定牧草种某一指标的测定值;Xmax为所有鉴定草种此指标的最大值;Xmin为所有鉴定草种此指标的最小值。
若所测指标与植物的耐盐性呈正相关,则采用(1)式计算隶属值,负相关则用(2)式。累加各草种各指标的具体隶属值,并求出平均值后进行比较,平均值越大植物的耐盐性越强[14,15]。
试验对5种禾本科牧草的耐盐性进行综合评价分析(表2),得出各禾草的耐盐能力大小依次为:垂穗披碱草>细茎冰草、老芒麦>扁穗冰草>无芒雀麦。
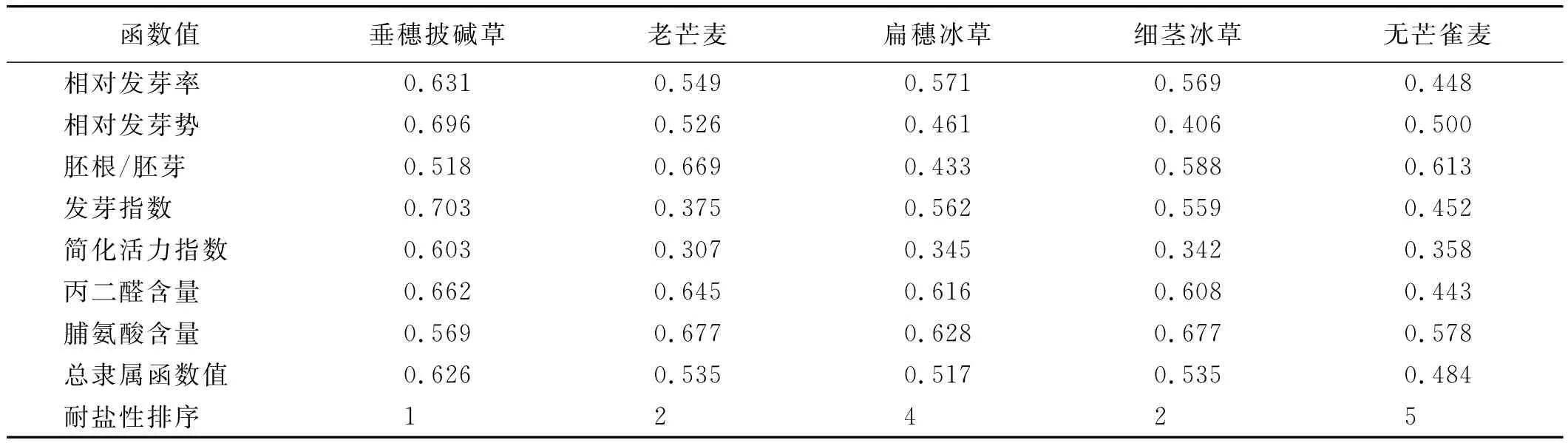
表2 5个禾本科牧草耐盐隶属函数Table2 The salt-tolerant membership function of 5grasses
3 讨论与结论
(1)此次试验在盐浓度为0.4%时,与对照相比垂穗披碱草的相对发芽率提高了5.2%;随着盐胁迫加剧,各材料的相对发芽率、相对发芽势、发芽指数和简化活力指数均呈下降趋势。罗志娜等[16]对24个燕麦品种种子萌发耐盐性综合研究发现,随着盐浓度的增加燕麦品种的发芽率、芽长和根长先升高后降低,低浓度盐胁迫可以促进种子萌发,高浓度盐胁迫对种子萌发有抑制作用,与此次研究结果相一致,抑制作用的大小因材料不同而不同,进而反应了不同禾草材料间耐盐性的差异[17]。
(2)胚根在低盐浓度时由于受到盐刺激使生长得到促进,但变化不大;在1.0%~1.6%浓度条件下,随着盐浓度的增大,盐胁迫对胚芽生长的抑制要大于胚根,所以胚根胚芽比值增加,老芒麦在1.6%处理时达到最高,为0.50。因此,与胚根胚芽有关的指标,如简化活力指数在盐浓度0.4%~1.0%时变化较小,当盐浓度高于1.0%时下降较大,是高浓度盐胁迫对胚芽生长的抑制作用较明显。霍平慧等[18]研究了盐胁迫对苜蓿种子萌发及幼苗生长的影响,结果发现随着盐浓度的升高,苜蓿幼苗的胚根长和上胚轴长呈下降趋势,与本研究结果一致。因此,胚根胚芽以及由它们得到的其他指标可用来比较材料间的耐盐性大小。
牧草种子的耐盐性研究为耐盐植物筛选与早期鉴定提供依据,植物种子能否在盐胁迫下萌发成苗,是保证植物在盐碱条件下正常生长发育的前提,因此,研究盐胁迫下种子的萌发具有重要意义。
(3)MDA是膜脂过氧化的指示化合物[18]。与对照相比,低浓度盐胁迫时幼苗叶片中丙二醛含量和脯氨酸含量变化不明显,只有在高盐胁迫时,其值随着盐浓度升高而变大;处理浓度在0.3%时,各牧草叶片中MDA含量无明显变化;随着盐胁迫的加强,老芒麦在1.2%盐胁迫下为对照的1.84倍;细茎冰草在1.5%处理下的脯氨酸含量是对照的2.7倍。
MDA和脯氨酸是牧草抵抗盐胁迫的重要渗透调节物质,通过增加渗透调节物质含量提高对盐的抵抗能力,维持细胞的正常的生理代谢,使牧草具有一定忍耐或抵抗盐碱的能力[19,20]。研究中当盐浓度在一定范围内禾草能够抵抗一定程度的盐胁迫,随着盐胁迫的加剧,破坏或损伤牧草细胞膜的结构和功能,导致细胞膜透性增加,大量渗透调节物外渗,脂质过氧化作用增强,对幼苗产生影响,所以禾草中 MDA和脯氨酸含量增加,以提高对盐的忍耐和抵抗能力。
总之,低浓度的盐胁迫对禾草的生长具有促进作用,但是超过一定浓度时将抑制禾草幼苗生长。在盐碱地上种植牧草可以减少土壤水分蒸发,一些耐盐碱牧草庞大的根系有利于改善土壤结构[21],因此牧草对盐碱地的改良具有重要作用。
(4)运用隶属函数对5种禾本科牧草的耐盐性进行综合评价,得出各材料的耐盐能力大小为:垂穗披碱草>细茎冰草、老芒麦>扁穗冰草>无芒雀麦。通过分析盐胁迫对不同禾本科牧草种子萌发及幼苗的影响,为牧草耐盐性鉴定、盐碱地牧草栽培和耐盐育种提供参考。
[1] 翁森红,徐恒刚.可在内陆盐碱地上推广的几种禾本科牧草的评价[J].四川草原,1997(1):5-6.
[2] 陈惠哲,Natalia Ladatko,朱德峰.盐胁迫下水稻苗期 Na+和K+吸收与分配规律的初步研究[J].植物生态学报,2007,31(5):937-945.
[3] 乔旭,黄爱军,褚贵新.植物对盐分胁迫的响应及其耐盐机理研究进展[J].新疆农业科学,2011,48(11):2089-2094.
[4] 乔枫,罗桂花,耿贵工.蚕豆幼苗对NaCl和NaHCO3胁迫的生理响应[J].安徽农业大学学报,2011,38(5):783-787.
[5] 张俊叶,张力君,赵青山,等.几种豆科牧草种子萌发期的耐盐性[J].中国草地学报,2012,34(4):116-120.
[6] 李珊,陈静波,郭海林,等.结缕草属草坪草种质资源的耐盐性评价[J].草业学报,2012,21(4):43-51.
[7] 刘志华,时丽冉,白丽荣,等.盐胁迫对獐毛叶绿素和有机溶质含量的影响[J].植物生理与分子生物学学报,2007,33(2):165-172.
[8] 慈敦伟,丁红,张智猛,等.花生耐盐性评价方法的比较与应用[J].花生学报,2013,42(2):28-35.
[9] 沈艳,谢应忠.牧草抗旱性和耐盐性研究进展[J].宁夏农学院学报,2004,25(1):65-69.
[10] 余玲,王彦荣,孙建华.野大麦种子萌发条件及抗逆性研究[J].草业学报,1999,8(1):50-57.
[11] 李淑君,李青丰.塔落岩黄芪种子发芽标准的确定[J].中国草地,1995(4):52-55.
[12] 张志良,瞿伟菁.植物生理学实验指导(第三版)[M].北京:高等教育出版社,2005.
[13] 武永军,何国强,史艳茹.不同pH值缓冲液处理下蚕豆叶片相对含水量、脯氨酸及丙二醛含量的变化[J].干旱地区农业研究,2009,27(6):169-172.
[14] 苏国兴,洪法水.桑品种耐盐性的隶属函数法之评价[J].江苏农业学报,2002,18(1):42-47.
[15] 崔英.三叶草的耐盐性和抗寒性研究[D].内蒙古:内蒙古农业大学,2006.
[16] 罗志娜,赵桂琴,刘欢.24个燕麦品种种子萌发耐盐性综合评价[J].草原与草坪,2012,32(1):34-38.
[17] 田晓艳,刘延吉,张蕾,等.盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J].草原与草坪,2009(6):11-14.
[18] 霍平慧,李剑峰,师尚礼,等.盐胁迫对超干处理苜蓿种子萌发及幼苗生长的影响[J].草原与草坪,2011,31(1):13-18.
[19] Li M,Wang G X.Effect of drought stress on activities of cell defense enzymes and lipid peroxidation in gl-ycyrrhiza uralensis seedlings[J].Acta Ecoloigica Sinica,2002,22(4):503-507
[20] 陈莎莎,姚世响,袁军文.盐生植物灰绿藜对NaCl和NaHCO3胁迫的生理响应[J].新疆农业科学,2010,47(5):882-887.
[21] 刘延吉,张珊珊,田晓艳,等.盐胁迫对NHC牧草叶片保护酶系统,MDA含量及膜透性的影响[J].草原与草坪,2008(2):30-34.
