葡萄糖、维生素C浸泡对普安银鲫胚胎发育中乙酰辅酶A羧化酶、脂肪酸合成酶及肉毒碱棕榈酰转移酶Ⅰ活性的影响
2014-12-21蒋左玉姚俊杰熊铧龙朱忠胜
蒋左玉 姚俊杰 安 苗 熊铧龙 朱忠胜
(贵州大学动物科学学院水产科学系,贵阳 550025)
脂质为鱼类胚胎发育过程中卵黄物质的主要营养成分,其不仅是鱼类胚胎、仔鱼发育过程中主要的代谢能源,而且还参与机体组织的构建和生理活动的调节[1]。葡萄糖作为一种能源物质,水体中添加适宜水平的葡萄糖对水生动物能产生正效应,1.5%的葡萄糖溶液浸泡能明显缩短斑马鱼(Danio rerio)胚胎发育时间,且出膜后仔鱼生长良好[2];将栉孔扇贝(Chlamys ferreri)受精卵放在2 mmol/L的葡萄糖溶液中孵化能显著降低胚胎的畸形率和滞育率,提高幼虫的孵化率[3]。已有研究表明,葡萄糖能促进鱼体内脂质的合成代谢,在军曹鱼(Rachycentron canadum)幼鱼饲料中添加适宜水平的葡萄糖能提高葡萄糖-6-磷酸脱氢酶活性[4],对高首鲟(Acipenser transmontanus)的研究结果也显示,适宜添加水平的葡萄糖试验组鱼体葡萄糖-6-磷酸脱氢酶和苹果酸酶的活性比对照组高[5],同样的研究结果在虹鳟(Oncorhynchus mykiss)[6]中也得到证实。维生素C是鱼、虾、蟹不可或缺的一种营养免疫刺激剂,能维持机体正常代谢、生长[7]。用0.09 g/L的维生素 C溶液浸泡栉孔扇贝胚胎能显著提高其孵化率[3];用40 mg/L的维生素C溶液对刚出膜的六须鲶(Silurus glanis)仔鱼进行浸泡,能使仔鱼提前8 h开口摄食,并使其成活率由自然状态下的5%~20%提高到70%[8]。研究表明,维生素C可以通过参与肉碱的合成而间接促进脂质的代谢,饲料中添加适宜水平的维生素C能促进虹鳟体内脂质代谢,改善能量代谢,达到良性循环[9-10]。
普安银鲫(Carassius auratus gibelio,C.auratus),属鲤形目,鲤科,鲤亚科,鲫鱼属,是在贵州省普安县青山镇一带独特高原环境条件下形成的一种天然雌核发育鲫鱼,其与黑龙江方正银鲫(Carassius auratus gibelio)、云南滇池的高背鲫(Highbacked Carassius auratus)和彭泽鲫(Carassius auratus of pengze)同属于天然雌核发育的鲫鱼,但它们并非同一来源。近年来,由于分布水域不断缩减和过度捕捞,其资源已受到严重影响。为保护这一珍贵的鱼类资源,相关学者已在普安银鲫人工繁育、消化生理及仔稚鱼生长特性等方面开展了研究[11-13]。目前,人们对普安银鲫早期发育的研究仍处于不断研究与探索阶段,胚胎发育孵化率及仔鱼存活率低仍是制约其发展的瓶颈。本文通过探究普安银鲫胚胎发育过程中与脂质合成代谢密切相关的脂肪酸合成酶(fatty acid synthase,FAS)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC),以及与脂质氧化分解密切相关的肉毒碱棕榈酰转移酶Ⅰ(carnitine palmitoyltransferasesⅠ,CPTⅠ)的活性变化规律,并探究葡萄糖溶液和维生素C溶液分别浸泡对其活性的影响,旨在提高该鱼人工繁育的孵化率、仔鱼存活率,为普安银鲫的资源保护和开发利用提供参考。
1 材料与方法
1.1 试验材料
试验在贵州省普安县普安银鲫原种场进行。以普安银鲫为母本,体长(27.91±1.53)cm,体质量(446.64±59.36)g;以兴国红鲤(Cyprinus carpio)为父本,体长(35.21±5.74)cm,体质量(518.14±121.70)g。试验中各时期胚胎样品经过人工催产、干法异源受精后,人工孵化获得。
葡萄糖,分析纯,由成都金山化学试剂有限公司生产;维生素C,分析纯,由天津市石英钟厂霸州市化工分厂生产。
1.2 试验设计
葡萄糖和维生素C浓度筛选:葡萄糖浓度分别为0、5、10、15和20 g/L;维生素 C 浓度分别为0、20、25、30 和 35 mg/L。将受精卵放在 90 cm×50 cm×55 cm的水箱内孵化,孵化水体中卵的平均密度为1 000个/L,每个浓度设6个重复,水温控制在24℃,每8 h全部换1次同温度、同浓度葡萄糖或维生素C溶液。记录出膜时间和孵化率,通过综合比较这2个指标选择最适葡萄糖浓度和维生素C浓度进行后续试验。
采用无添加(对照组)、最适葡萄糖浓度(葡萄糖组)和最适维生素C浓度(维生素C组)的溶液用于孵化,记录出膜时间和孵化率,每组设3个重复,从受精卵至出膜期的整个发育过程均处于相同的试验环境。
用显微镜和解剖镜连续观察,记录发育时间和发育时期。本试验取样标准为50%的胚胎发育至某个时期为取样时间点,在受精卵、原肠中期、晶体出现期和出膜前期4个时期分别取样,用于酶活性测定的样本均取样500个卵或胚胎,将样本用滤纸吸干水分后放入1.5 mL的Eppendof管中,置于-80℃保存。
1.3 指标测定
蛋白质浓度采用考马斯亮蓝法测定。FAS、ACC和CPTⅠ活性均采用比色法,用酶联免疫分析试剂盒测定,具体测定和计算方法参考试剂盒说明书进行。
酶活性分别以比活力[即每毫克蛋白质所具有的活力单位(U/mg prot)]和全活力[即每个卵的总活力(U/个)]表示。
1.4 数据统计分析
试验数据用平均值±标准差表示,采用SPSS 13.0统计软件进行分析,用t检验比较分析试验结果的差异显著性,当 P<0.05时为差异显著,P>0.05时为差异不显著。
2 结果
2.1 不同浓度葡萄糖、维生素C溶液分别浸泡下普安银鲫出膜时间和孵化率
由表1可见,随着葡萄糖和维生素C浓度的增加,出膜时间呈“降低-升高”的变化,孵化率呈“升高-降低”变化。在15 g/L的葡萄糖溶液中,仔鱼能提前出膜 6.6 h,孵化率提高 12.4%。在30 mg/L的维生素 C溶液中,仔鱼能提前出膜4.5 h,孵化率提高 15.6%。
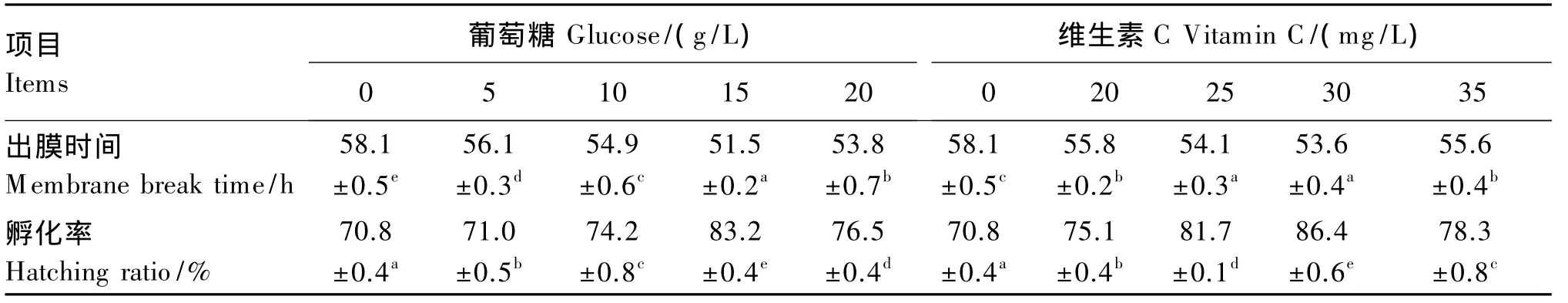
表1 不同浓度葡萄糖、维生素C溶液对普安银鲫出膜时间和孵化率的影响Table 1 Effects of solutions with different concentrations of glucose and vitamin C on membrane break time and hatching rate of C.auratus
2.2 适宜浓度葡萄糖、维生素C溶液分别浸泡下普安银鲫出膜时间和孵化率
由表2可见,葡萄糖组仔鱼能提前出膜6.3 h,孵化率比对照组高12.5%。维生素C组仔鱼能提前出膜 4.4 h,孵化率比对照组高 16.2%。

表2 适宜浓度葡萄糖、维生素C溶液对普安银鲫出膜时间和孵化率的影响Table 2 Effects of solutions with appropriate concentrations of glucose and vitamin C on membrane break time and hatching rate of C.auratus
2.3 葡萄糖、维生素 C溶液对普安银鲫 ACC活性的影响
由表3可见,从受精卵发育至出膜前期,ACC比活力与全活力均呈上升趋势。在原肠中期、晶体出现期和出膜前期,葡萄糖组ACC比活力和全活力均显著高于对照组(P<0.05)。在原肠中期、晶体出现期,维生素C组ACC比活力和全活力虽高于对照组,但差异均不显著(P>0.05);胚胎发育至出膜前期,维生素C组ACC全活力为(0.819±0.012)×10-2U/个,显著高于对照组(P<0.05)。
2.4 葡萄糖、维生素C溶液对普安银鲫FAS活性的影响
由表4可见,在胚胎发育过程中,FAS比活力和全活力均呈上升趋势。在原肠中期、晶体出现期和出膜前期,葡萄糖组FAS比活力和全活力均显著高于对照组(P<0.05)。在原肠中期和晶体出现期,维生素C组FAS比活力和全活力均高于对照组,但差异不显著(P>0.05);到出膜前期 FAS全活力为(0.385±0.034)×10-2U/个,显著高于对照组(P<0.05)。
2.5 葡萄糖、维生素 C溶液对普安银鲫CPTⅠ活性的影响
由表5可见,在胚胎发育过程中,CPTⅠ比活力和全活力呈上升趋势。在晶体出现期和出膜前期,对照组 CPTⅠ比活力分别为(0.502±0.015)和(0.542 ± 0.025)U/mg prot,葡 萄 糖 组 分 别 为(0.548±0.009)和(0.604±0.014)U/mg prot,葡萄糖组显著高于对照组(P<0.05)。维生素 C组CPTⅠ比活力和全活力在整个发育过程中略高于对照组,差异均不显著(P>0.05)。

表3 葡萄糖、维生素C溶液对普安银鲫乙酰辅酶A羧化酶活性的影响Table 3 Effects of glucose and vitamin C solutions on acetyl-CoA carboxylas activity of C.auratus

表4 葡萄糖、维生素C溶液对普安银鲫脂肪酸合成酶活性的影响Table 4 Effects of glucose and vitamin C solutions on fatty acid synthase activity of C.auratus
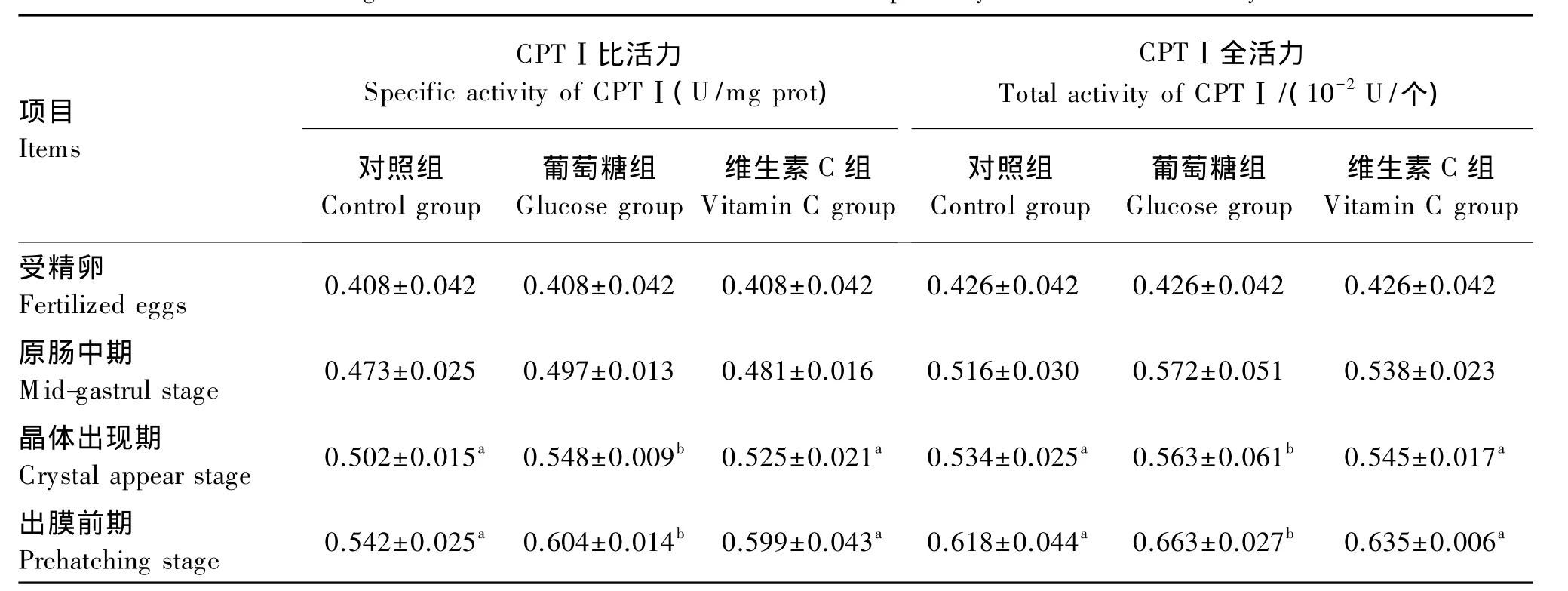
表5 葡萄糖、维生素C溶液对普安银鲫肉毒碱棕榈酰转移酶Ⅰ活性的影响Table 5 Effects of glucose and vitamin C solutions on carnitine palmitoyltransferasesⅠ activity of C.auratus
3 讨论
3.1 葡萄糖浸泡下普安银鲫胚胎发育中ACC、FAS和CPTⅠ活性变化特点
鱼类胚胎发育过程中脂质代谢酶的活性变化对于鱼体的脂质营养代谢发挥着至关重要的作用。乙酰辅酶A是脂肪酸合成的直接原料,主要来自葡萄糖的氧化脱羧[14]。ACC是催化脂肪酸合成代谢第1步反应的限速酶,对脂质代谢起着至关重要的作用,而动物体沉积所需要的脂肪酸大多来自脂肪酸的从头合成,即由FAS催化乙酰辅酶A、丙二酸单酰辅酶A和NADPH合成甘油三酯,从而在动物体脂沉积中发挥重要作用。已有的研究表明,葡萄糖能促进鱼体内脂质的合成代谢。葡萄糖-6-磷酸脱氢酶和苹果酸酶是参与脂肪酸合成的重要酶,饲料中以葡萄糖为糖源饲喂虹鳟16周能显著提高这2种酶活性[4],此结果在对军曹鱼幼鱼[5]和高首鲟[6]的研究中也得证实。同时Girard等[15]的研究结果也表明,饲料中糖对FAS和ACC活性都有激活作用。本试验结果表明,从原肠中期发育至出膜前期,葡萄糖组胚胎FAS和ACC活性均显著高于对照组,其可能原因为外源葡萄糖进入胚胎为脂肪酸的合成代谢提供了大量的乙酰辅酶A,从而诱导FAS和ACC的分泌,为胚胎内脂肪酸的沉积提供了保障。
CPTⅠ作为线粒体脂肪酸β-氧化过程中的关键酶之一,对脂肪酸的β-氧化分解供能起着至关重要的作用,CPTⅠ能催化脂酰辅酶A生成脂酰肉毒碱,从而得以通过线粒体内膜进行β-氧化。当脂肪酸动员作用加强时,机体需要脂肪酸供能,此时CPTⅠ活性增加[14]。研究表明,脂质为鱼类胚胎发育中卵黄物质中的主要营养成分,在胚胎发育的早期,脂质的利用相对较少,而胚胎发育至器官形成期,卵黄中的脂质作为主要的营养物质被代谢利用[16]。在普安银鲫整个胚胎发育过程中,原肠中期后是各种组织器官分化及形成的关键时期,需要消耗大量的能量,脂质含量显著下降[17],说明脂质分解作用加强,而CPTⅠ活性增加有利于胚胎分解利用脂质。研究表明,在罗非鱼(Oreochromis niloticus)饲料中糖添加量的增加会使磷酸戊糖途径的代谢速度加快,从而增强脂质的合成作用[18]。而鱼类可调节酶的合成与分泌来形成新的代谢水平,以适应营养条件的改变,本试验结果表明,葡萄糖组CPTⅠ活性也不同程度地高于对照组,其可能原因为胚胎中沉积的脂肪酸为CPTⅠ的氧化分解提供了适宜的底物,从而提高CPTⅠ的活性,以确保胚胎内脂质代谢的动态平衡。
3.2 维生素C浸泡下普安银鲫胚胎发育中ACC、FAS和CPTⅠ活性变化特点
鱼类胚胎期生理代谢活跃,会产生大量的自由基,影响胚胎发育,而维生素C作为一种抗氧化剂,是鱼类为维持正常的生理功能而必须从食物中获得的一类微量有机物质,在鱼类生长、代谢、发育过程中发挥着重要的作用。维生素C对清除胚胎代谢过程中产生的氧自由基具有重要作用,能保证卵膜结构的完整[19]。鱼卵中高含量的维生素C对后代的早期生存有重要作用,鲈鱼(Dicentrarchus labrax L.)和鲷鱼(Sparus aurata L.)卵中积累较多的维生素C可保护卵子免受氧化损伤,调控胚胎发育过程中卵内物质和能量代谢,从而有效促进鲈鱼和鲷鱼的早期胚胎发育[20]。研究表明,肉碱是一种具有多种生理功能的添加剂,主要参与机体的能量代谢,是脂肪酸进入线粒体进行β-氧化的载体,是转化脂肪生成能量的关键,而维生素C能通过参与肉碱合成而间接促进脂质的代谢,从而增加脂质代谢和蛋白质的良性循环,改善能量代谢[10]。当维生素 C缺乏时,肉碱合成减少,以致脂肪的 β-氧化减少[21]。在草鱼(Ctenopharyngodon idellus)的饲料中添加适量的肉碱可调节脂质代谢酶的活性来维持机体脂质代谢的动态平衡[22];在中华鳖(Pelodiscus sinensis)的研究中也表明适宜添加量的肉碱能同时增强中华鳖脂质的合成和分解代谢[23]。本试验中,维生素C组ACC、FAS和CPTⅠ比活力和全活力均高于对照组,其原因可能有2个:一是维生素C在脂质代谢中发挥了抗氧化功能,采用适宜浓度的维生素C溶液浸泡普安银鲫胚胎,降低了机体的损伤,提高了普安银鲫胚胎的免疫力,使其在抗氧化过程中维持维生素E和β-胡萝卜素的水平,阻断脂肪的氧化链,避免细胞膜遭受氧化损伤[24]。同时保护脂质膜免受过氧化损害,防止脂肪酸过氧化,有利于免疫功能的发挥[4]。二是维生素C参与肉碱合成间接促进了脂质代谢,诱导胚胎期ACC、FAS和CPTⅠ的分泌,导致维生素C溶液浸泡下的胚胎体内3种脂质代谢酶活性升高,表明适宜浓度的维生素C溶液对普安银胚胎发育过程中体内脂质代谢具有促进作用,但具体机理还有待进一步研究。
4 结论
① 葡萄糖浓度为15 g/L,维生素C浓度为30 mg/L时能获得最短出膜时间和最高的孵化率。
②胚胎发育过程中,FAS、ACC和CPTⅠ比活力和全活力均呈上升趋势。
③15 g/L葡萄糖溶液浸泡显著提高了原肠中期、晶体出现期和出膜前期ACC和FAS比活力和全活力以及晶体出现期和出膜前期CPTⅠ比活力和全活力。
④30 mg/L维生素C溶液浸泡显著提高了出膜前期ACC、FAS全活力。
⑤15 g/L葡萄糖和30 mg/L维生素C溶液浸泡能促进普安银鲫胚胎发育过程中ACC、FAS和CPTⅠ的合成与分泌而形成新的代谢水平,以维持胚胎中脂质代谢的动态平衡。
[1] CEJASJR,ALMANSA E,JÉREZ S,et al.Changes in lipid class and fatty acid composition during development in white seabream(Diplodus sargus)eggs and larvae[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2004,139(2):209-216.
[2] 李俊霞.葡萄糖、蔗糖、氯化钠对斑马鱼胚胎发育的影响[D].硕士学位论文.济南:山东师范大学,2007.
[3] 薛凌展.环境和营养因子对四倍体栉孔扇贝胚胎及早期幼虫的影响[D].硕士学位论文.福州:福建师范大学,2008.
[4] CUI X J,ZHOU Q C,LIANG H O,et al.Effects of dietary carbohydrate sources on the growth performance and hepatic carbohydrate metabolic enzyme activities of juvenile cobia(Rachycentron canadum Linnaeus)[J].Aquaculture Research,2010,42(1):99-107.
[5] HUNG S S,FYNN-AIKINS F K,LUTES P B,et al.Ability of juvenile white sturgeon (Acipenser transmontanus)to utilize different carbohydrate sources[J].The Journal of Nutrition,1989,119(5):727-733.
[6] HUNG S S,STOREBAKKEN T.Carbohydrate utilization by rainbow trout is affected by feeding strategy[J].The Journal of Nutrition,1994,124(2):223-230.
[7] LIGHTNER D V,HUNTER B,MAGARELLI PC,et al.Assorbic acid:nutritional requirement and role in wound repair in penaeid shrimp[J].Proceedings of the World Mariculture Society,1979,10(1/2/3/4):513-528.
[8] 季延滨,陈成勋,王祥,等.维生素在提高六须鲶育苗成活率中的应用[J].中国水产,2007(11):60-61.
[9] JOHN T M,GEORGE J C,HILTON J W,et al.Influence of dietary ascorbic acid on plasma lipid levels in the rainbow trout[J].International Journal for Vitamin and Nutrition Research,1978,49(4):400-405.
[10] 颉志刚,牛翠娟.维生素C在鱼类营养与饲料研究中的重要作用及应用[J].饲料广角,2003(13):29-32.
[11] 梁正其,马珊,姚俊杰,等.普安银鲫胚胎发育的初步研究[J].水产科学,2012,31(6):316-320.
[12] 梁正其,姚俊杰,熊铧龙,等.普安银鲫仔稚鱼的发育及生长研究[J].水产科学,2013,32(7):380-384.
[13] 姚俊杰,梁正其,冯亚楠,等.普安银鲫消化系统胚后发育的组织学观察[J].贵州农业科学,2013,41(11):152-155.
[14] 邹思湘.动物生物化学[M].4版.北京:中国农业出版社,2005:181-196.
[15] GIRARD J,PREDERAU D,FOUFELLE F,et al.Regulation of lipogenic enzyme gene expression by nutrients and hormones[J].The Journal of the Federation of American Societies for Experimental Biology,1994,8(1):36-42.
[16] GUNASEKERA R M,DE SILVA S S,INGRAM B A.Early ontogeny-related changes of the fatty acid composition in the percichthyid fishes trout cod,Maccullochella macquariensis and Murray cod,M.peelii peelii[J].Aquatic Living Resources,1999,12(3):219-227.
[17] 牟洪民,马珊,姚俊杰,等.普安银鲫胚胎发育早期的总脂与脂肪酸变化[J].西南农业学报,2012,25(5):1925-1928.
[18] SHIMENO S,MING D C,TAKEDA M.Metabolic response to dietary carbohydrate to lipid ratios in Oreochromis niloticus[J].Nippon Suisan Gakkaishi,1993,59(5):827-833.
[19] De MENEZES G C,TAVARES-DIASM,ONO E A,et al.The influence of dietary vitamin C and E supplementation on the physiological response of pirarucu,Arapaima gigas,in net culture[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,2006,145(2):274-279.
[20] TEROVA G,SAROGLIA M,PAPP Z G,et al.Dynamics of collagen indicating amino acids,in embryos and larvae of sea bass(Dicentrarchus labrax)and gilthead sea bream(Sparus aurata),originated from broodstocks fed with different vitamin C content in the diet[J].Comparative Biochemistry and Physiology Part A:Molecular& Integrative Physiology,1998,121(2):111-118.
[21] FELLER A G,RUDMAN D.Role of carnitine in human nutrition[J].The Journal of Nutrition,1988,118(5):541-547.
[22] 田娟,冷向军,李小勤,等.肉碱对草鱼生长性能,体成分和脂肪代谢酶活性的影响[J].水产学报,2009,33(2):295-302.
[23] 占秀安,许梓荣.肉碱对中华鳖脂肪代谢的影响[J].浙江大学学报:农业与生命科学版,2002,28(1):70-73.
[24] ODEH R M,CORNISH L A.Natural antioxidants for the prevention of atherosclerosis[J].Pharmacotherapy:The Journal of Human Pharmacology and Drug Therapy,1995,15(5):648-659.
