过氧化氢诱导的奶牛乳腺上皮细胞氧化损伤模型的建立
2014-12-21闫素梅史彬林石惠宇郭晓宇李俊良
金 鹿 闫素梅 史彬林 石惠宇 郭晓宇 李俊良
(内蒙古农业大学动物科学学院,呼和浩特 010018)
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤[1]。当机体遭受到体内外各种有害刺激时,氧化系统和抗氧化系统平衡失调,自由基的产生量会远远超过机体的清除能力,抗氧化系统不能及时的清除就会导致过多的自由基,从而导致氧化应激[2]。奶牛由于泌乳期间的高代谢率,往往会产生大量的活性氧(reactive oxygen species,ROS),导致乳腺的氧化应激,尤其对于高产奶牛[3]。奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMEC)是乳腺组织的主要构成细胞,是乳脂和乳蛋白合成与分泌的重要场所,其细胞的生物合成能力决定了奶牛乳腺的产奶能力[4]。由于奶牛泌乳期间代谢旺盛,BMEC是乳腺组织受到氧化应激首先攻击的细胞[5]。因此,BMEC是建立奶牛氧化应激模型的理想组织细胞,建立一个成功可靠的BMEC氧化应激模型,对于揭示氧化应激机制、研究有效的抗氧化措施、提高抗氧化功能和产奶性能具有重要的意义。过氧化氢(hydrogen peroxide,H2O2)是一种重要的活性氧,极易穿过细胞膜,与细胞内亚铁离子(Fe2+)通过Fenton反应形成高活性的自由基,导致一系列反应,因H2O2容易获得,性质相对稳定,操作简单,是目前研究各类细胞氧化损伤的重要工具[1]。目前,以H2O2为应激源构建细胞氧化损伤模型的报道中,关于H2O2作用浓度与时间的 差 别 较 大。 韩 飞 等[6]用 10、100 和1 000μmol/L H2O2作用人肝癌细胞(HepG2)4 h后,结合细胞存活率及对DNA损伤程度结果,选择100μmol/L作为HepG2细胞氧化模型的适宜浓度。彭亮等[7]选用人的脐静脉内皮细胞为试验材料,最终选择1 000μmol/L H2O2作用1 h来构建其氧化损伤模型。由此可见,不同的细胞对于抵抗外界应激源的反应敏感程度不同,所以构建氧化损伤模型使用的H2O2作用浓度与作用时间也不同。可见,目前大多数氧化应激模型的建立都集中于肝细胞或者是医学领域的心肌细胞,对于BMEC的氧化应激模型建立的研究鲜见,而关于建立BMEC氧化损伤模型的判别标准的研究则尚未见报道。鉴于此,本试验通过研究H2O2的作用浓度和作用时间对BMEC存活率和抗氧化指标的影响,研究建立BMEC氧化损伤模型,为进一步深入研究BMEC的氧化应激机制和抗氧化措施奠定基础。
1 材料与方法
1.1 试验材料
DMEM/F12培养基、胎牛血清、胰岛素转铁蛋白溶液、胶原酶Ⅱ、胰蛋白酶/乙二胺四乙酸(EDTA)、双抗均购自美国Gibco公司;H2O2、表皮生长因子、氢化可的松、催乳素、两性霉素B均购自美国Sigma公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)均购自美国Amresco公司;谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。
1.2 试剂配制
H2O2原液的配制方法:35%H2O2浓度约为10 mol/L。取l mL稀释到10 mL,配制成浓度为1 mol/L(1 000 mmol/L)的H2O2原液,按照试验要求配制成不同浓度的H2O2贮备液(0、100、200、400、600、800和1 000 mmol/L)。在试验开始前,用不同浓度的H2O2贮备液配制成含不同浓度H2O2的细胞培养液,保证各浓度培养液中加入的H2O2溶液体积相等,使得细胞培养液中除H2O2浓度不同外,其他成分都相同。
细胞培养液的配制:将20μL不同浓度的H2O2贮备液加入到 19.98 mL的 DMEM/F12基础培养液中,使反应体系培养液中H2O2作用浓度分 别 为 0、100、200、400、600、800 和1 000μmol/L。配制好的液体用0.22μm的过滤器过滤,每次换液时现配。
1.3 BMEC 的培养
奶牛乳腺组织取自于内蒙古呼和浩特市北亚清真冷库,采用胶原酶消化法获得BMEC。具体为将采集的健康的黑白花奶牛乳腺组织迅速带回实验室,减去外层组织,取里层组织块装入含3×双抗的磷酸盐缓冲液(PBS)的贮液瓶中,转入超净台中经含3×双抗的PBS清洗3遍、75%医用酒精(30 s)清洗1遍、含1×双抗的PBS清洗3遍后,用眼科剪剪去乳腺组织块的表面部分,于深层腺泡多的地方剪取1 mm3大小的小块装入5 mL的离心管中,充分剪碎后加入等体积的0.5%的胶原酶Ⅱ,置于37℃的培养箱中消化1 h,每隔20 min拿出轻轻摇晃离心管1次,使小组织块充分消化。消化液用80目的细胞滤网过滤,收集滤液于15 mL的离心管中,1 300 r/min离心5 min后,移去上清。然后用PBS重新悬浮细胞,1 300 r/min离心3 min后,再次吸弃上清,培养液重新悬浮细胞后接种于25 cm2的培养瓶中,置于培养箱(37℃、5%CO2)中培养。待原代细胞80%~90%贴壁长满培养瓶瓶底时,用0.05%胰蛋白酶/EDTA消化传代细胞。
将传至第3代贴壁生长的BMEC接种于96孔细胞培养板和60 mm培养皿中,加入含10%胎牛血清的DMEM/F12完全培养液(含1μg/mL氢化可的松、0.5%胰岛素转铁蛋白硒钠、10 ng/mL表皮生长因子、5μg/mL催乳素)直至80%~90%细胞贴壁后进行后续试验。
1.4 试验设计
本试验分2部分进行。试验一采用单因子完全随机试验设计,将第3代贴壁生长的BMEC随机分为42个组,每个组10个重复。细胞中分别添加 0、100、200、400、600、800 和 1 000 μmol/L H2O2,使之分别作用 2、4、6、8、12 和 24 h,测定细胞数量,计算存活率。其中,0μmol/L组为对照组。以细胞存活率为主要指标初步筛选H2O2作用时间和作用浓度。
试验二是采用试验一筛选得出适宜H2O2作用时间(6 h),采用单因子随机试验设计,将第3代贴壁生长的BMEC随机分为7组,每组6个重复,BMEC 中添加不同浓度的 H2O2(0、100、200、400、600、800 和 1 000 μmol/L),使 H2O2作用于细胞6 h后,收集细胞和培养液测定抗氧化指标,进一步筛选使细胞发生氧化损伤的适宜H2O2作用浓度。其中,0μmol/L组为对照组。
1.5 样品采集
细胞培养液样品采集:BMEC培养6 h后,从每组的每个重复中吸取细胞培养液,分别收集于1.5 mL Eppendof管中,12 000 r/min 离心 10 min,收集上清液用于CAT和SOD活性的测定。
用于酶活性测定的细胞样品采集:BMEC培养6 h后,弃上清,在每培养皿中加入1 mL PBS清洗贴壁生长的BMEC 2遍,弃去液体,加入动物细胞裂解液后放置于冰上冰浴30 min,用细胞刮板刮取贴壁细胞,收集细胞悬液到1.5 mL Eppendorf管中,4℃、12 000 r/min离心10 min,收集上清液用于细胞中GPx活性和MDA含量的测定。
1.6 测定指标及方法
1.6.1 存活率
存活率采用噻唑蓝(MTT)法测定,以吸光度值反映细胞的数量。将细胞悬液以1×104个/mL的密度接种于96孔培养板,按上述试验设计培养24 h后,各培养孔加入MTT(5 mg/mL)20μL;4 h后,弃上清液,甩板并拍干液体,每孔加入DMSO 100μL,用全自动酶标仪设置程序振荡10 min,而后检测各孔490 nm波长下的吸光度值(OD490nm)。根据下列公式计算存活率。
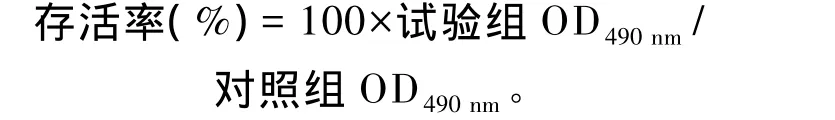
1.6.2 抗氧化指标
GPx活性采用二硫代二硝基苯甲酸法测定,CAT活性采用比色法测定;SOD活性采用黄嘌呤氧化酶法测定;MDA含量采用硫代巴比妥酸法测定,具体操作过程按照试剂盒说明书进行。
1.7 试验数据处理
所有数据经Excel进行整理和计算,试验数据采用SAS 9.0分析软件的方差分析(ANOVA)程序进行显著性检验和多重比较,P<0.05表示差异显著,0.05<P≤0.10 表示差异趋于显著,P>0.10表示差异不显著。
2 结果
2.1 H 2O 2作用浓度和作用时间对BMEC数量的影响
由表1可见,在所有作用时间下,H2O2作用浓度对BMEC数量均有显著的影响(P<0.05),并且随着H2O2作用浓度的增加,细胞的吸光度值均依次显著减小,即细胞数量显著降低(P<0.05)。与对照组相比,当H2O2作用浓度为100μmol/L时,作用时间在2~8 h均未对细胞数量造成显著影响(P>0.10);作用 12和 24 h,细胞数量显著减少(P<0.05),存活率分别为 93.62%和 92.48%。当H2O2作用浓度增加到200~400μmol/L时,除4和8 h作用时间外,其他各作用时间的细胞数量均显著低于对照组(P<0.05)。当H2O2作用浓度达到600μmol/L时,所有作用时间的细胞数量与对照组相比均显著减少(P<0.05),2、4、6、8、12 和24 h 细 胞 存 活 率 分 别 为 87.30%、91.94%、79.79%、76.34%、60.00%和 49.27%,而且当作用时间在6 h以上时,其细胞数量显著低于0~400 μmol/L组(P<0.05)。当 H2O2作用浓度增加到800、1 000μmol/L时,所有作用时间的细胞数量均急剧减少,显著低于其他各组(P<0.05),细胞的存活率分别从2 h的57.54%和56.35%降低到24 h的38.11%和20.15%,细胞死亡率高达40%~80%。
随着H2O2作用时间的延长,不同浓度H2O2组细胞数量呈不同的变化规律。H2O2作用4 h与作用2 h相比,所有浓度H2O2组细胞数量均呈升高趋势;作用6~8 h,与4 h相比,所有浓度 H2O2组细胞数量均呈降低趋势;然而,作用12~24 h,600~1 000μmol/L组的细胞数量随着H2O2作用时间的延长逐渐减弱,而100~400μmol/L组的细胞数量随着时间的延长反而升高。其中,细胞存活率在70%~80%范围内的H2O2作用浓度与作用时间分别是:800μmol/L H2O2作用细胞4 h、600μmol/L H2O2作用细胞6 h、600μmol/L H2O2作用细胞 8 h,细胞的存活率分别为 73.15%、79.79%和 76.34%。
“一带一路”国家倡议的提出,必然需要大批复合型英语专业人才,这是复合型英语专业的人才培养的机遇和挑战[3]。“一带一路”倡议视野下国际贸易法律复合人才法律英语教学是以培养国际化人才为目标的高端人才培养活动,因此,必须要以国际化的先进的教学理念为指引,针对“一带一路”建设现实需要,根据国际贸易实践对贸易、外语、法律人才的新需求,及时调整人才培养模式和教学大纲,以素质教育和能力本位教育理论为基础,构建了“一带一路”建设“外语+”、“贸易+”、“法律+”人才培养的多维互动模式[4],将国际化人才培养理念贯穿于法律英语教学的始终。
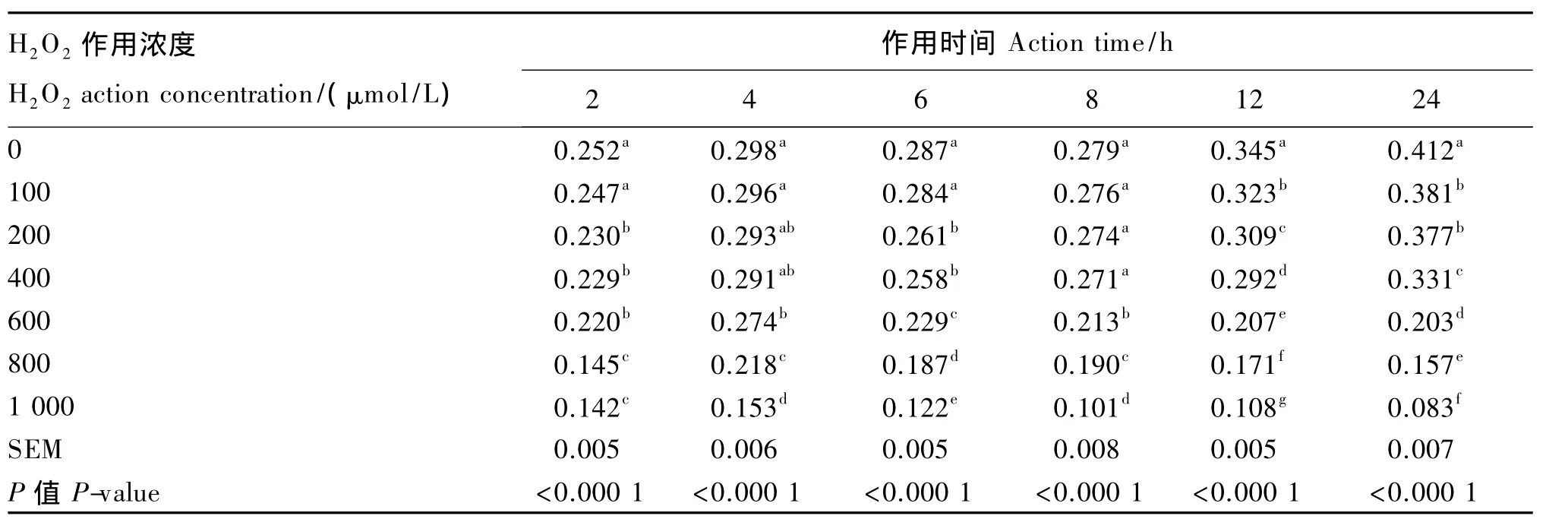
表1 H 2 O 2作用浓度和作用时间对BMEC数量的影响Table 1 Effects of concentration and action time of H2O2 on BMECs count OD490 nm
2.2 H 2 O 2作用浓度对BMEC抗氧化指标的影响
由表2可见,随着H2O2作用浓度升高,细胞GPx活性显著下降(P<0.05),其中,以 600~1 000μmol/L组较低,显著低于其他各组(P<0.05),但 600、800和 1 000 μmol/L 组之间无显著差异(P>0.10);对照组最高,显著高于其他各组(P<0.05);100、200和 400 μmol/L 组居中。
600~1 000μmol/L的H2O2作用浓度引起培养液CAT和SOD活性显著下降(P<0.05),显著低于其他各组,但600、800和1 000μmol/L组之间差异不显著(P>0.10);400μmol/L组的培养液CAT和SOD活性显著低于对照组和100μmol/L组(P<0.05),与200μmol/L 组之间无显著的差异(P>0.10)。从总趋势看,对照组的培养液CAT和SOD活性最高,100、200和400μmol/L组居中,600、800和1 000μmol/L组较低。
细胞MDA含量与上述GPx、CAT、SOD活性出现相反的变化规律。H2O2作用浓度为600~1 000μmol/L时,细胞MDA含量较高,显著高于对照组及100~400μmol/L组(P<0.05),但这 3组比较无显著的差异(P>0.10);作用浓度为400μmol/L时,细胞MDA含量显著高于对照组和100μmol/L组(P<0.05),但与 200 μmol/L 组之间无显著的差异(P>0.10)。由此得出,600、800和1 000μmol/L组的细胞MDA含量较高,其次为100、200和400μmol/L组,对照组最低。

表2 H 2O 2作用浓度对BMEC抗氧化指标的影响Table 2 Effects of action concentration of H 2 O2 on antioxdant paramaters of BMECs
3 讨论
H2O2是一种重要的ROS,极易穿过细胞膜,与细胞内Fe2+通过Fenton反应形成高活性的自由基(·OH),导致一系列反应,因H2O2容易获得,性质相对稳定,操作比较简单,所以它是目前应用最为广泛的氧化损伤模型的应激源,是研究各类细胞氧化损伤时使用的主要方法之一[1]。然而,以H2O2为刺激源诱导建立细胞氧化应激模型的方法在医学领域应用较多,如体外培养的心肌细胞及肝脏细胞,关于建立BMEC的氧化应激损伤模型的研究报道极少。而且,以H2O2为应激源构建细胞氧化损伤模型的报道中,判断氧化应激是否发生所选择的判别指标与判别标准不同。一些研究认为,MTT法具有特异性强、重复性好、快速、准确等优点,通过测定其吸光度值的大小即可反映出细胞数量的多少,也可反映出细胞增殖的快慢,进而可以作为建立氧化应激模型的判别指标[8-9],但目前选择的判别标准不完全相同。Huo等[10]报道在小鼠的心肌细胞中,选取细胞存活率为40%~50%作为H2O2氧化损伤模型的依据。Wei等[11]研究表明,以H2O2氧化诱导鼠嗜铬细胞瘤,以细胞死亡率为25%作为建立氧化损伤模型时选择H2O2适宜浓度的判别标准。孙婧陶等[12]指出,以细胞死亡率为50%~60%作为建立延边奶山羊BMEC氧化损伤模型的判别标准。周丽娜[13]的研究指出,细胞死亡率为20%~30%可以作为建立小鼠脊髓神经元细胞氧化应激模型的评判标准。由此可见,可能是由于细胞的种类不同,对氧化损伤的耐受能力不同,因此选择的细胞存活率判别标准不同,所报道的H2O2作用浓度与作用时间的差别也较大。通常,在建立氧化应激模型时,细胞的存活率都不宜过高或过低,若存活率过低,说明大量的细胞已经死亡,会造成细胞不可恢复的损伤,不利于抗氧化机制的研究;若存活率过高,说明细胞是处于相对长势比较好的状态,细胞的活力也较好,氧化后不会造成明显的损伤,也不利于后续试验的开展[14]。由此说明,建立细胞氧化损伤模型时需要使细胞达到适宜的损伤程度。
此外,氧化应激指标的变化是判断细胞是否发生了氧化应激、是否可建立细胞氧化应激模型的主要依据,是建立细胞氧化应激损伤模型的关键。除了细胞存活率外,GPx、SOD和CAT活性以及MDA含量可反映出机体清除自由基的能力以及脂质过氧化损伤的程度,因此,也可以作为判断细胞是否发生氧化应激的指标[15-16]。杨家军等[17]研究了断奶对仔猪肠上皮细胞的氧化损伤的影响,以SOD、CAT和GPx等酶的活性和MDA的含量作为反映机体氧化损伤的指标,结果表明,在21日龄时,与哺乳组仔猪相比,断奶组仔猪的肠上皮细胞中SOD、CAT和GPx等抗氧化酶的活性显著降低,过氧化产物MDA含量显著升高,其肠上皮细胞也发生了明显的损伤。李永义[18]研究了体外仔猪淋巴细胞氧化模型的建立,发现添加200~800μmol/L H2O2后,GPx、SOD 活性显著降低,MDA含量显著升高,400μmol/L H2O2可对体外仔猪的淋巴细胞产生明显的氧化应激。韩飞等[6]研究表明,100和1 000μmol/L H2O2能够显著降低HepG2中SOD、CAT活性,提高MDA含量,而100μmol/L H2O2的对于SOD、CAT活性及MDA含量无显著的影响,选择100μmol/L H2O2构建了氧化应激模型。然而,齐晓龙等[14]用 0.5~8.0 mmol/L的H2O2诱导产蛋鸡的原代肝细胞后,MDA含量随着H2O2作用浓度的增加而增加,SOD和CAT的活性呈现先增加后减少的趋势,最终选择4 mmol/L的H2O2作为构建应激模型的浓度。Wijeratne 等[19]研究表明,用 50、100、150、200和250μmol/L H2O2诱导人的病态的结肠细胞后发现,SOD活性在50μmol/L H2O2作用时达到最高,CAT活性在50~250μmol/L作用时保持不变,GPx活性随着H2O2作用浓度的增加而升高。由此可见,不同的细胞在发生氧化应激刺激后,对抗氧化酶活性的影响规律是相似的,但最终选择的H2O2作用浓度与作用时间不完全相同,这可能与细胞的种类、研究目的不同有很大的关系。
在此基础上,试验二又以抗氧化指标GPx、SOD、CAT活性和MDA含量为判别依据,以H2O2的作用时间为6 h,进一步研究了不同浓度的H2O2对细胞抗氧化酶活性的影响,以进一步确定建立细胞氧化损伤模型时适宜的H2O2作用浓度。结果显示,600~1 000μmol/L组与对照组相比均显著降低了GPx、SOD和CAT活性,提高了MDA含量,与400μmol/L组比较差异显著,但 600、800和1 000μmol/L组之间差异不显著。由此可见,600μmol/L H2O2即可对BMEC产生明显的氧化应激,可以作为建立氧化损伤模型时的作用浓度,作用浓度再继续增加,相关指标的组间无显著差异。H2O2引起细胞产生氧化损伤的原因是氧自由基和H2O2会启动脂质过氧化反应的发生,进而产生更多的自由基,随着氧化和抗氧化过程的不断进行,造成机体抗氧化能力的耗竭,导致氧化和抗氧化的严重不平衡[21],从而造成了机体的氧化损伤,细胞内产生的大量的自由基破坏了生物膜影响了酶的活性,加速蛋白质的分解,进而影响抗氧化酶的活力、导致抗氧化能力的降低[22]。还有研究指出,机体内抗氧化酶活力的降低是终产物H2O2的反馈作用或超氧阴离子(·O-2)使其灭活,这被认为是机体自身在环境因素下的保护效应[23]。因此,综合本试验的细胞存活率和抗氧化指标结果得出,以H2O2为应激源,其作用浓度为600μmol/L、作用时间为6 h可以引起BMEC的氧化损伤,可以作为建立BMEC氧化损伤模型的适宜条件。
4 结论
① 细胞存活率和抗氧化指标(GPx、SOD和CAT活性及MDA含量)可以作为判别BMEC是否发生氧化应激的指标。
② 600μmol/L H2O2作用BMEC 6 h,可以作为建立BMEC氧化损伤模型的适宜条件。
[1] 张斌,夏作理,赵晓民,等.氧化应激模型的建立及其评价[J].中国临床康复,2006,10(44):112-114.
[2] 吴永霞,董国忠,贾亚伟.氧化应激对奶牛的危害及其防治[J].中国饲料,2011(4):32-35.
[3] VALKO M,LEIBFRITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[4] 胡菡,王加启,李发弟,等.高温诱导体外培养奶牛乳腺上皮细胞的应激响应[J].农业生物技术学报,2011,19(2):287-293.
[5] 王振云.茶多酚对奶牛乳腺上皮细胞氧化应激损伤的保护作用[D].硕士学位论文.南京:南京农业大学,2011.
[6] 韩飞,周孟良.过氧化氢诱导HepG2细胞产生氧化应激细胞模型的建立[J].食品科学,2011,32(5):55-57.
[7] 彭亮,李知敏.紫萍提取物对过氧化氢诱导内皮细胞氧化损伤的保护作用研究[J].时珍国医国药,2009,20(4):996-998.
[8] LIU Y,PETERSON D A,KIMURA H,et al.Mechanism of cellular 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)reduction[J].Journal of Neurochemistry,1997,69(2):581-593.
[9] 文金隆.天麻酚性成分对H2O2诱导PC12细胞氧化损伤的保护作用研究[D].硕士学位论文.昆明:云南中医学院,2013.
[10] HUO R,SHIY,XU JJ,et al.Antioxidant effect of human selenium-containing single-chain Fv in rat cardiac myocytes[J].Chemical Research in Chinese Universities,2009,25(2):216-219.
[11] WEI Z L,BAI O,RICHARDSON J S,et al.Olanzapine protects PC12 cells from oxidative stress induced by hydrogen peroxide[J].Journal of Neuroscience Research,2003,73(3):364-368.
[12] 孙婧陶,李兆华,张宝修,等.过氧化氢诱导延边奶山羊乳腺上皮细胞氧化损伤模型的建立[J].江苏农业科学,2013,41(10):149-152.
[13] 周丽娜.野木瓜注射液及野木瓜提取物对H2O2氧化损伤神经元的保护作用[D].硕士学位论文.上海:上海师范大学,2011.
[14] 齐晓龙,赵芹,张亚男,等.过氧化氢诱导产蛋鸡原代肝细胞氧化应激模型的建立[J].中国畜牧杂志,2013,49(11):49-52.
[15] 郑延松,李源,张珊红,等.用低浓度过氧化氢建立心肌细胞氧化损伤模型[J].第四军医大学学报,2001,22(20):1849-1854.
[16] SINET P M,GARBER P.Inactivation of the human CuZn superoxide dismutase during exposure to O2癬and H2O2[J].Archives of Biochemistry and Biophysics,1981,212(2):411-416.
[17] 杨家军,张敏红,冯京海.早期断奶对仔猪肠上皮细胞氧化与损伤的影响[J].安徽农业大学学报,2013,40(1):77-82.
[18] 李永义.茶多酚对氧化应激仔猪的保护作用及机制研究[D].博士学位论文.雅安:四川农业大学,2011.
[19] WIJERATNE S SK,CUPPETT S L,SCHLEGEL V.Hydrogen peroxide induced oxidative stress damage and antioxidant enzyme response in Caco-2 human colon cells[J].Journal of Agricultural and Food Chemistry,2005,53(22):8768-8774.
[20] 齐晓龙.共轭亚油酸对产蛋鸡抗氧化机能的影响[D].博士学位论文.北京:中国农业科学院,2013.
[21] 方允中,杨胜,伍国耀.自由基稳衡性动态[J].生理科学进展,2004,35(3):199-204.
[22] 任泽林,霍启光,曾虹,等.氧化鱼油对鲤鱼生产性能和肌肉组织结构的影响[J].动物营养学报,2001,13(1):59-64.
[23] 徐静.猪氧化应激模型构建以及茶多酚的抗应激效应的研究[D].硕士学位论文.雅安:四川农业大学,2009.
