外源寡糖对山羊瘤胃液酶活及粗饲料瘤胃降解率的影响
2014-12-21林英庭王利华朱风华赵发盛
林英庭 祁 茹,2 王利华 朱风华 赵发盛,3 胡 静
(1.青岛农业大学动物科技学院,青岛 266109;2.内蒙古圣牧高科牧业有限公司,呼和浩特 010100;3.龙口市畜牧兽医工作站,龙口 265701)
寡糖又称低聚糖(oligosaccharides),是指由2~10个单糖分子通过糖苷键连接形成的直链或支链小聚合物的总称,是20世纪90年代中后期开发的新型无公害添加剂,由于具有无污染、无残留、功能奇特、与其他添加剂配伍性良好等独特优点,越来越受到人们的关注。我国已批准使用寡木糖(xylooligosaccharide,XOS)、低聚壳聚糖、半乳甘露寡糖(galacto-mannanoligosaccharides,GMOS)、果寡糖(fructooligosaccharide,FOS)、甘露寡糖(mannanoligosaccharide,MOS)5种产品作为饲料添加剂使用[1]。国内外以往有关寡糖的研究,多限于猪禽等单胃动物。但近年来研究发现,寡糖 对 反 刍 动 物 生 产 性 能[2-7]、瘤 胃 发 酵 功能[8-10]、瘤胃[11-12]及粪便微生物区系[13-14]、营养物质消化吸收及代谢[4-5,8]、免疫功能[5,8,12,15-16]、血液生化指标[4-5,8,17]等方面能产生作用。本试验探讨了不同外源寡糖对崂山奶山羊去势公羊瘤胃液主要酶活及常用粗饲料瘤胃降解率的影响,旨在探讨不同外源寡糖的作用效果,筛选适宜寡糖添加种类,为寡糖在山羊饲料中的合理应用提供依据。
1 材料与方法
1.1 试验材料
试验用 MOS(纯度为50%)、GMOS(纯度为80%)、XOS(纯度为70%),低聚异麦芽寡糖(iso-maltooligosaccharide,IMO,纯度为 90%)、FOS(纯度为90%)均为市售产品。
1.2 试验设计及试验动物
选用体况良好、装有永久性瘤胃瘘管的崂山奶山羊成年去势公羊[(62.80±2.45)kg]6 只。采用6×4不完全拉丁方试验设计。对照组(CT)饲喂基础饲粮,试验组在基础饲粮中分别添加1%寡糖(以有效含量计)。试验进行4期(4个重复),每期35 d,其中预试期25 d,正试期10 d。
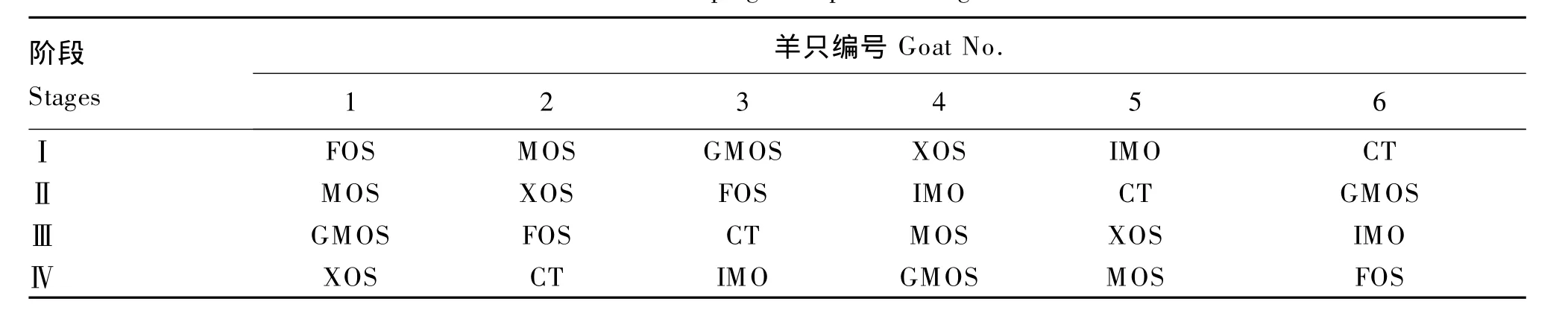
表1 试验羊分组Table 1 Grouping of experimental goats
1.3 基础饲粮
试验用基础饲粮参照《山羊饲养标准》(NY/T 816—2004)[18]配制,其组成及营养水平见表 2。
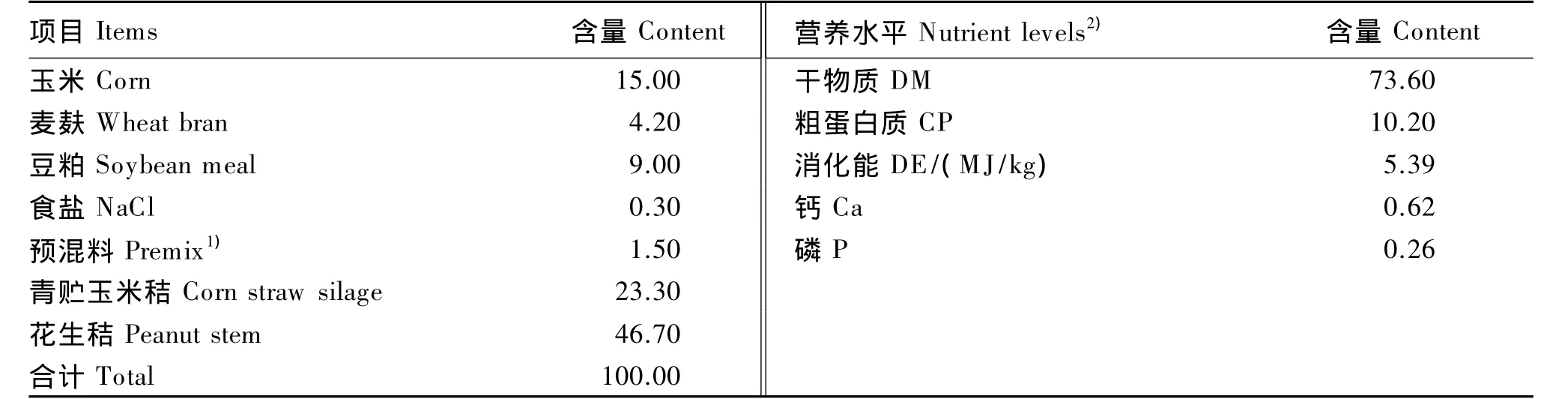
表2 基础饲粮组成及营养水平(风干基础)Table 2 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4 饲养管理
试验奶山羊单栏饲养,每日07:00和17:00分2次等量饲喂,精饲料425 g/d,粗料1 000 g/d(全株玉米青贮∶花生蔓为1∶2),先饲喂精饲料后饲喂粗饲料。自由饮水,各组间饲养管理完全一致。
1.5 测定项目与方法
1.5.1 瘤胃液主要酶活测定
瘤胃液的收集分别于正试期第1天的07:00和13:00、第 5天的 09:00和 15:00、第 9天的11:00和17:00进行,由瘤胃瘘管采集不同位点的瘤胃液,立刻用4层纱布过滤后置于-20℃冰箱保存备用。采用双位点夹心酶联免疫吸附法测定羧甲基纤维素酶(carboxymethyl cellulose)、滤纸纤维素酶(filter paper cellulase)、β-葡萄糖苷酶(β-glucosidase)、木聚糖酶(xylanase)、中性蛋白酶(neutral protease)和 α-淀粉酶(α-amylase)活性,试剂盒均购自上海申科技术有限公司,按说明书操作。
1.5.2 常用粗饲料瘤胃降解率测定
正试期第6天开始,用瘤胃尼龙袋法测定全株青贮玉米、花生蔓、苜蓿、羊草中干物质(DM)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)的瘤胃 72 h 降解率[19]。
将孔径40μm、内径5 cm×10 cm的尼龙袋洗净,置65℃烘干至恒重,放入干燥器中冷却备用。饲料原料粉碎通过2 mm标准筛,65℃烘箱中烘干至恒重。分别称取饲料样品4 g(精确至0.000 1 g)装入尼龙袋中,晨饲前通过半软塑料管放入瘤胃腹囊处,处理72 h后取出,用中等流速的自来水冲洗,然后放入水中浸泡55 min,再在中等流速的自来水下冲洗,冲洗过程中不能用手挤压袋内样品。另设2个空白对照(清水中浸泡72 h)校正试验误差。水洗后的尼龙袋置于65℃烘箱中烘至恒重。用常规分析方法[20]分析饲料和瘤胃处理72 h后的DM、NDF及ADF含量,按下式计算瘤胃降解率。
某目标成分72 h瘤胃降解率(%)=100×(a-b)/a。
式中:a为校正后饲料样本中目标成分含量(g);b为瘤胃处理72 h后的残余物中目标成分的含量(g)。
1.6 数据处理
数据处理及统计分析应用SPSS 17.0统计分析软件ANOVA过程进行单因素方差分析,用LSD法进行多重比较。试验数据均以平均值±标准差表示。
2 结果与分析
2.1 外源寡糖对瘤胃液主要酶活的影响
由表3、表4、表5、表6、表7和表8可以看出,与对照组相比,山羊饲粮中添加MOS后,可使瘤胃液中羧甲基纤维素酶活性平均值提高10.42%(P<0.05);添加 GMOS、IMO 和 FOS 后,瘤胃液中滤纸纤维素酶活性平均值分别提高 6.83%、6.675%和8.25%(P<0.05);添加 IMO 和 XOS,β-葡萄糖苷酶活性平均值可分别提高 11.23%和12.80%(P<0.05),而添加 GMOS 和 FOS,β-葡萄糖苷酶活性平均值可分别提高21.23%和13.55%(P<0.01);添加 MOS、GMOS、XOS 和 IMO,木聚糖酶活性平均值分别提高 7.23%、6.99%、6.75%和7.05%(P<0.05),FOS 可提高木聚糖酶活性平均值 12.51%(P<0.01);添加 XOS,中性蛋白酶活性平均值可提高和 8.93%(P<0.05),添加 MOS、GMOS、IMO和FOS中性蛋白酶活性平均值分别提高 9.59%、19.03%、14.33% 和 17.81%(P <0.01);添加 FOS,α-淀粉酶活性平均值提高7.77%(P<0.05)。
试验期内,瘤胃液中各种酶的活性随饲喂后时间的变化基本呈现规律性变化。羧甲基纤维素酶活性饲喂后基本呈现下降趋势,2~4 h降到最低,之后上升,约8~10 h升高至高峰,然后又呈下降趋势(表3);滤纸纤维素酶和木聚糖酶活性饲喂后迅速升高,2或4 h出现高峰,之后先下降后升高,饲喂后8 h再次出现高峰,然后下降(表4和表6);β-葡萄糖苷酶和中性蛋白酶活性随时间变化规律不一致(表5和表7);α-淀粉酶活性在饲喂后4 h出现高峰,小幅下降后又迅速升高,到饲喂后8 h升高至新的高峰,然后又迅速下降,10 h左右又下降至饲喂时的水平(表8)。

表3 不同外源寡糖对瘤胃液羧甲基纤维素酶活性的影响Table 3 Effects of different exogenous oligosaccharides on carboxymethyl cellulose activity of rumen fluid ng/mL

表4 不同外源寡糖对瘤胃液滤纸纤维素酶活性的影响Table 4 Effects of different exogenous oligosaccharides on filter paper cellulase activity of rumen fluid ng/mL
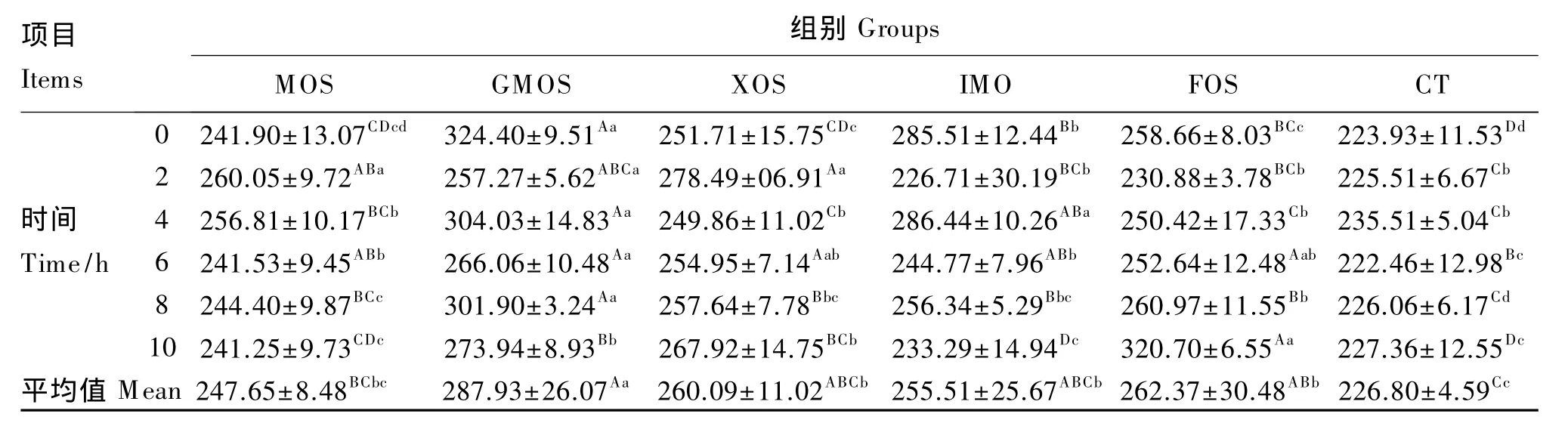
表5 不同外源寡糖对瘤胃液β-葡萄糖苷酶活性的影响Table 5 Effects of different exogenous oligosaccharides onβ-glucosidase activity of rumen fluid pg/mL

表6 不同外源寡糖对瘤胃液木聚糖活性的影响Table 6 Effects of different exogenous oligosaccharides on xylanase activity of rumen fluid ng/mL
2.2 外源寡糖对常用粗饲料瘤胃降解率的影响
由表9可以看出,与 CT组相比,饲粮添加GMOS、XOS、IMO后,全株玉米青贮的 DM 瘤胃降解率分别提高 14.74%(P<0.05)、24.31%(P<0.01)、16.29%(P<0.05);添加 GMOS 后,花生蔓的 DM 瘤胃降解率提高 15.25%(P<0.01);添加MOS、GMOS、IMO、FOS 后,羊草的 DM 瘤胃降解率分别提高 23.75%(P<0.01)、22.49%(P<0.01)、21.05%(P<0.01)和 20.50%(P <0.01);添 加MOS、IMO、FOS后,苜蓿干草的 DM 瘤胃降解率分别提高 9.24%(P<0.05)、13.51%(P<0.01)、14.61%(P<0.01)。
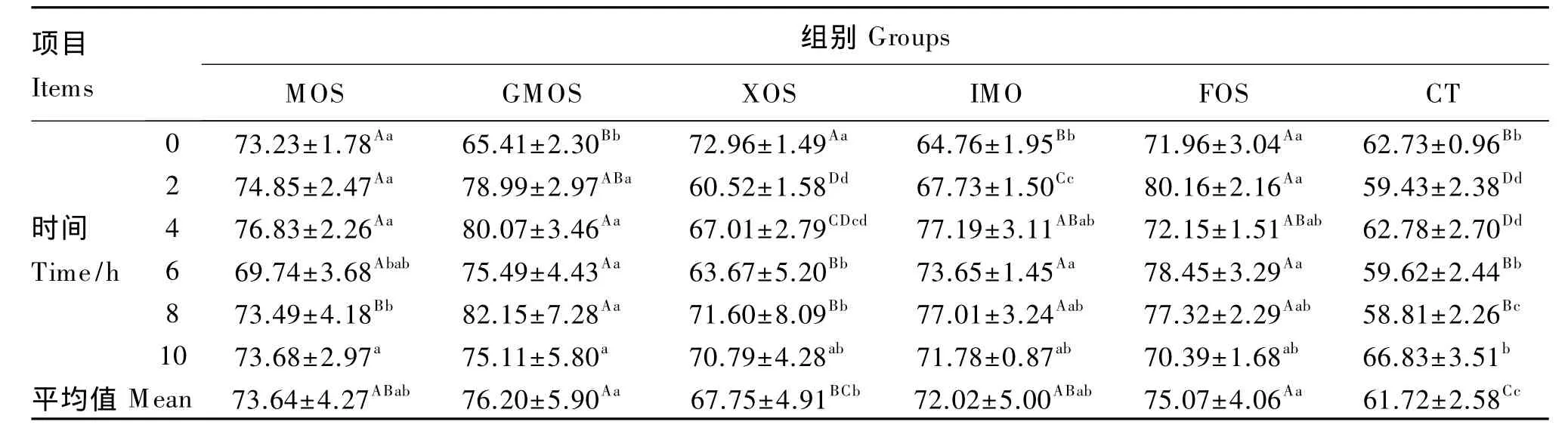
表7 不同外源寡糖对瘤胃液中性蛋白酶活性的影响Table 7 Effects of different exogenous oligosaccharides on rumen neutral protease activity of rumen fluid ng/L
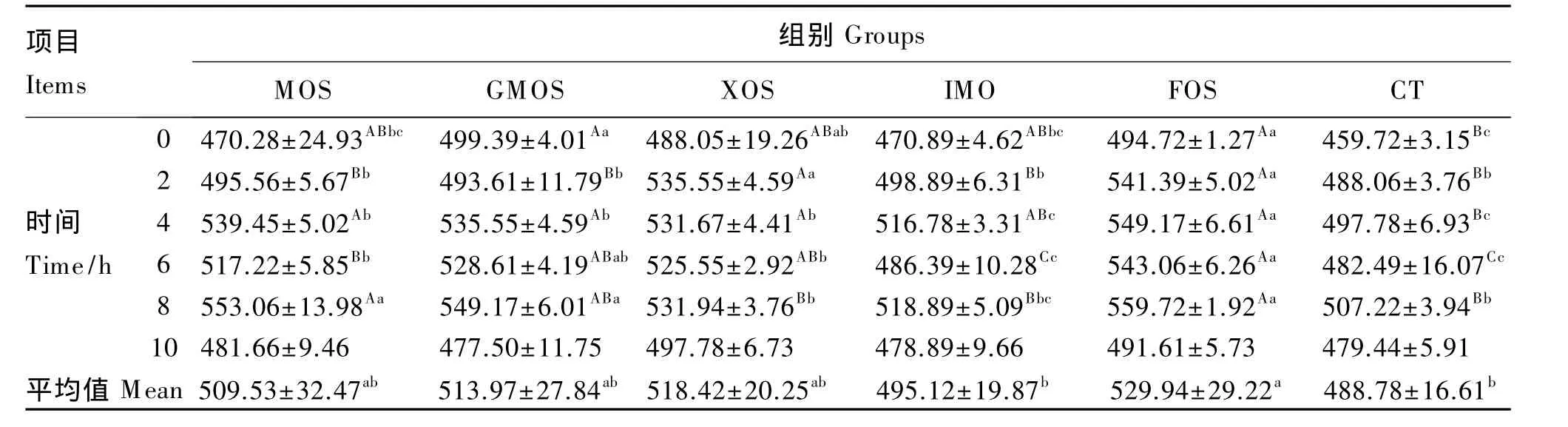
表8 不同外源寡糖对瘤胃液α-淀粉酶活性的影响Table 8 Effects of different exogenous oligosaccharides on rumenα-amylase activity of rumen fluid U/L
饲粮中添加 MOS、GMOS、XOS、IMO、FOS,全株玉米青贮NDF瘤胃降解率分别提高5.72%(P<0.05)、13.00%(P < 0.01)、12.80%(P < 0.05)、13.57%(P<0.01)、5.29%(P<0.05);添加 GMOS后,花生蔓 NDF瘤胃降解率提高 13.09%(P<0.05);添加 MOS、GMOS、XOS、FOS 后,羊草 NDF瘤胃降解率分别提高 45.64%(P<0.01)、26.02%(P<0.05)、9.30%(P<0.05)、29.44%(P<0.01);添加MOS、GMOS、FOS后,苜蓿青干草NDF瘤胃降解率分别提高 23.71%(P<0.01)、17.14%(P<0.01)、15.35%(P<0.01)。
饲粮中添加 MOS、GMOS、XOS、IMO、FOS,全株玉米青贮 ADF瘤胃降解率依次提高25.10%(P<0.01)、21.34%(P<0.01)、19.54%(P<0.01)、10.56%(P>0.05)、25.30%(P<0.01);添加 MOS、GMOS、XOS及 FOS,花生蔓 ADF瘤胃降解率分别提高 15.13%(P<0.01)、24.98%(P<0.01)、26.35%(P<0.01)、10.55%(P<0.05);添加 MOS和IMO,可使羊草ADF瘤胃降解率分别提高19.26%(P <0.05)和 24.54%(P < 0.01);添 加MOS、GMOS、XOS、IMO 和 FOS,分别使苜蓿 ADF瘤胃降解率提高 44.46%(P<0.01)、54.56%(P<0.01)、50.50%(P < 0.01)、62.20%(P < 0.01)、52.57(P<0.01)。
3 讨论
3.1 外源寡糖对瘤胃液主要酶活的影响
纤维素在瘤胃内的降解主要通过纤维素分解菌分泌的多酶复合体实现[21],多酶复合体是由各种纤维素酶通过非共价键形成有组织的复合物[22]。羧甲基纤维素酶的活性反映该酶降解水溶性纤维素衍生物的能力[23];滤纸纤维素酶反映内切、外切葡聚糖酶和葡萄糖苷酶协同作用的结果,代表纤维素酶解全程总效应[23-24],其活性代表瘤胃内总的纤维素酶活性;β-葡萄糖苷酶能够切开纤维二糖的β-1,4糖苷键,生成游离葡萄糖;木聚糖酶是一组能够水解木聚糖的酶类,因为木聚糖是最主要的植物半纤维素成分,因此该酶的活性大小也反映了瘤胃内植物组织中半纤维素的消失程度[24]。纤维类物质的降解必须在各种酶的协同作用下才能完成,任何酶活性的改变都会影响其降解。瘤胃内微生物所产生的酶,除与微生物菌群及数量有关外,其活性还会受到发酵底物的影响,这些发酵底物主要是由反刍动物饲粮中不同来源的碳水化合物和蛋白质所决定的[25]。本试验结果表明,添加外源寡糖可以提高山羊瘤胃液纤维素酶活性,但不同外源寡糖对其影响的程度不同,其中尤以MOS和FOS效果较好。分析其原因,可能主要与瘤胃微生物纤维素分解菌及真菌的数量有关。王新峰等[26]报道,饲粮中添加FOS能够使黄化瘤胃球菌和产琥珀酸丝状杆菌的数量提高。张学峰[12]研究表明,外源寡糖可以提高纤维素分解菌的数量,提前纤维素分解菌到达峰值的时间。祁茹等[11]发现,GMOS和FOS可以显著提高奶山羊瘤胃液纤维素分解菌数量,MOS和FOS可以显著提高奶山羊瘤胃液真菌数量。另外,反刍动物饲粮中添加外源寡糖可以显著增加瘤胃液中挥发性脂肪酸含量[9,27-28],挥发性脂肪酸为纤维素分解菌的增殖提供能量,增加其在瘤胃菌群的数量和比例。
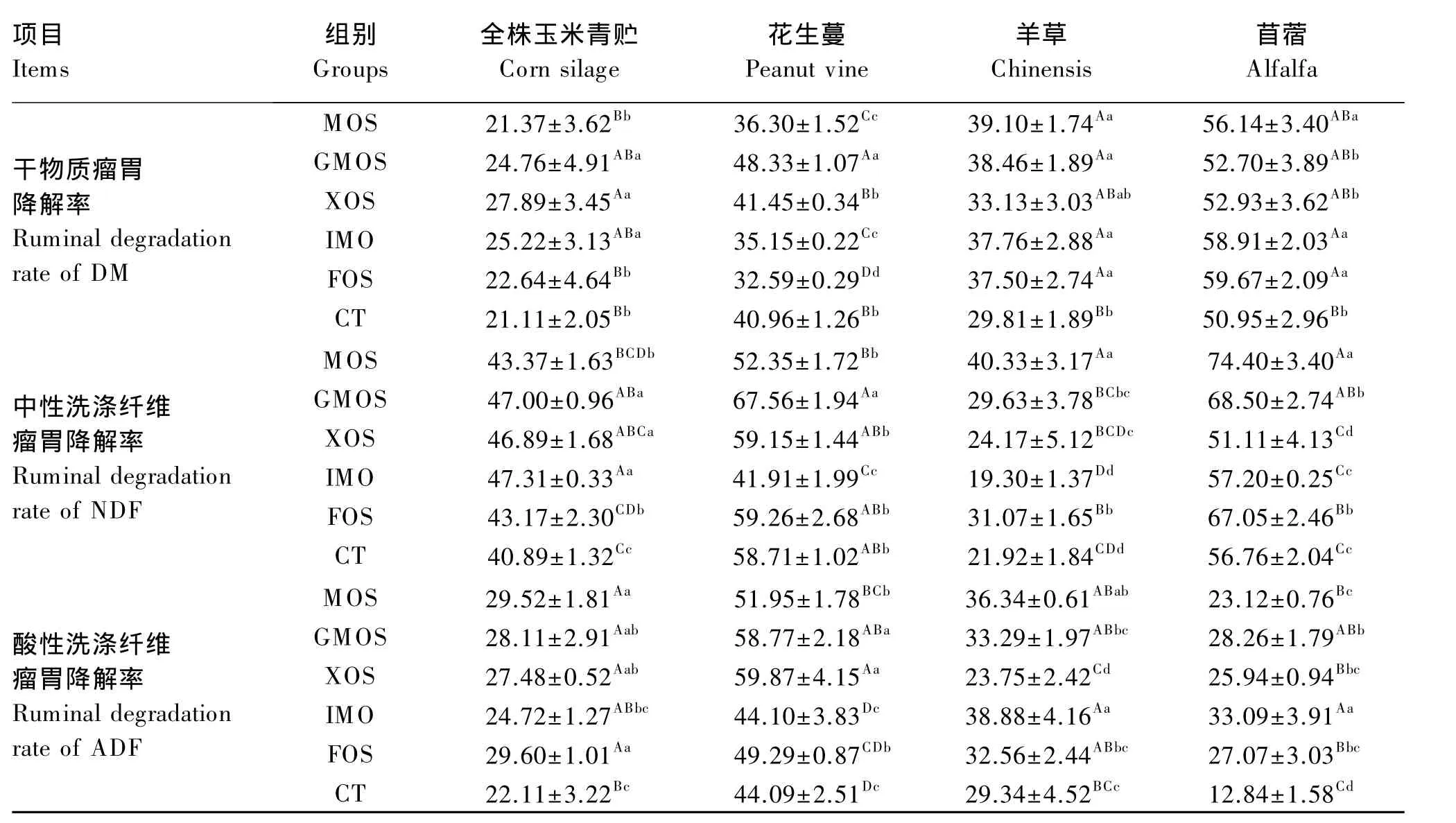
表9 外源寡糖对山羊常用粗饲料瘤胃降解率的影响Table 9 Effects of exogenous oligosaccharides on ruminal degradation rates of common roughages in goats %
瘤胃纤毛虫和许多细菌都具有蛋白质水解活性,瘤胃液中分离出来的细菌当中,30%~50%具有降解胞外蛋白质的活性,其中主要有嗜淀粉拟杆菌、反刍兽新月形单胞菌以及溶纤维丁酸弧菌等[29]。外源寡糖进入瘤胃后,可作为瘤胃纤毛虫和细菌的营养基质被利用而迅速增殖;此外,外源寡糖可改善瘤胃发酵功能,使瘤胃内环境更适宜于瘤胃纤毛虫和细菌生长,因此,不同外源寡糖均可显著提高中性蛋白酶的活性。
淀粉酶活性的高低直接决定饲料中可溶性碳水化合物的消失程度[30],瘤胃内最主要的淀粉利用菌有嗜淀粉瘤胃杆菌、牛链球菌、栖瘤胃普雷沃氏菌、反刍兽新月形单胞菌、溶淀粉琥珀酸单胞菌、溶纤维丁酸弧菌以及反刍兽真杆菌等。除此之外,瘤胃内几乎所有大型内毛虫以及瘤胃厌氧真菌都具有降解淀粉的能力。不同种淀粉降解菌它们所产生的a-淀粉酶的作用方式基本相同,它们均可将淀粉水解成麦芽糖,降解所得的麦芽糖为非淀粉降解菌提供碳源[29]。本试验中,添加FOS可明显提高瘤胃液α-淀粉酶活性,其原因可能是由于FOS促进了非结构性碳水化合物(NSC)分解细菌的快速生长,进而表现出较强的α-淀粉酶活性。
3.2 外源寡糖对常用粗饲料瘤胃降解率的影响
饲料DM瘤胃降解率是评定饲料营养价值的一个总体指标,它反映了饲料在瘤胃中的利用程度。赵晓静[5]报道,绵羊饲粮中添加牛蒡果寡糖可以提高DM 的表观消化率。刘兵等[30]报道,瘤胃灌注大豆寡糖(SBOS)降低了DM、OM、ADF、NDF在十二指肠、回肠、直肠的流通量,提高了它们在胃区、大肠中以及整个消化道的消化率。
NDF和ADF瘤胃降解率是反映结构性碳水化合物消化利用程度的重要指标,主要受结构性碳水化合物组成的影响[31]。木质素和半纤维素形成的酯键将纤维素包裹在其中,影响到反刍动物瘤胃微生物对纤维素和半纤维素的消化利用,而木质素又几乎完全不能被微生物利用[32],故其消化率主要取决于其中木质素的含量。瞿明仁等[9]用体外法研究发现,饲粮添加 0.6%、0.8%、1.0%FOS可以显著降低培养残渣中的NDF含量,添加IMO的各组,培养残渣中的NDF含量也比对照组降低。刘光斌等[28]报道,饲粮添加 0.8%和 2.0%的大豆寡糖可以显著降低培养残渣中NDF含量,提高NDF瘤胃降解率,且可降低瘤胃液pH、乙酸/丙酸,有利于瘤胃发酵的调控。
本试验结果表明,添加外源寡糖可以提高粗饲料DM、NDF和ADF的瘤胃降解率,其中MOS、GMOS和FOS效果显著,与前人研究结果基本相同,且粗饲料木质化程度越高,瘤胃降解率的改善作用越明显。一方面是可能由于外源寡糖可以明显改善瘤胃发酵功能,稳定和改善瘤胃内环境,为瘤胃微生物的生长提供良好的条件,另一方面是由于外源寡糖可明显促进瘤胃内纤维素分解菌、蛋白质分解菌及淀粉利用菌的增殖,增加相应酶的分泌,从而提高瘤胃液中有关酶的活性。
4 结论
①饲粮添加MOS可显著提高羧甲基纤维素酶活性,添加GMOS、IMO和FOS可显著提高滤纸纤维素酶活性;GMOS、IMO、XOS、FOS可显著提高 β-葡萄糖苷酶活性;添加 MOS、GMOS、XOS、FOS可显著提高木聚糖酶活性。
② 饲粮添加GMOS、IMO和FOS可显著提高中性蛋白酶活性。
③ 饲粮添加 FOS可显著提高 α-淀粉酶活性。
④ 饲粮添加 MOS、GMOS、IMO、XOS、FOS 可提高山羊常用粗饲料中DM、ADF及NDF的瘤胃降解率。
综上所述,在1%添加水平下,GMOS和FOS在山羊饲粮中添加效果较好。
[1] 中华人民共和国农业部.中华人民共和国农业部公告(第 1126 号)[EB/OL].http://www.moa.gov.cn/zwllm/zcfg/nybgz/200812/t20081225_1196468.htm,2008-12-25.
[2] 王定发,赵晓明,刘晓华,等.不同来源甘露寡糖饲喂犊牛试验[J].江西畜牧兽医杂志,2006(3):10-11.
[3] 王定发,黄代勇,晏邦富,等.甘露寡糖对犊牛的增重及血液免疫球蛋白的影响[J].上海畜牧兽医通讯,2005(6):18.
[4] 赵晓静.全营养保健代乳粉及甘露寡糖对犊牛代谢及生长发育影响的研究[D].硕士学位论文.保定:河北农业大学,2005.
[5] 赵晓静,李建国,李秋凤,等.不同营养水平代乳粉对犊牛生产性能和腹泻率的影响[J].动物营养学报,2007,19(2):124-128.
[6] 王定发,王春芳,刘晓华,等.甘露寡糖饲喂犊牛的重复试验[J].粮食与饲料工业,2004(9):34-35.
[7] 鲍延安,邢淑芳,徐庆龙.微生态效应添加剂甘露寡糖对中国荷斯坦牛产奶量及乳常规成分的影响[J].中国奶牛,2009(3):12-14.
[8] 郑琛.外源添加甘露寡糖对绵羊养分消化代谢、瘤胃发酵、消化道食糜流通量及免疫的影响[D].博士学位论文.兰州:甘肃农业大学,2012.
[9] 瞿明仁,凌宝明,卢德勋,等.灌注果寡糖对生长绵羊瘤胃发酵功能的影响[J].畜牧兽医学报,2006,37(8):779-784.
[10] 肖宇,王利华,程明,等.功能性寡糖对奶山羊瘤胃发酵功能的影响[J].动物营养学报,2011,23(12):2203-2209.
[11] 祁茹,温建新,程明,等.不同外源寡糖对崂山奶山羊瘤胃微生物区系的影响[J].动物营养学报,2012,24(2):349-357.
[12] 张学峰.外源寡糖在绵羊消化道内的降解、转化、利用和流通规律及其对瘤胃微生物区系、免疫和营养物质消化影响的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2007.
[13] 赵晓静,李建国,李秋凤,等.甘露寡糖对犊牛粪便菌群影响的研究[J].中国畜牧杂志,2007,43(5):31-34.
[14] 瞿明仁,刘兵,张学峰,等.消化道不同部位灌注大豆寡糖对绵羊几个免疫指标影响[J].动物营养学报,2007,19(6):678-683.
[15] 肖宇,程明,汪文鑫,等.外源寡糖对奶山羊免疫机能的影响[J].中国兽医学报,2012,32(10):1516-1520.
[16] 肖宇,王利华,孙国强,等.外源寡糖对奶山羊血清生化指标和抗氧化指标的影响[J].动物营养学报,2012,24(2):342-348.
[17] 中华人民共和国农业部.NY/T 816-2004肉羊饲养标准[S].北京:中国农业出版社,2004.
[18] 冯仰康.反刍动物营养学[M].北京:科学出版社,2004.
[19] 张丽英.饲料分析及饲料质量检测技术[M].3版.北京:中国农业大学出版社,2007.
[20] FONDEVILA M,DEHORITY B A.Interactions between Fibrobacter succinogenes,Prevotella ruminicola,and Ruminococcus flavefaciens in the digestion of cellulose from forages[J].Journal of Animal Science,1996,74(3):678-684.
[21] TEERI T T.Crystalline cellulose degradation:new insight into the function of cellobiohydrolases[J].Trends in Biotechnology,1997,15(5):160-167.
[22] 陈旭伟.不同皂苷对山羊瘤胃原虫和细菌种属变化以及纤维降解的影响[D].硕士学位论文.扬州:扬州大学,2009.
[23] 高爱武.分别驱除厌氧真菌和原虫对绵羊瘤胃微生物种群及纤维物质降解的影响[D].博士学位论文.呼和浩特:内蒙古农业大学,2008.
[24] 孙宏远.不同来源的蛋白质和非结构性碳水化合物对泌乳奶牛瘤胃微生物酶活性的影响[D].硕士学位论文.北京:中国农业科学院,2006.
[25] 王新峰,冷青文,李志远,等.低聚糖对断奶羔羊瘤胃菌群的影响[J].动物营养学报,2010,22(5):1396-1401.
[26] CAMPBELL J M,FAHEY G C,Jr,WOLF B W.Selected indigestible oligosaccharides affect large bowel mass,cecal and fecal short-chain fatty acids,pH and microflora in rats[J].The Journal of Nutrition,1997,127(1):130-136.
[27] 刘光斌,刘兵,张学峰,等.不同水平大豆寡糖(SBOS)对生长绵羊瘤胃发酵的影响[J].江西农业大学学报,2007,29(6):871-875.
[28] 张学峰,瞿明仁,王立阁,等.大豆寡糖对瘤胃发酵的影响及适宜添加量筛选[J].黑龙江畜牧兽医,2008(10):46-47.
[29] 刘春龙,李忠秋,张帆,等.大豆黄酮和染料木素对奶牛瘤胃液内主要养分相关酶活性的影响[J].中国畜牧杂志,2009,45(5):39-41.
[30] 刘兵,瞿明仁,张学峰,等.瘤胃灌注大豆寡糖对绵羊消化道内营养物质流通与消化的影响[J].畜牧兽医学报,2008,39(7):915-922.
[31] 杨凤.动物营养学(第2次修订版)[M].北京:中国农业出版社,2002.
[32] 凌宝明,瞿明仁,卢德勋,等.利用体外法研究功能性寡糖对生长绵羊瘤胃发酵功能的影响[J].江西农业大学学报,2007,29(1):98-104.
