颅脑损伤急性期血清中的炎性因子与神经功能损伤及预后关系
2014-12-20陈郁强张摇威
陈郁强,谢 扬,韩 溟,张摇威,黄 铿
随着经济、高速交通工具的发展,颅脑创伤的发病率也在逐年增加,各个部位创伤发生率显示,颅脑创伤仍然是仅次于四肢骨折的最常见的外伤类型[1],并且在发达国家创伤性颅脑损伤(traumatic brain injury,TBI)已经成为40岁以下人群最常见的死亡原因[2]。炎症反应是颅脑损伤后病理生理重要的组成部分,本实验通过监测创伤性颅脑损伤血清中肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白介素-1β(interleukin 1b,IL-1β)和超敏C反应蛋白(high-sensitivity C-reactive protein,hsCRP)的变化规律的水平变化,进一步探讨其变化规律及其与颅脑损伤程度和预后关系,现报告如下。
临床资料
1 一般资料
2012年12月~2013年9月我院神经外科收治的60例颅脑损伤患者,其中男性47例,女性13例;年龄15~82岁,平均40.9岁。均在伤后24h内入院。经头颅CT证实存在颅脑损伤,60例患者根据病史及糖化血红蛋白排除糖尿病,伤前无心、肺、肝、肾等重要器官疾病。按入院时格拉斯哥昏迷评分(GCS)分为3组,分别为轻型组(13~15分)30例,中型组(9~12分)13例,重型组(3~8分)17例;按伤后3个月格拉斯哥预后评分(GOS)分为2组,分别为预后良好组(GOS≥4分)46例,预后不良组(GOS≤3分)14例。选择同期17名正常健康人作为对照组,男性13例,女性4例;年龄20~75岁,平均38.6岁。均排除损伤、感染,无心、肺、肝、肾等重要器官疾病。经统计分析,观察组与对照组两组之间年龄分布、体重和性别构成比经统计学处理,均具有可比性。
2 标本收集及检测
60例颅脑损伤患者分别于伤后第1、3、7d清晨抽取外周血3ml,对照组17例抽取清晨外周血3ml,离心取上清后放置于-80°C冰箱保存;采用双抗体夹心ELISA法(试剂盒购于武汉博士德生物工程有限公司)测定颅脑损伤患者血清1、3、7d TNF-α、IL-β水平,采用免疫比浊法检测hsCRP水平(hsCRP正常水平为0~6mg/L)。
3 统计方法
使用SPSS 16.0统计软件进行统计学处理。数据均用均值±标准差(±s)表示,Kolmogoriv-Smimov检验用于评估样本分布状态。正态分布数据用t检验,非正态分布数据用Mann-Whitney U检验。P<0.05有统计学意义。
结 果
1 颅脑损伤患者第1、3、7d血清中TNF-α和IL-1β的水平变化
颅脑损伤患者伤后第1、3、7d血清中TNF-α和IL-1β的水平均显著高于健康对照组(P<0.05),而各个时间点的水平无显著差异(P>0.05),但可观察到TNF-α的水平于伤后第1d开始上升,第3d达峰值,第7d又缓慢下降的变化趋势(图1)。
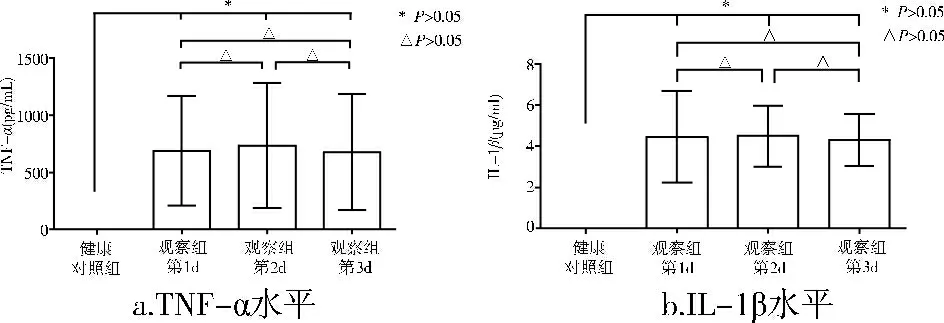
图1 各时间点血清中TNF-α(a)和IL-1β(b)的水平变化
2 TNF-α和IL-1β伤后第1、3、7d的水平变化与神经功能损伤程度的关系
颅脑损伤患者于伤后第1、3、7d 3个时间点重型组血清中TNF-α(a)和IL-1β(b)水平均明显高于轻型组(P<0.05),重型组与中型组、中型组与轻型组TNF-α和IL-1β比较均无显著差异(P>0.05)(图2)。

图2 各时间点TNF-α(a)和IL-1β(b)的水平变化与神经功能损伤程度的关系
3 TNF-α和IL-1β伤后第1、3、7d的水平变化与预后的关系
预后不良组在第1、3、7d血清中TNF-α均显著高于预后良好组(P<0.05);而血清中IL-1β在第1、3、7d各个时间点中,预后良好组与预后不良组均无显著差异(P>0.05)(图3)。
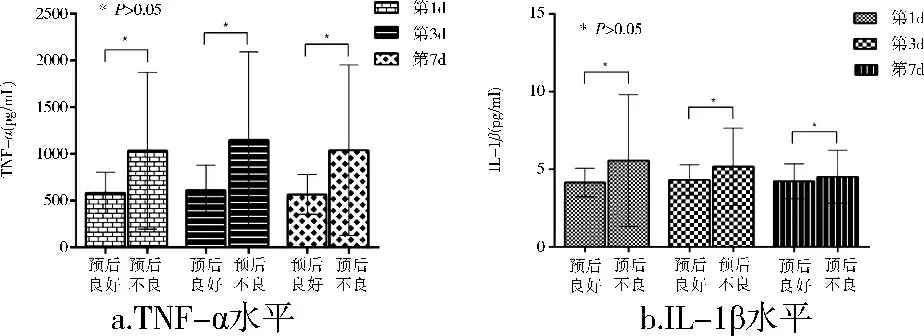
图3 各时间点TNF-α(a)和IL-1β(b)的水平变化与预后的关系
4 伤后24h内hsCRP水平变化与神经功能损伤及预后的关系
颅脑损伤患者于伤后24h内重型组、中型组患者血清中hsCRP显著高于轻型组(P<0.05),重型组与中型组伤后24h内血清中hsCRP水平并无统计学意义(P>0.05);预后不良组伤后24h内血清中hsCRP显著高于预后良好组(P<0.05)(图4)。

图4 伤后24h内神经功能损伤(a)与hsCRP水平变化(b)及预后的关系
讨 论
TNF-α、IL-1β与颅脑损伤的关系:颅脑损伤患者在伤后第1、3、7d血清中TNF-α和IL-1β水平与对照组相比显著升高,该结果与已往报道相同。伤后血清中第1、3、7d组间对比TNF-α和IL-1β水平并无明显差异,但从图1示TNF-α均数水平变化趋势与脑水肿高峰期吻合;而IL-1β变化趋势不明显。TNF-α、IL-1β在中枢神经系统主要是由小胶质细胞、星状细胞分泌的。有研究[3]发现,在细胞培养模型上,TNF-α与IL-1β通过相似的细胞内通道协同调节颅脑损伤后的炎性反应。我们发现颅脑损伤患者各个时间点的血清中TNF-α和IL-1β水平只有重型组与轻型组组间比较有统计学差异,但重型组TNF-α和IL-1β水平略高于中型组,而中型组略高于轻型组,表明血清中的TNF-α、IL-1β的水平与颅脑损伤程度有密切关系。颅脑损伤后体内TNFα、IL-1β水平迅速上升,参与了多种病理生理过程,刺激白细胞在损伤部位黏附、集聚浸润,与血脑屏障的通透性增加、破坏密切相关,使神经元赖以生存的内环境发生变化,导致神经元变性,是脑缺血性损伤和脑创伤后血管源性脑水肿形成的重要原因[2,4]。以上结果提示,颅脑创伤后TNF-α和IL-1β的水平高低与其损伤程度呈正相关,并介导了颅脑损伤后的炎症反应过程,与创伤后脑组织受到二次损害有着密切的联系。
TNF-α、IL-1β与颅脑损伤预后的关系:本研究结果显示,预后不良组第1、3、7d的血清中TNF-α水平均显著高于预后良好组(P<0.01),表明颅脑创伤患者血清中TNF-α的水平与其预后呈正相关,即颅脑损伤后血清中TNF-α的水平越高,患者的预后就越差。关于IL-1β与颅脑损伤预后的关系,Cederberg和Siesjö[5]研究发现颅脑损伤后血清中IL-1β水平与患者预后呈正相关,但Stein等[6]研究则未能提示两者相关。本研究提示预后不良组在各个时间点的血清中IL-1β水平与预后良好组并无明显差异(P>0.05),但预后不良组在各个时间点的IL-1β均值水平均略高于预后良好组。有研究[4]表明颅脑损伤后血清中IL-1β升高幅度小,较难准确测量,这可能会影响IL-1β真实值的测量,我们将在后续实验中加大样本量,以期更准确地反映IL-1β与颅脑损伤的关系及其变化趋势。
hsCRP与颅脑损伤程度及预后关系:颅脑创伤后,在炎性因子特别是IL-6、TNF-α的参与下,刺激肝脏分泌C反应蛋白(CRP)进入血液中,数小时血清中CRP水平便迅速升高,然后通过循环系统,穿过受损的血脑屏障进入颅内[7]。CRP被认为具有促使炎症消退和促进组织修复的功能,修复受损的脑组织及血脑屏障,颅脑损伤越严重则CRP水平越高,故CRP水平在一定意义上反映了颅脑损伤的程度。本研究发现颅脑损伤重型组、中型组伤后24h内血清中hsCRP显著高于轻型组,重型组与中型组伤后24h内血清中hsCRP并无统计学意义,说明血清中hsCRP与颅脑损伤的程度密切相关;我们还发现预后不良组伤后24h内血清中hsCRP显著高于预后良好组,可见颅脑损伤后血清中hsCRP水平可以作为预测预后的指标之一。CRP的半衰期为19h,当体内的炎症得到控制时,少了炎症因子的刺激,体内的CRP水平也会迅速回落[8]。
由图1可见,TNF-α在颅脑受损后的均值水平>600pg/ml,较正常值均值(约48pg/ml)升高十几倍;而IL-1β在颅脑受损后的均值则在5pg/ml以内,与正常值相比虽有统计学差异,但是相差不大。我们研究的数据显示IL-1β在颅脑损伤后峰值升高幅度较小,这与Singhal等[9]的研究相符,另外部分患者血清中IL-1β峰值低于正常水平均值,而TNFα的峰值则显著高于其正常水平均值,可见颅脑损伤TNF-α较IL-1β在血清中的水平含量升高程度更加明显。因此,在判断颅脑损伤患者的神经功能损伤程度及预后时,检测血清中TNF-α水平的灵敏度优于IL-1β,TNF-α可以更加真实准确地反映颅脑损伤程度,更好地预测患者的预后水平。同时,相对于IL-1β、hsCRP这些炎症因子,TNF-α还能在一定程度上反映脑水肿的情况,所以监测颅脑损伤患者血清中TNF-α水平,特别是对于缺少颅内压监测、不宜搬动去行头颅CT平扫的患者来说,能够帮助临床上更好、更及时地判断患者的病情变化,给予准确的治疗方案。基于我们的研究发现,我们认为TNFα与颅脑创伤后的关系更加密切,在以后的临床应用中,更具临床价值。
综上所述,监测颅脑创伤患者血清中TNF-α、IL-1β和hsCRP的水平,特别是对TNF-α的水平监测,对于反映颅脑损伤的严重程度、临床诊断、判断颅脑创伤患者的预后水平等有着十分重要的意义。另外He[10]、汪君[11]等分别使用孕酮、促红细胞生成素治疗模拟脑部创伤的大鼠,发现能够降低大鼠血清中TNF-α、IL-1β的水平,且能提高大鼠的认知功能恢复,可见监测TNF-α、IL-β的水平变化可用于指导临床颅脑损伤药物的使用,抑制颅脑损伤后TNF-α、IL-1β参与的炎症反应,可能有利于预后的恢复,为临床治疗颅脑损伤带来新途径。
[1]只达石,张国斌,闫华.颅脑创伤基础与临床研究十年回顾[J].中国现代神经疾病杂志,2010,10(1):83-91.
[2]Helmy A,De Simoni MG,Guilfoyle MR,et al.Cytokines and innate inflammation in the pathogenesis of human traumatic brain injury[J].Prog Neurobiol,2011,95(3):352-372.
[3]Ziebell JM,Morganti-Kossmann MC.Involvement of proand anti-inflammatory cytokines and chemokines in the pathophysiology of traumatic brain injury[J].Neurotherapeutics,2010,7(1):22-30.
[4]Woodcock T,Morganti-Kossmann MC.The role of markers of inflammation in traumatic brain injury[J].Front Neurol,2013,4(18):1-18.
[5]Cederberg D,SiesjöP.What has inflammation to do with traumatic brain injury[J].Childs Nerv Syst,2010,26(2):221-226.
[6]Stein DM,Lindell A,Murdock KR,et al.Relationship of serum and cerebrospinal fluid biomarkers with intracranial hypertension and cerebral hypoperfusion after severe traumatic brain injury[J].J Trauma,2011,70(5):1096-1103.
[7]Is M,Coskun A,Sanus GZ,et al.High-sensitivity C-reactive protein levels in cerebrospinal fluid and serum in severe head injury:relationship to tumor necrosis factor-alpha and interleukin-6[J].J Clin Neurosci,2007,14(12):1163-1171.
[8]农朝赞,周志宇,黄之虎,等.脑脊液C反应蛋白水平变化与颅脑损伤患者预后相关分析[J].创伤外科杂志,2013,15(5):450.
[9]Singhal A,Baker AJ,Hare GM,et al.Association between cerebrospinal fluid interleukin-6 concentrations and outcome after severe human traumatic brain injury[J].JNeurotrauma,2002,19(8):929-937.
[10]He J,Evans CO,Hoffman SW,et al.Progesterone and allopregnanolone reduce inflammatory cytokines after traumatic brain injury[J].Exp Neurol,2004,189(2):404-412.
[11]汪君,杨青.促红细胞生成素对大鼠脑损伤后神经保护作用的实验研究[J].中国临床神经外科杂志,2010,15(8):477-480.
