饲料中添加甘露寡糖对团头鲂幼鱼生长性能、抗氧化能力和肠道菌群的影响
2014-12-20孙盛明戈贤平江晓浚
孙盛明 谢 骏 朱 健 戈贤平 江晓浚
(1.中国水产科学研究院珠江水产研究所,农业部热带亚热带水产资源利用与养殖重点实验室,广州 510380;2.中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,无锡 214081;3.南京农业大学无锡渔业学院,无锡 214081)
随着集约化养殖模式的扩大和推广,水产养殖业得到了迅猛的发展。然而,因高密度养殖、投饲频率增加以及水体污染等问题,导致水生动物的病害和重大疫病频发。据不完全统计,我国水产养殖病害平均年损失达百亿元,其中鱼类占55%~77%,虾蟹类占 11% ~28%[1],通过营养学手段从根本上增强水生动物自身免疫力成为健康养殖领域亟需解决的关键问题。新型绿色水产饲料添加剂寡糖又称低聚糖或寡聚糖,是由2~10个单糖通过糖苷键连接而成的聚合体,由于单糖分子大小和结构不一,单糖之间的结合方式不同,构成性质、结构及功能不尽相同的众多种类的寡糖类物质,包括甘露寡糖(mannan oligosaccharide,MOS)、果寡糖(frueto oligosaeeharides,FOS)、半乳甘露寡糖(galactomannan oligosaccharides,GMOS)等。近年来,甘露寡糖在畜禽养殖中被认为具有提高生产性能、优化肠道微生物区系及增强机体免疫力的作用[2-3],然而,甘露寡糖对水生动物是否具有相似作用效果尚无定论。
团头鲂(Megalobrama amblycephala),隶属于硬骨鱼纲,鲤形目(Cypriniformes),鲤科(Cyprinidae),鳊 亚 科(Abramidinae),鲂 属 (Megalobrama),其肉质鲜美、生长快、经济价值高,截至2011年,团头鲂在我国的总产量远超过60万t,是我国重要的大宗淡水养殖鱼类之一[4-5]。迄今,在鱼类饲料中添加甘露寡糖的研究较少,仅见杂食性鱼类异育银鲫[6]、鲤[7]和肉食性鱼类虹鳟[8]、金头鲷[9]等少数品种,甘露寡糖在草食性鱼类团头鲂养殖中的应用还未见报道。本试验选用团头鲂幼鱼为研究对象,在研究甘露寡糖对团头鲂幼鱼生长性能、抗氧化能力影响的基础上,采用变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)技术探讨甘露寡糖对团头鲂幼鱼肠道菌群结构的影响,旨在为甘露寡糖在团头鲂健康养殖中合理利用提供理论参考。
1 材料与方法
1.1 试验设计
1.2 试验动物与饲养管理
团头鲂幼鱼购自中国水产科学研究院淡水渔业研究中心南泉养殖基地。选择活泼健康、规格一致、平均体重为(1.05±0.01)g 的团头鲂幼鱼360尾,随机分成4组,每组3个重复,每个重复30尾。试验鱼以重复为单位放入流水循环圆形蓄养槽(体积约为300 L)内,各组试验所用蓄养槽在空间位置上随机排布,以减小各组间因光线等因素造成的误差。试验开始前用基础饲料驯养2周后,按照日投喂量为试验鱼体重的3%~5%投喂5种试验饲料,每天投喂 3次(08:00、11:30和17:00),根据摄食情况适当调整投喂量。整个试验期间水质如下:水温为27~29℃,溶氧浓度≥5 mg/L,氨氮浓度≤0.05 mg/L,pH 为 6.8~ 7.2。试验期为8周。养殖试验结束后,禁食24 h后量取鱼体长、称鱼体重,以计算生长性能指标。每个重复取3尾,每个组的9尾团头鲂幼鱼分别取肠道组织,在生理盐水中洗涤,除去其上所带有的血液、粪便等杂质,用液氮速冻后于-80℃保存用于肠道菌群结构分析;取鱼体的肝脏组织-80℃放置,用于抗氧化指标测定。

表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.3 生长性能的测定
增重率(weight gain rate,WGR)、饲料系数(feed conversion ratio,FCR)、成活率(survival rate,SR)用以下公式求得:

1.4 肝脏抗氧化指标的测定
肝脏样品解冻后用预冷的生理盐水冲洗干净并用滤纸吸干后称重。肝脏与预冷的生理盐水按1∶9(质量体积比)的比例冰浴匀浆,然后在4℃下10 000 r/min离心20 min,取上清液用于抗氧化指标分析。肝脏上清液蛋白质含量采用考马斯亮蓝法测定,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性以及丙二醛(malondialdehyde,MDA)含量分别采用黄嘌呤氧化酶法、吸光光度法和硫代巴比妥酸法测定,所用试剂盒购自于南京建成生物工程研究所。
1.5 DGGE技术分析肠道菌群结构
1.5.1 DNA提取方法和高可变区 16S rDNA-V3片段的PCR扩增
按照蛋白酶K-氯仿-异戊醇法从肠道内容物提取DNA。本试验采取将DNA提取物稀释100倍的纯化方法。按文献[10]提供的扩增方法,采用带GC夹(GC-clamp)细菌通用引物341F(5'-CCTACGGGAGGCAGCAG-3')和 534R(5'-ATTACCGCGGCTGCTGG-3')进行细菌基因组DNA的扩增,GC-clamp序列为 CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACG GGGGGGGG,扩增片段为细菌的16S rDNA-V3片段。PCR扩增采用 50μL体系,包括 10×LAPCR Buffer(Mg2+Plus)5 μL,10 mmol/L dNTP 4μL,10 μmol/L 上、下游引物各 1 μL,5 U/μL LATaq DNA 聚合酶0.5 μL,50 ng/μL 模板 DNA 2.0 μL,灭菌去离子水 37.5 μL。整个过程采用降落PCR(touchdown-PCR)模式,程序如下:94℃预变性5 min;94℃变性30 s,65℃退火30 s,72℃延伸90 s,之后每个循环退火温度降低0.5℃,循环20次,在这个退火温度下再进行15个循环;72℃最终延伸5 min。扩增产物用1%琼脂糖凝胶电泳检测。从琼脂糖凝胶中回收纯化PCR产物,采用大连宝生物工程公司的胶回收纯化试剂盒(TaKaRa Agarose Gel DNA Purification Kit)进行,过程参照试剂盒中的使用说明进行操作。
1.5.2 PCR 扩增产物的 DGGE
将PCR扩增产物通过DGGE进行分离,采用的凝胶变性梯度为35%~55%,浓度为8%的聚丙烯酰胺凝胶(化学变性剂为100%尿素7 mol/L和40%的丙烯酰胺),在 1×TAE缓冲液中 150V 60℃下电泳5 h,电泳完毕后采用银染的方法进行染色,银染结束后利用凝胶成像仪观察并记录结果。
2.3 两组患儿心律失常情况 对照组患儿心律失常发生率为62.5%(25/40),观察组为29.3%(12/41),观察组明显低于对照组(χ2=7.684,P<0.05),见表2。
1.5.3 DGGE图谱中优势条带的克隆及测序
PCR回收纯化产物与pMD18-Tvector(TaKa-Ra)在16℃下连接过夜,转化大肠杆菌感受态细胞DH5α,蓝白斑筛选挑选阳性克隆子,电泳检测确认阳性克隆。最后将所得克隆片段送至上海生工生物工程有限公司进行测序。
1.6 数据分析
试验数据采用SPSS 16.0统计软件包中的单因素方差分析(one-way ANOVA)进行处理,若差异显著,再进行Tukey’s多重比较,显著水平为P<0.05,所有结果均以平均值±标准误(mean±SE)表示。
用Quantity One 4.6软件分析样品电泳条带的数目和亮度,以此来评估肠道菌群的生物多样性,生物多样性采用Shannon-Wiener指数表示,该指数可以表示种群之间遗传多样性的分布和差异。其公式为:

式中:H'代表Shannon-Wiener指数;ni代表某泳道中单个条带的平均密度;N代表该泳道下所有条带的密度和,用来评估各样品的多样性。
2 结果与分析
2.1 饲料中添加甘露寡糖对团头鲂幼鱼生长性能的影响
由表2可知,在养殖8周结束后,团头鲂幼鱼摄食添加了甘露寡糖的饲料后增重率、饲料系数和成活率均没有产生显著变化(P>0.05),其中100和200 mg/kg甘露寡糖组的增重率略高于对照组,比对照组分别提高了5.03%和3.32%,饲料系数略低于对照组,比对照组分别降低了1.5%和1.0%。
2.2 饲料中添加甘露寡糖对团头鲂幼鱼肝脏抗氧化指标的影响
由表3可知,在养殖8周结束后,与对照组相比,饲料中添加甘露寡糖的各试验组团头鲂幼鱼的肝脏超氧化物歧化酶和过氧化氢酶活性均显著升高(P<0.05),但添加 100、200 和 400 mg/kg 甘露寡糖的试验组间并没有显著差异(P>0.05)。与对照组相比,饲料中添加甘露寡糖的各试验组团头鲂幼鱼的肝脏丙二醛含量显著降低(P<0.05), 而各试验组间则没有显著差异(P>0.05)。
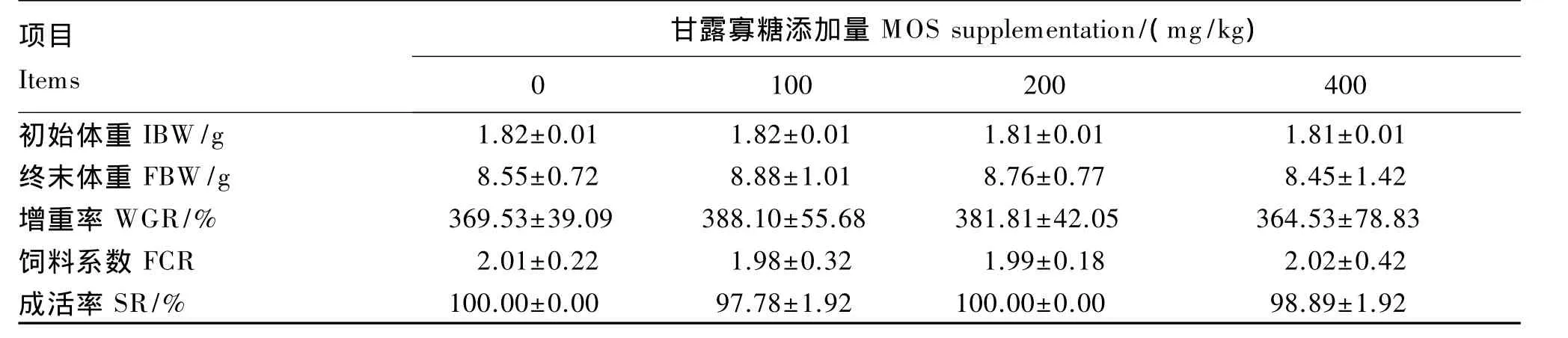
表2 饲料中添加甘露寡糖对团头鲂幼鱼生长性能的影响Table 2 Effect of dietary MOS on growth performance of juvenile blunt anout bream

表3 饲料中添加甘露寡糖对团头鲂鱼幼鱼肝脏抗氧化指标的影响Table 3 Effect of dietary MOS on liver antioxidant parameters of juvenile blunt anout bream
2.3 肠道细菌16S r DNA-V3片段的 PCR扩增结果

图1 肠道细菌16S r DNA-V3片段的PCR扩增结果Fig.1 PCR amplification results of intestinal bacterial 16S rDNA-V3 fragment
将提取的细菌总基因组DNA为模版,进行1 6 SrDNA-V 3片段的PCR扩增,从图1可知,1.5%琼脂糖凝胶电泳检测获得200 bp左右的特异性扩增片段,每个样品都有清晰、较亮的扩增条带,可达到后续DGGE电泳分析要求。
2.4 16S r DNA-DGGE指纹图谱的建立、聚类分析及相似系数分析
各组团头鲂幼鱼肠道细菌16S rDNA-V3片段的DGGE指纹图谱分析结果如图2所示。比较DGGE各条带相对光密度发现,部分条带光密度变化明显受到饲料中甘露寡糖含量的影响。有的条带在各组的肠道样品中均出现,如条带21和22;有的条带只在对照组中出现,如条带2、3和10,有的条带只在试验组中出现,如条带5。由图3可知,团头鲂幼鱼饲料中添加甘露寡糖会明显改变团头鲂幼鱼肠道的微生态环境,说明团头鲂幼鱼肠道菌群易受甘露寡糖的影响,聚类分析结果表明12个样品在0.6的相似度上可分为2类,其中400 mg/kg甘露寡糖组为一类,100和200 mg/kg甘露寡糖组及对照组为一类。
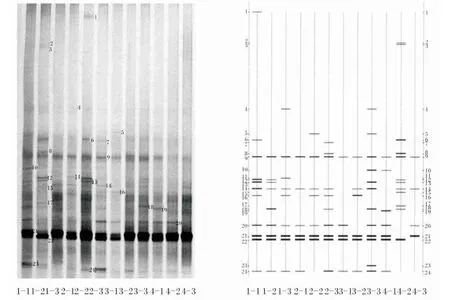
图2 团头鲂幼鱼肠道菌群DGGE指纹图谱及分析示意图Fig.2 Fingerprint and analysis schematic diagram of intestinal microflora of juvenile blunt anout bream by DGGE
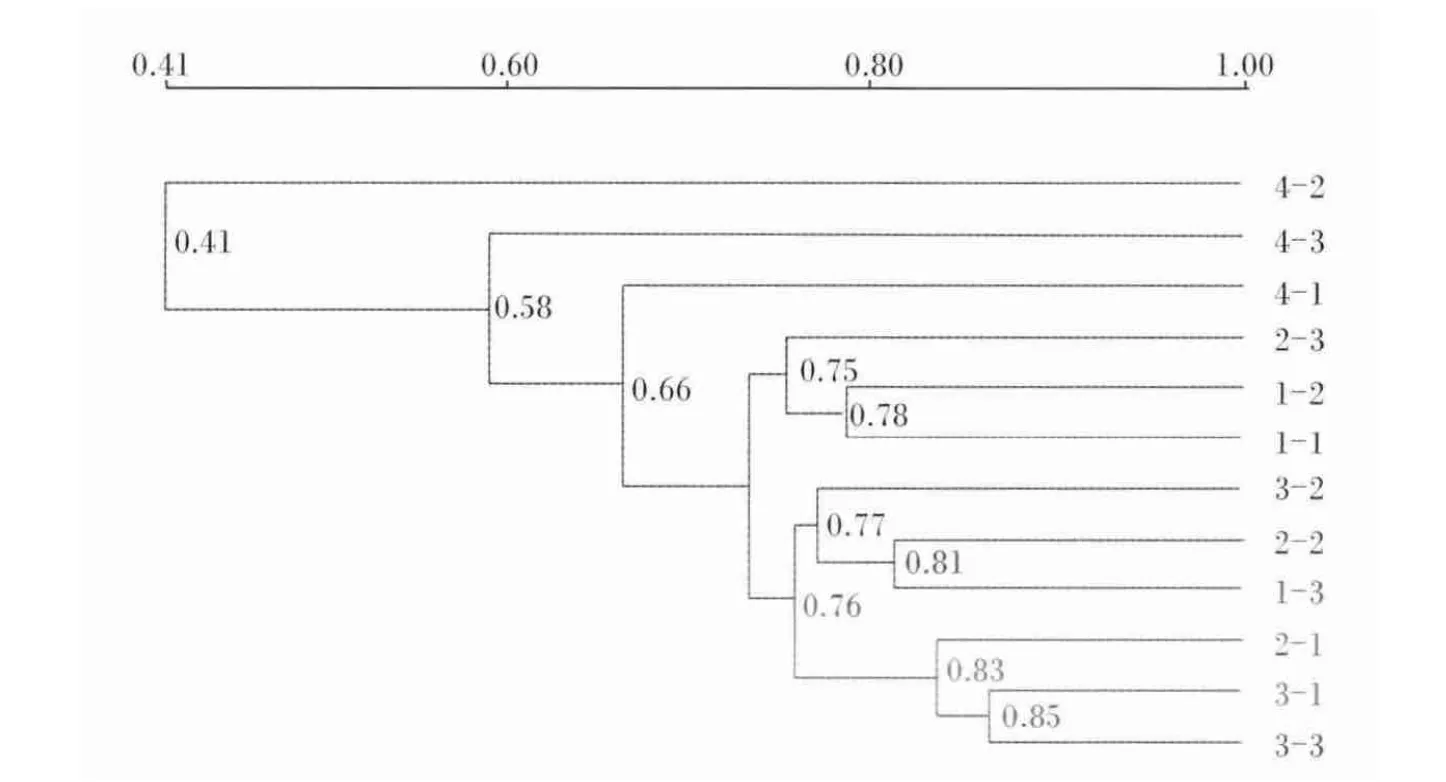
图3 团头鲂幼鱼肠道菌群的UPMGA聚类分析示意图Fig.3 UPMGA cluster analysis schematic diagram of intestine microflora of juvenile blunt anout bream
2.5 肠道菌群的Shannon-Wiener指数分析
由表4可知,投喂含200和400 mg/kg甘露寡糖饲料的团头鲂幼鱼肠道菌群Shannon-Wiener指数显著降低(P<0.05),对照组肠道菌群的 Shannon-Wiener指数为 2.33,100、200 和 400 mg/kg 甘露寡糖组分别为 2.21、1.63 和 1.65,随着甘露寡糖添加量的增加,团头鲂幼鱼肠道菌群Shannon-Wiener指数逐渐减小,且200和400 mg/kg甘露寡糖组较对照组显著降低(P<0.05)。

表4 饲料中添加甘露寡糖对团头鲂鱼幼鱼肠道菌群Shannon-Wiener指数的影响Table 4 Effect of dietary MOS on Shannon-Wiener index of intestinal microflora of juvenile blunt anout bream
2.6 DGGE条带的16Sr DNA序列分析
团头鲂幼鱼肠道细菌16S rDNA-V3特征片段经DGGE分离,切割特征性条带1~24,序列大小在160~200 bp范围之内。将所得序列输入Gen-Bank,以Blast进行相似性分析。由表5可知,24条所测序列的最相似序列基本来自GenBank数据库中未培养的细菌克隆,所测序列与GenBank数据库中的16S rDNA序列相似度均在95%~100%之间。100、200和400 mg/kg甘露寡糖组团头鲂幼鱼肠道优势菌为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、硬壁菌门(Firmicutes),而对照组团头鲂肠道中含有弧菌门(Vibriogazogenes)。
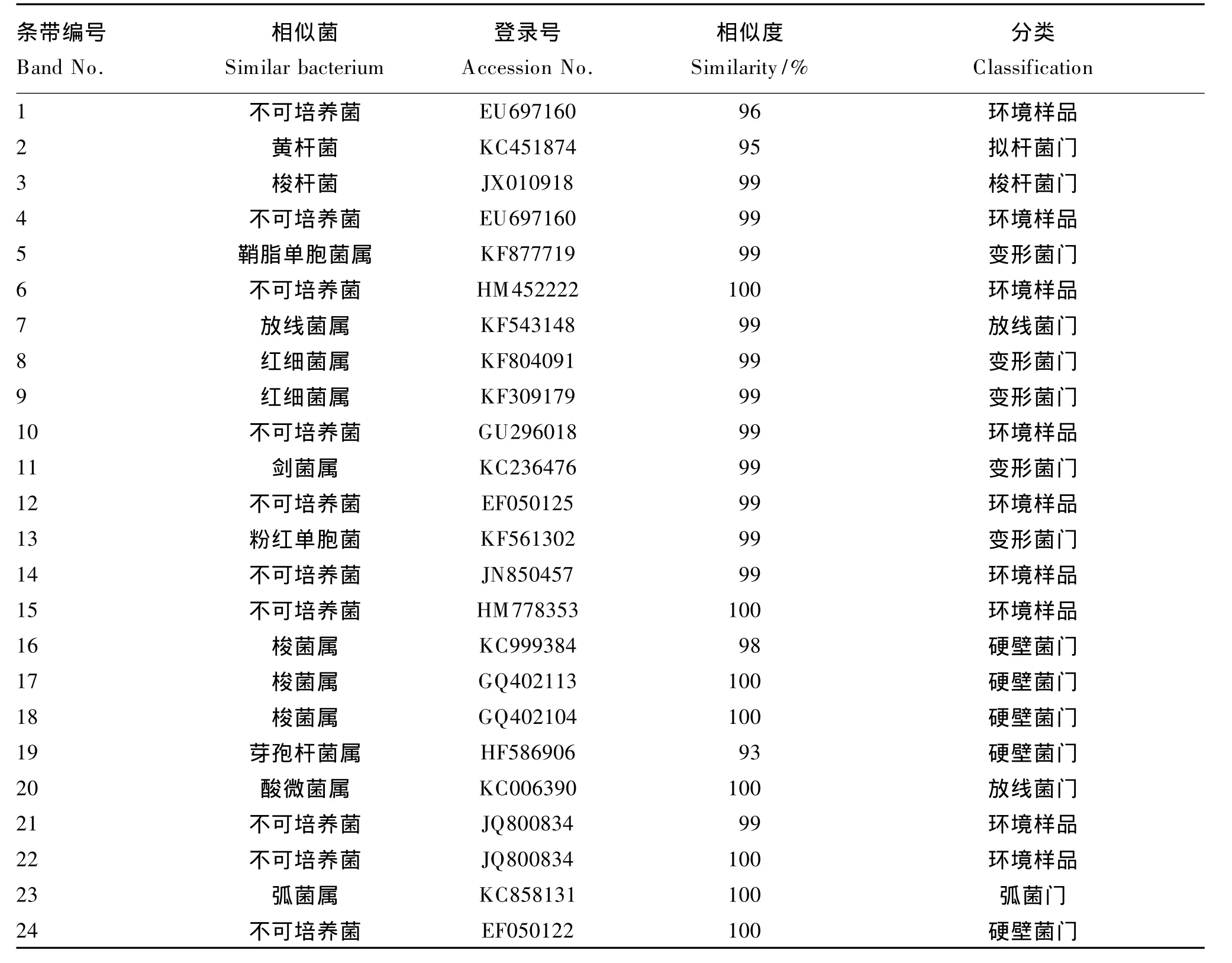
表5 DGGE凝胶条带回收序列分析结果Table 5 The analysis results of DGGE gel band recovery sequences
3 讨 论
3.1 饲料中添加甘露寡糖对团头鲂幼鱼生长性能的影响
基于国内外对甘露寡糖作用机理的研究,Sims等[2]和 Rozeboom 等[3]分别研究证实甘露寡糖在断奶仔猪和育雏鸡上具有抑制有害菌吸附、促进有益菌增殖,以及提高机体免疫力的作用,而国外的一些报道对饲料中添加适宜的甘露寡糖是否能够有效促进水产动物生长性能尚存在较大的争议[11-14]。本试验结果表明,饲料中添加甘露寡糖对团头鲂幼鱼的增重率、饲料系数和成活率均没有显著影响,本研究结果与在哺乳动物动物上的研究结果存在较大差异的原因有3个方面:首先,不同食性鱼类在消化道的长短及消化道微生物组成与哺乳动物之间有很大差异,可能对饲料中甘露寡糖的敏感性不同[15],即使甘露寡糖能够促进有益菌的增殖,但优势益生菌如何促进鱼体的生长有待于进一步研究;其次,动物不同发育阶段也可能是造成差异的重要原因之一[16];再次,任何营养物质或添加物在动物中起作用都需要一定的时间,试验周期太短也可能是甘露寡糖效果没有体现的原因之一。
3.2 饲料中添加甘露寡糖对团头鲂幼鱼抗氧化能力的影响
迄今,关于甘露寡糖对水生动物的作用研究主要集中在免疫反应方面[17-19]。由超氧化物歧化酶和过氧化氢酶等组成的抗氧化酶系统可清除过多的自由基,减少脂质的过氧化损伤,其中超氧化物歧化酶是体内以超氧阴离子自由基(O-2·)为唯一底物的酶类和自由基连锁反应的阻断剂,它可特异性地催化超氧化物自由基歧化为过氧化氢和氧;过氧化氢在过氧化氢酶的作用下生成无毒性的水和氧。因此,检测动物超氧化物歧化酶和过氧化氢酶活性的变化能比较准确地反映机体内的抗氧化状况。本试验结果表明,100、200和400 mg/kg甘露寡糖组的肝脏超氧化物歧化酶和过氧化氢酶活性均显著高于对照组,与王锐等[20]对异育银鲫、刘爱君等[21]对罗非鱼、于艳梅等[22]对黄颡鱼的研究结论相似。丙二醛是脂质过氧化物的主要分解产物,能引起蛋白质、核酸等生物大分子的交联聚合,导致细胞死亡。众所周知,丙二醛含量升高与氧自由基产生过多密切相关,本试验结果表明摄食含100~400 mg/kg甘露寡糖饲料的团头鲂幼鱼的肝脏丙二醛含量较对照组显著降低。这暗示饲料中添加甘露寡糖可以有效提高机体的抗氧化防御能力,使过量活性氧自由基(ROS)在尚未发挥毒性作用前就被消除,从而保持机体ROS的稳态平衡。
3.3 饲料中添加甘露寡糖对团头鲂幼鱼肠道菌群的影响
姚延丹等[23]认为DGGE带谱中的每个条带代表1个可能的细菌类群或可操作分类单元。本研究发现在团头鲂幼鱼肠道中细菌丰富度较高,通过DGGE图谱中的条带数目变化可知,摄食不同含量甘露寡糖饲料的团头鲂肠道菌群生物多样性具有明显的差异性,由此可知,饲料中添加甘露寡糖改变了团头鲂幼鱼原有的肠道微生态环境,即鱼肠道微生态环境易受饲料中甘露寡糖含量的影响,这与在罗非鱼上的研究结果[24-25]一致。杜英男等[26]也发现甘露寡糖能提高动物肠道中双歧杆菌和乳酸杆菌的数量,阻止病原菌的定植。本研究表明,对照组肠道中存在弧菌门,而摄食100、200和400 mg/kg甘露寡糖的幼鱼肠道优势菌为放线菌门、变形菌门、硬壁菌门,这些细菌类群中包含双歧杆菌、芽孢杆菌等益生菌。此外,DGGE图谱分析表明团头鲂幼鱼肠道中变型菌门含量较高,Yang 等[27]和 Kim 等[28]研究分别表明河豚和虹鳟肠道中变型菌门含量丰富,与本研究结果相一致,说明变型菌门是鱼类肠道菌群中的优势种属。研究结果提示,饲料中添加适量甘露寡糖能够促进团头鲂幼鱼肠道内益生菌的增殖,保证正常的微生态平衡和正常的消化道内环境,进而对病原菌入侵有较好的保护作用。
4 结论
①饲料中添加甘露寡糖可提高团头鲂幼鱼的抗氧化能力。
②饲料中添加200~400 mg/kg甘露寡糖可改善团头鲂幼鱼的肠道菌群结构。
[1] 吴淑勤,王亚军.我国水产养殖病害控制技术现状与发展趋势[J].中国水产,2010(8):9-10.
[2] SIMS M D,DAWSON K A,NEWMAN K E,et al.Effects of dietary mannan oligosaccharide,bacitracin methylene disalicylate,or both on the live performance and intestinal microbiology of turkeys[J].Poultry Science,2004,83(7):1148-1154.
[3] ROZEBOOM D W,SHAW D T,TEMPELMAN R J,et al.Effects of mannan oligosaccharide and an antimicrobial product in nursery diets on performance of pigs reared on three different farms[J].Journal of Animal Science,2005,83(11):2637-2644.
[4] 明建华,谢骏,徐跑,等.团头鲂(Megalobrama amblycephala)两种热休克蛋白70(HSP70s)的原核表达、纯化及鉴定[J].海洋与湖沼,2012,43(1):185-191.
[5] 崔红红,刘波,戈贤平,等.肌醇对氨氮应激下团头鲂幼鱼免疫的影响[J].水产学报,2014,38(2):228-236.
[6] 徐磊,刘波,谢骏,等.甘露寡糖对异育银鲫生长性能、免疫及HSP70基因表达的影响[J].水生生物学报,2012,36(4):656-663.
[7] AKRAMI R,RAEZGHI-MANSOUR M,CHITSAZ H,et al.Effect of dietary mannan oligosaccharide on growth performance,survival,body composition and some hematological parameters of carp juvenile(Cyprinus carpio)[J].Journal of Animal Science Advances,2012,2(11):879-885.
[8] STAYKOV Y,SPRING P,DENEV S,et al.Effect of a mannan oligosaccharide on the growth performance and immune status of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture International,2007,15(2):153-161.
[9] DIMITROGLOU A,MERRIFIELD D L,SPING P,et al.Effects of mannan oligosaccharide(MOS)supplementation on growth performance,feed utilisation,intestinal histology and gut microbiota of gilthead sea bream(Sparus aurata)[J].Aquaculture,2010,300(1/2/3/4):182-188.
[10] 李晓,李冰,董玉峰,等.精养团头鲂池塘沉积物微生物群落的结构特征及组成多样性分析[J].水产学报,2014,38(2):218-227.
[11] DIMITROGLOU A,MERRIFIELD D L,MOATE R,et al.Dietary mannan oligosaccharide supplementation modulates intestinal microbial ecology and improves gut morphology of rainbow trout,Oncorhynchus mykiss(Walbaum)[J].Journal of Animal Science,2009,87(10):3226-3234.
[12] GENC M A,AKTASM,GENC E,et al.Effects of dietary mannan oligosaccharide on growth,body composition and hepatopancreas histology of Penaeus semisulcatus(de Haan 1844)[J].Aquaculture Nutrition,2007,13(2):156-161.
[13] DANIELSC L,MERRIFIELD D L,BOOTHROYD D P,et al.Effect of dietary Bacillus spp.and mannan oligosaccharides(MOS)on European lobster(Homarus gammarus L.)larvae growth performance,gut morphology and gut microbiota[J].Aquaculture,2010,304(1/2/3/4):49-57.
[14] GRISDALE-HELLAND B,HELLAND S J,GATLINⅢ D M,et al.The effects of dietary supplementation with mannanoligosaccharide,fructooligosaccharide or galactooligosaccharide on the growth and feed utilization of Atlantic salmon(Salmo salar)[J].Aquaculture,2008,283(1/2/3/4):163-167.
[15] 王红宁.鲤肠道正常菌群的研究[J].水生生物学报,1994,18(4):354-359.
[16] DAVIS M E,MAXWELL C V,BROWN D C,et al.Effect of dietary mannan oligosaccharides and(or)pharmacological additions of copper sulfate on growth performance and immunocompetence of weanling and growing/finishing pigs[J].Journal of Animal Science,2002,80(11):2887-2894.
[17] GU M,MA H M,MAI K S,et al.Effects of dietary βglucan,mannanoligosaccharide and their combinations on growth performance,immunity and resistance against Vibrio splendidus of sea cucumber,Apostichopus japonicus[J].Fish & Shellfish Immunology,2011,31(2):303-309.
[18] TORRECILLAS S,MAKOL A,CABALLERO M J,et al.Immune stimulation and improved infection resistance in European sea bass(Dicentrarchus labrax)fed mannan oligosaccharides[J].Fish & Shellfish Immunology,2007,23(5):969-981.
[19] SANG H M,FOTEDAKAR R,FILER K.Effects of dietary mannan oligosaccharide on the survival,growth,immunity and digestive enzyme activity of freshwater crayfish,Cherax destructor Clark(1936)[J].Aquaculture Nutrition,2011,17(2):e629-e635.
[20] 王锐,刘军,刘辉宇.半乳甘露寡糖对异育银鲫幼鱼生长和非特异性免疫的影响[J].上海水产大学学报,2008,17(4):502-506.
[21] 刘爱君,冷向军,李小勤,等.甘露寡糖对奥尼罗非鱼(Oreochromis niloticus×O.aureus)生长、肠道结构和非特异性免疫的影响[J].浙江大学学报:农业与生命科学版,2009,35(3):329-336.
[22] 于艳梅,吴志新,陈孝煊,等.魔芋甘露寡糖对黄颡鱼非特异性免疫功能及生长的影响[J].华中农业大学学报,2010,29(3):351-355.
[23] 姚延丹,李谷,陶玲,等.复合人工湿地-池塘养殖生态系统细菌多样性研究[J].环境科学与技术,2011,34(7):51-55.
[24] 马相杰,汪立平,赵勇,等.甘露寡糖对罗非鱼幼鱼肠道微生物的影响[J].微生物学通报,2010,37(5):708-713.
[25] 吕慧源,周志刚.饲喂果寡糖对奥尼罗非鱼Oreochromisaurea ×O.nilotica♀肠道菌群、成活率及生长性能的影响[J].动物营养学报,2007,19(6):691-697.
[26] 杜英男,鞠贵春,薛军,等.果聚糖和甘露寡糖对水貂肠道菌群影响的研究[J].经济动物学报,2007,11(2):83-86.
[27] YANG G M,BAO B L,PEATMAN E,et al.Analysis of the composition of the bacterial community in puffer fish Takifugu obscurus[J].Aquaculture,2007,262(2/3/4):183-191.
[28] KIM D H,BRUNT J,AUSTIN B.Microbial diversity of intestinal contents and mucus in rainbow trout(Oncorhynchus mykiss)[J].Journal of Applied Microbiology,2007,102(6):1654-1664.
