合成的西红花糖苷体外抗肿瘤活性研究
2014-12-16胡德凤邢菲菲
张 伶, 陈 柳, 胡德凤, 邢菲菲, 张 宏, 陈 放
(1.中国人民解放军成都军区总医院肿瘤诊治中心放疗科,四川成都610083;2.四川师范大学生命科学学院,四川成都610101;3.四川大学生命科学学院,四川成都610041)
恶性肿瘤居全球死亡原因的第二位,至今仍缺乏有效的治疗方法.西红花属鸢尾科植物.西红花提取物(SE)具有降血压、抗血栓、免疫调节等药理作用.另外,近年研究还发现西红花具有抑制多种恶性肿瘤增殖、诱导细胞凋亡、阻滞细胞周期进程(肝癌、肠癌、前列腺癌、胃癌及宫颈癌等)[1-5]等抗肿瘤活性.其中抗肿瘤活性的主要成分是西红花酸及西红花糖苷[6].然而由于原材料昂贵、理化性质不明确、药物性能稳定性差等原因限制了西红花抗肿瘤应用的发展.然而化学合成的西红花酸和西红花糖苷弥补了以上不足,但其抗肿瘤作用有待证实.本实验首次检测了合成的西红花酸及8种西红花糖苷对多种肿瘤细胞的体外抗肿瘤活性,并初步探讨了其抗瘤机制.
1 材料、试剂与仪器
材料:人结肠癌细胞系 HCT116、HT-29、LOVO、SW480、SW620、人胸腺癌细胞系 MCF-7、人肺癌细胞系A549、人肝癌细胞系BELE-7402由四川师范大学生命科学学院实验室提供.提取SE的西红花原料购于四川中药材有限公司,经四川大学生命科学学院陈放教授鉴定为鸢尾科植物西红花(Saffron)干燥的花茎;合成的西红花糖苷由四川师范大学张宏教授实验室合成并提供,经核磁共振(NMR)及质谱(MS)确定其结构,由HPLC测定其纯度均≥98%(见图1).

试剂:抗人p53单克隆抗体(中国中杉金桥公司);MTT试剂盒(美国Sigma公司).
仪器:酶标仪、Western blot转膜仪(美国Bio-RAD公司);流式细胞仪(美国COULTER公司).
2 实验方法
2.1 西红花有效成分的提取 取西红花干燥柱头30 g,加入300 mL体积分数50%的乙醇,超声提取30 min,过滤,旋转蒸发至无乙醇,冷冻干燥,得西红花提取物(saffron extraction,SE),备用.
2.2 MTT法检测细胞增殖 待测细胞以每孔2.5×103个接种于96孔板.加实验样品(处理药物)100 μL,浓度为 0、0.937 5、1.875、3.75、7.5、15 μM,每组9孔,分别孵育 24、48、72 h.每组及空白取3孔,加20 μL MTT溶液,孵育2 h.弃液,加200 μL DMSO及甘氨酸缓冲液25 μL.酶标仪读取光密度,波长570 nm,记录吸光值分别为 OD0、OD实验、OD空白.计算抑制率 =[(OD0-OD空白)-(OD实验-OD空白)]/(OD0-OD空白).
2.3 流式细胞术检测细胞凋亡和周期 待测细胞接种于6孔板.加浓度为IC50的实验样品2 mL,处理72 h.收集细胞,加体积分数70%的冰乙醇固定,4℃过夜,离心.PBS重悬,离心.加1 mL PI染液,4℃避光30 min.流式细胞仪分析PI荧光直方图,收集数据,Mutlciyde软件计算Gl期、S期和G2期细胞的相对比值.
2.4 Western blot检测p53的表达 待测细胞用RIPA裂解液重悬、超声、离心,收集蛋白样品.测量总蛋白质量浓度:取蛋白样品40 μg,用体积分数12%的分离胶溶液进行SDS聚丙烯酰胺凝胶电泳(SDS-PAGE);260 mA横流湿转90 min,体积分数5%脱脂牛奶封闭,一抗4℃过夜,PBS洗涤3次,二抗避光2 h,TBST洗涤2次.显色液按照1∶1比例避光覆盖PVDF膜,曝光显影.
2.5 统计学方法 数据用SPSS 19.0统计软件分析.各组均数采用方差分析与S-N-K检验,P<0.05表示差异有统计学意义.
3 结果和结论
3.1 合成的西红花糖苷对肿瘤细胞增殖的影响
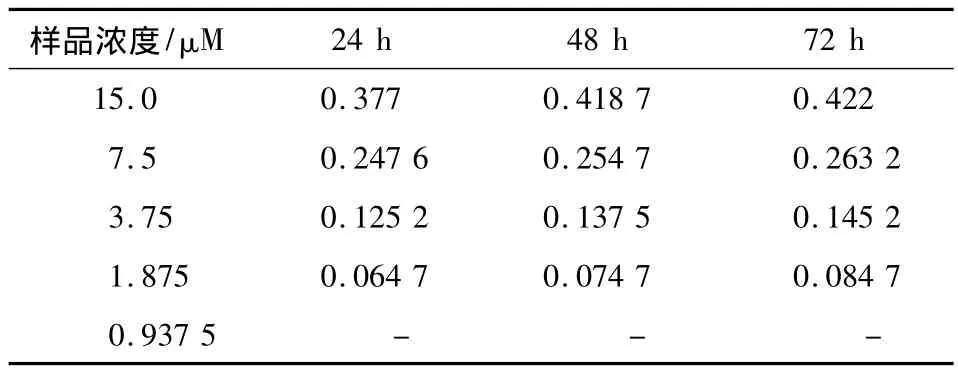
表1 在不同浓度的SE作用下A549细胞系的生长抑制率Table 1 The proliferation inhibition rates of A549 with different concentration of SE

表2 浓度为15 μM的SE及合成的西红花糖苷作用下A549细胞的生长抑制率Table 2 The proliferation inhibition of A549 using concentration of 15 μM SE or synthetic crocins
1)不同浓度的SE及合成的西红花糖苷分别作用于8种肿瘤细胞株HCT116、HT-29、LOVO、SW620、SW480、A549、BELE-7402、MCF-7 不同时间.检测其对细胞增殖的抑制作用,抑制率随实验样品浓度及处理细胞时间的增加而增加,以SE作用于A549细胞为例,当浓度为0.937 5 μM时,细胞的生长和未处理组无明显差异(P>0.05),而当浓度为15 μM时,处理组细胞生长受到抑制,24 h时抑制率为 0.377,48 h为 0.418 7,72 h时为0.422,即随着时间的延长,其抑制率逐渐增加;当不同浓度的SE作用于A549细胞时,发现作用在相同的时间点上其抑制率随SE浓度的增加而增加(表1).另外,与 SE 比较,crocetin、crocin I~III体外抑制肿瘤细胞增殖作用显著,而crocin IV体外抑制作用与SE相当,crocin V~VIII抑制作用略逊于SE(表2).在相同浓度实验样品的作用下,A549细胞生长抑制率依次为crocin I、crocin II>crocetin、crocin III>crocin IV>SE>crocin V>crocin VI>crocin VIII>crocin VII(图2和表2).以上实验说明,crocetin、crocin I~III体外抑制肿瘤增殖作用较SE更加明显,crocin IV体外抑制作用与SE相当.

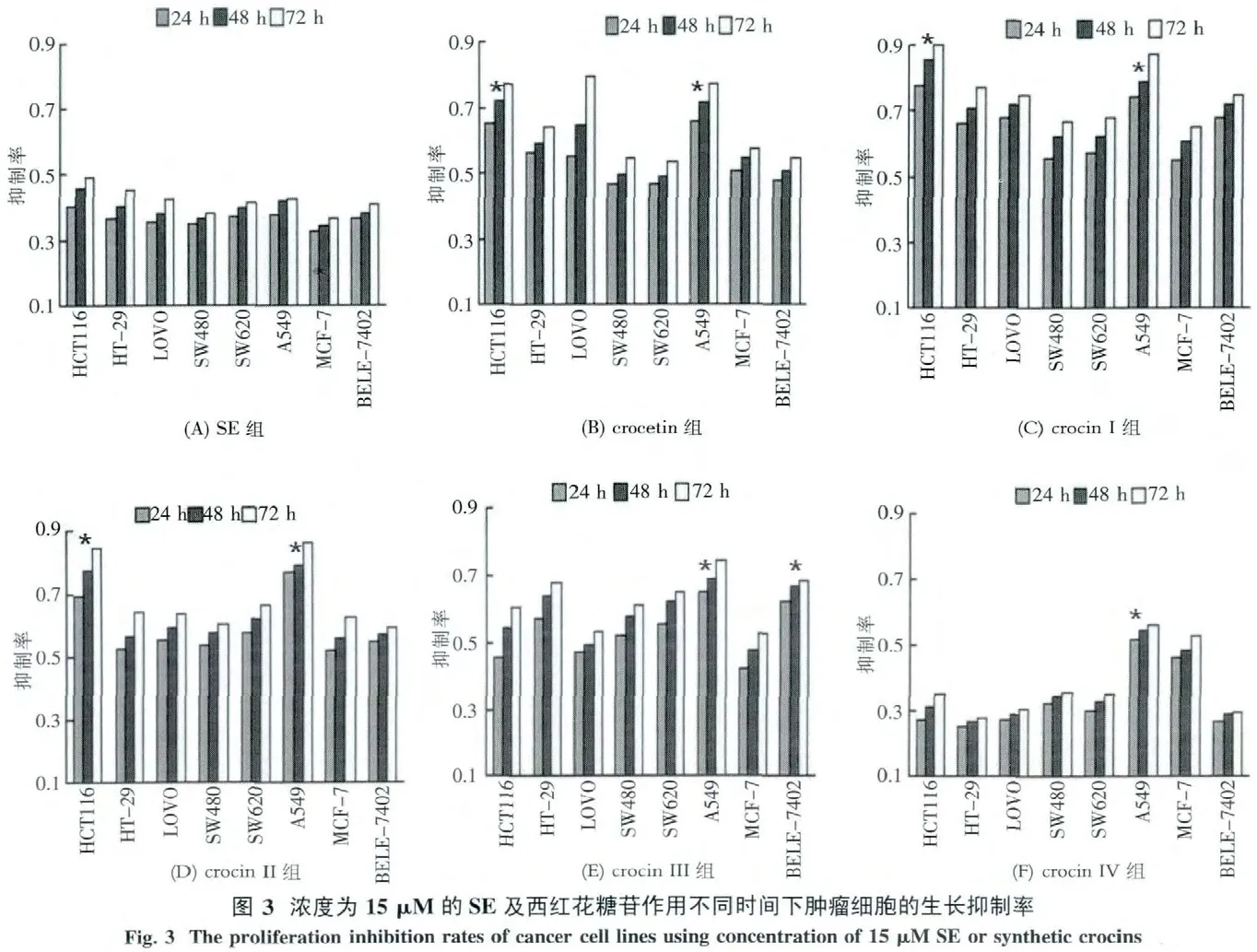
2)用相同浓度的SE及合成的西红花糖苷作用于 8种肿瘤细胞株 HCT116、HT-29、LOVO、SW620、SW480、A549、BELE-7402、MCF-7 相同时间,观察肿瘤细胞对其的敏感性.其中HCT116细胞对 crocetin、crocin I~crocin II的作用较为敏感,A549细胞对crocetin、crocin I~crocin IV作用较为敏感,BELE-7402细胞对crocin III的作用较为敏感,而SE、crocin V~crocin VIII作用于此8种肿瘤细胞均没有较为敏感的菌株(图3,其中“*”表示实验样品抑制该肿瘤细胞的增殖作用与其他肿瘤细胞比较具有统计学意义(P<0.05)).因此以肿瘤抑制作用较为明显的crocetin、crocin I~crocin IV作为观察样品组,用HCT116、A549作为靶细胞,进行抗肿瘤作用机制的相关研究.
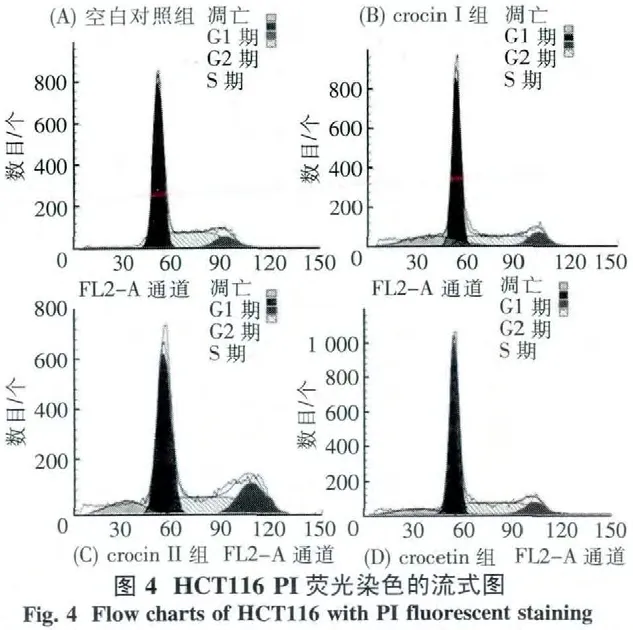
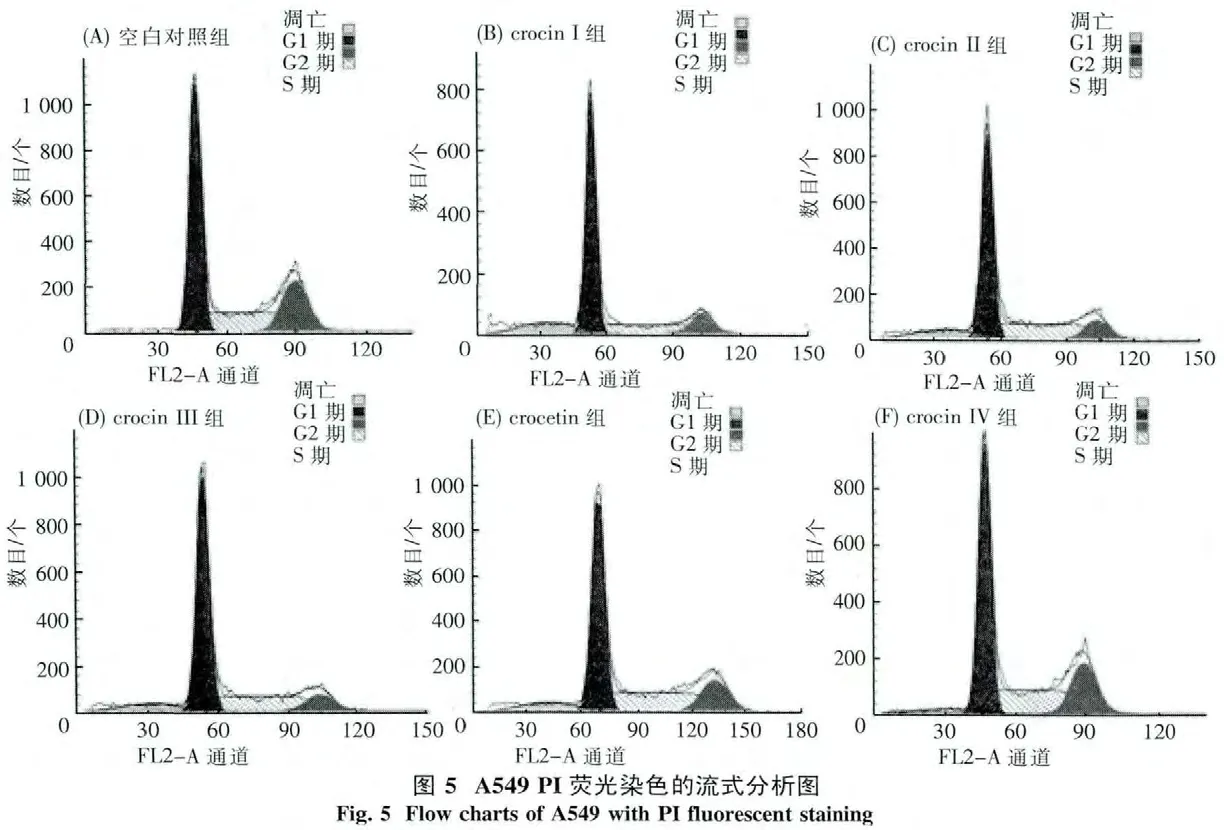
3.2 合成的西红花糖苷对细胞凋亡的影响 根据MTT实验结果,应用流式细胞仪检测合成的crocetin、crocin I~crocin IV 作用下 HCT116、A549细胞的凋亡(表3、图4及5).与未处理的空白对照组比较,crocetin、crocin I和 crocin II可以诱导 HCT116细胞凋亡(图4),crocetin、crocin I和crocin IV则能促进A549细胞的凋亡(图5).
3.3 合成的西红花糖苷对细胞周期的影响 流式细胞仪检测合成的crocetin、crocin I~crocin IV作用下HCT116、A549细胞有丝分裂周期的结果(表4和5).与空白对照组肿瘤细胞比较,在各自浓度为IC50的 crocetin、crocin I~crocin IV 的作用下,HCT-116、A549G2期的细胞比例明显减少,G1/G2期细胞比例明显增加,较多肿瘤细胞生长停滞在G1期.以上数据说明西红花糖苷可能对肿瘤细胞分裂周期中相关蛋白质的合成具有抑制作用.

表3 HCT116、A549在合成的西红花糖苷作用下的凋亡率Table 3 The apoptosis rates of HCT116 and A549 with synthesis crocins %

表4 HCT116在合成的西红花糖苷作用下的细胞周期情况Table 4 The cell cycle process of HCT-116 with synthetic crocins %

表5 A549在合成的西红花糖苷作用下的细胞周期情况Table 5 The cell cycle process of A549 with synthetic crocins %
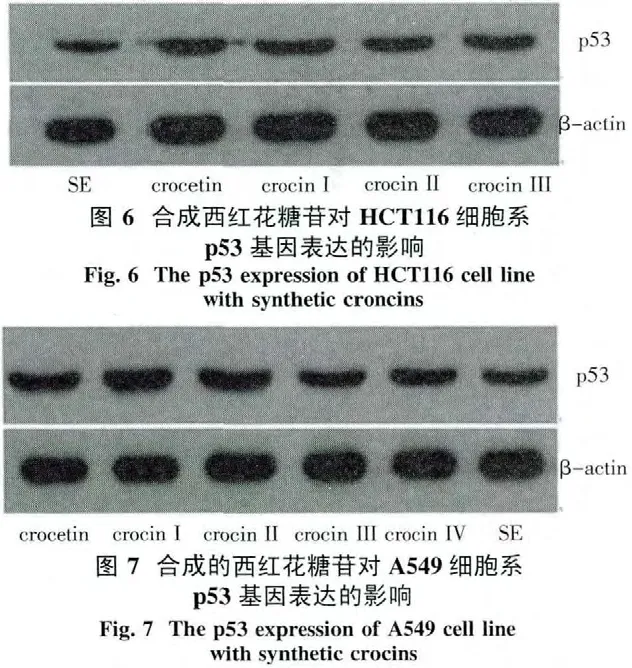
3.4 合成的西红花糖苷对p53基因表达的影响p53是对细胞周期和凋亡起关键作用的抑癌基因.本实验给予浓度为IC50的SE及合成的西红花糖苷药物作用于HCT116、A549肿瘤细胞.Western blot检测表明,与 SE比较,经crocetin、crocin I~crocin IV处理后,p53基因表达明显增加(图6、图7).因此,合成的西红花糖苷诱导HCT116、A549细胞凋亡及细胞周期进程阻滞的机制可能与促进p53蛋白的表达有关.
4 讨论
近年不少研究人员发现西红花主要成分具有潜在的抗肿瘤活性,但诸多原因限制了西红花的进一步研究及开发.本实验发现,与西红花提取物SE比较,合成的crocetin、crocin I~crocin III在体外可以显著抑制肿瘤细胞的增殖.另外,合成的西红花糖苷能促进细胞凋亡,阻滞细胞于有丝分裂G1期,减少G2期肿瘤细胞的DNA合成;其抗肿瘤机制可能与上调p53表达相关.
SE中的主要成分有西红花酸、西红花素、西红花酸二甲酯等,有降血脂、抗氧化、兴奋子宫、活血等功效[7].另外国内外实验证明,西红花提取物可在体内外抑制多种肿瘤细胞(如肝癌、肠癌、胃癌、前列腺癌、宫颈癌、乳腺癌等)[1-5,8]增殖,诱导细胞凋亡,阻滞细胞周期进程,抑制DNA和RNA合成.而在肿瘤发生发展过程中发挥重要负性作用的主要物质是西红花酸及西红花糖苷[6].本实验中合成的西红花糖苷具有相似的抗癌活性,且crocetin、crocetin I~III抑制细胞增殖作用优于SE,该结果为替代SE,进一步研发抗癌新药提供了理论依据.
合成的西红花糖苷作用于5种不同的大肠癌细胞,其敏感依次为:HCT116(p53野生型)>LOVO(p53野生型)、HT-29(p53突变型)>SW480、SW620(p53突变型);而西红花糖苷调控HCT116细胞周期停滞在G1期,诱导细胞凋亡,同时p53的表达也有不同程度的上调.同样,H.H.Aung等[9]也发现,在SE或提取的crocins作用下,HCT116的生长较SW480、HT-29受到明显抑制.其机制为p53野生型及突变型肿瘤细胞分别通过p53依赖的及 p53 非依赖途径激活 p21WAF1/Cip1[10-11],后者抑制细胞周期依赖性激酶(CDKS)或生长增殖核抗原(PCNA)活性从而调控细胞周期于G1期.另外,研究表明SE可诱导两种同源的HCT116(HCTp53阳性和HCTp53阴性)细胞凋亡及胞内DNA损伤,但死亡细胞碎片的自噬延迟诱导HCTp53阴性细胞凋亡[2].因此,肿瘤细胞的p53状态一定程度地影响着西红花对其的细胞周期进程及细胞凋亡.但是否完全适用于合成的西红花糖苷,以及其具体的机制等仍需进一步研究.
西红花具有潜在的抗肿瘤活性,且对正常细胞的毒性很小[5,9],是极有应用前景的抗癌药物.而与SE比较,合成的西红花糖苷用于肿瘤治疗具有如下优势:1)量:目前,西红花稀少,价格昂贵,有“植物黄金”之称[12];而化学合成可批量得到西红花糖苷,成本低廉.2)理化性质:与SE比较,合成的西红花糖苷成分单一,化学结构较简单,理化性质清楚,药物性能稳定,有利于分析其各成分的作用.3)抗肿瘤活性:可以通过化学合成选择抗癌活性显著的药物.本研究创新性地选择出较SE具有更强体外抗肿瘤活性的合成的西红花糖苷,并初步探讨了其抗肿瘤机制,为探寻更理想的西红花类抗肿瘤药物提供了体外研究的依据.
[1]Amin A,Hamza A A,Bajbouj K,et al.Saffron:a potential candidate for a novel anticancer drug against hepatocellular carcinoma[J].Hepatology,2011,54(3):857-867.
[2]Bajbouj K,Schulze-Luehrmann J,Diermeier S,et al.The anticancer effect of saffron in two p53 isogenic colorectal cancer cell lines[J].BMC Complement Altern Med,2012,12:69.
[3]Samarghandian S,Shabestari M M.DNA fragmentation and apoptosis induced by safranal in human prostate cancer cell line[J].Indian J Urol,2013,29(3):177-183.
[4]Bathaie S Z,Miri H,Mohagheghi M A,et al.Saffron aqueous extract inhibits the chemically-induced gastric cancer progression in the Wistar Albino Rat[J].Iran J Basic Med Sci,2013,16(1):27-38.
[5]Abdullaev F I,Espinosa-Aguirre J J.Biomedical properties of saffron and its potential use in cancer therapy and chemoprevention trials[J].Cancer Detect Prev,2004,28:426-432.
[6]张宏,张俊国,张伶,等.西红花有效成分研究进展[J].化学研究与应用,2009,21(6):794-800.
[7]胡江宁,姚德中,章江生,等.西红花抗肿瘤作用的研究进展[J].安徽农业科学,2014,42(3):699-701,703.
[8]Mousavi S H,Tavakkol-Afshari J,Brook A,et al.Role of caspases and Bax protein in saffron-induced apoptosis in MCF-7 cells[J].Food Chem Toxicology,2009,47(8):1909-1913.
[9]Aung H H,Wang C Z,Ni M,et al.Crocin from Crocus sativus possesses significant anti-proliferation effects on human colorectal cancer cells[J].Exp Oncol,2007,29:175-180.
[10]Zhong Y J,Shi F,Zheng X L,et al.Crocetin induces cytotoxicity and enhances vincristine-induced cancer cell death via p53-dependent and-independent mechanisms[J].Acta Pharmacologica Sinica,2011,32:1529-1536.
[11]Li C Y,Huang W F,Wang Q L,et al.Crocetin induces cytotoxicity in colon cancer cells via p53-independent mechanisms[J].Asian Pacific J Cancer Prev,2012,13:3757-3761.
[12]张宏.西红花有效成分-西红花糖苷分离方法和机理的研究及应用[D].成都:四川大学,2001.
